Microsoft Word Herceptin repack PI-Neoadjuvant and CDS 19.0 safety-Clean.docx
|
|
|
- 樟 任
- 5 years ago
- Views:
Transcription
1 核准日期 :2009 年 07 月 31 日修改日期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 2015 年 01 月 26 日 2015 年 11 月 04 日 2016 年 04 月 12 日 2017 年 05 月 11 日 2018 年 07 月 04 日 2018 年 07 月 31 日 2019 年 02 月 19 日 注射用曲妥珠单抗说明书 请仔细阅读说明书并在医师指导下使用警告心功能不全, 输注反应, 肺部反应和胚胎毒性心功能不全曲妥珠单抗会导致亚临床和临床心力衰竭, 其发生率和严重程度在曲妥珠单抗合并蒽环类抗生素治疗的患者中最高 在给予曲妥珠单抗治疗前以及治疗过程中需对左心室功能进行评估 在临床显著的左心室功能下降转移性乳腺癌患者和辅助治疗患者中, 应停止曲妥珠单抗治疗 输注反应 ; 肺部反应曲妥珠单抗会导致严重的致命的输注反应和肺部反应 大多数情况下, 症状发生在曲妥珠单抗输注过程中或 24 小时内 对于发生呼吸困难或临床显著的低血压患者, 应当立即停止输注曲妥珠单抗, 并对患者进行监控直至症状完全消失 发生过敏 血管性水肿 间质性肺炎或者急性呼吸窘迫综合征的患者应停止输注 胚胎毒性孕期使用曲妥珠单抗会导致羊水过少及其造成肺发育不全 骨骼异常和新生儿死亡 向患者提示这些风险以及采取有效的避孕措施的必要性 1 / 45
2 药品名称 通用名 : 注射用曲妥珠单抗 商品名 : 赫赛汀 Herceptin 英文名 : Trastuzumab Injection 汉语拼音 :Zhusheyong Qutuozhu Dankang 成份 活性成份 : 曲妥珠单抗曲妥珠单抗是一种重组 DNA 衍生的人源化单克隆抗体, 是由悬浮培养于无菌培养基中的哺乳动物细胞 ( 中国仓鼠卵巢细胞 CHO) 生产的, 纯化过程包括特定的病毒灭活和去除步骤, 采用的是用亲合色谱法和离子交换法 稀释液为含 1.1% 苯甲醇的 20ml 灭菌注射用水 ( 以下称稀释液 ) 赋形剂 :L- 盐酸组氨酸,L- 组氨酸,α,α- 海藻糖二水合物, 聚山梨醇酯 20 性状 每瓶含浓缩曲妥珠单抗粉末 440mg, 为白色至淡黄色块状疏松体 溶解后为无色至淡黄色, 澄清至微乳光溶液, 供静脉输注用 溶解后曲妥珠单抗的浓度为 21mg/ml 适应症 转移性乳腺癌 : 本品适用于 HER2 阳性的转移性乳腺癌 : 作为单一药物治疗已接受过 1 个或多个化疗方案的转移性乳腺癌 ; 与紫杉醇或者多西他赛联合, 用于未接受化疗的转移性乳腺癌患者 早期乳腺癌 : 本品适用于 HER2 阳性的早期乳腺癌 : 接受了手术 含蒽环类抗生素辅助化疗和放疗 ( 如果适用 ) 后的单药辅助治疗 多柔比星和环磷酰胺化疗后序贯本品与紫杉醇或多西他赛的联合辅助治疗 与多西他赛和卡铂联合的辅助治疗 与化疗联合新辅助治疗, 继以辅助治疗, 用于局部晚期 ( 包括炎性 ) 或者肿瘤直径 >2cm 的乳腺癌 转移性胃癌 : 本品联合卡培他滨或 5- 氟尿嘧啶和顺铂适用于既往未接受过针对转移性疾病治疗的 HER2 阳性的转移性胃腺癌或胃食管交界腺癌患者 2 / 45
3 曲妥珠单抗只能用于 HER2 阳性的转移性胃癌患者,HER2 阳性的定义为使用已验证的检测方法得到的 IHC3+ 或 IHC2+/FISH+ 结果 规格 440 mg(20 ml)/ 瓶 用法用量 请按 输液准备 的要求对复溶后药品进行充分稀释后使用 请勿静推或静脉快速注射 在本品治疗前, 应进行 HER2 检测 使用其他任何生物制品替代需征得处方医师的同意 本品应通过静脉输注给药 早期和转移性乳腺癌每周给药方案初始负荷剂量 : 建议本品的初始负荷剂量为 4mg/kg 静脉输注 90 分钟以上 维持剂量 : 建议本品每周用量为 2mg/kg 如果患者在首次输注时耐受性良好, 则后续输注可改为 30 分钟 3 周给药方案初始负荷剂量为 8mg/kg, 随后 6mg/kg 每三周给药一次 且重复 6mg/kg 每三周给药一次时输注时间约为 90 分钟 如果患者在首次输注时耐受性良好, 后续输注可改为 30 分钟 转移性胃癌建议采用每三周一次的给药方案, 初始负荷剂量为 8mg/kg, 随后 6mg/kg 每三周给药一次 首次输注时间约为 90 分钟 如果患者在首次输注时耐受性良好, 后续输注可改为 30 分钟 维持治疗直至疾病进展 疗程 转移性乳腺癌患者使用曲妥珠单抗治疗直至疾病进展或不可耐受的毒性 乳腺癌早期患者使用曲妥珠单抗治疗 1 年或至疾病复发或不可耐受的毒性 ( 视何者为先 ) 不建议 EBC 延长治疗超过 1 年 转移性胃癌患者使用曲妥珠单抗治疗至疾病进展或不可耐受的毒性 剂量调整 输注反应 对发生轻至中度输注反应患者应降低输注速率 3 / 45
4 对呼吸困难或临床明显低血压患者应中断输注 对发生重度和危及生命的输注反应患者 : 强烈建议永久停止曲妥珠单抗的输注 心脏毒性曲妥珠单抗开始治疗前应进行左室射血分数 (LVEF) 的检测, 治疗期间也须经常密切监测 LVEF 出现下列情况时, 应停止曲妥珠单抗治疗至少 4 周, 并每 4 周检测 1 次 LVEF LVEF 较治疗前绝对数值下降 16% LVEF 低于该检测中心正常范围并且 LVEF 较治疗前绝对数值下降 10% 4~8 周内 LVEF 回升至正常范围或 LVEF 较治疗前绝对数值下降 15%, 可恢复使用曲妥珠单抗 LVEF 持续下降 (>8 周 ), 或者 3 次以上因心脏毒性而停止曲妥珠单抗治疗, 应永久停止使用曲妥珠单抗 减量临床试验中未减量使用过曲妥珠单抗 在化疗导致的可逆的骨髓抑制过程中患者仍可继续使用本品, 是否减少或持续使用化疗药剂量需特别指导, 在此期间应密切监测患者是否出现中性粒细胞减少并发症 漏用如果患者漏用曲妥珠单抗未超过一周, 应尽快对其给予常规维持剂量的曲妥珠单抗 ( 每周一次的给药方案 :2 mg/kg; 每三周一次的给药方案 :6 mg/kg), 不需等待至下一治疗周期 此后, 对于每周一次或每三周一次的给药方案应分别在 7 天或者 21 天后给予维持剂量的曲妥珠单抗 如果患者漏用曲妥珠单抗已超过一周, 应尽快重新给予初始负荷剂量的曲妥珠单抗 ( 每周一次的给药方案 :4mg/kg; 每三周一次的给药方案 :8mg/kg), 输注时间约为 90 分钟以上 此后, 对于每周一次或每三周一次的给药方案应分别在 7 天或者 21 天后给予维持剂量的曲妥珠单抗 ( 每周一次的给药方案 :2 mg/kg; 每三周一次的给药方案 :6 mg/kg) 输液准备配置过程中, 应当仔细处理曲妥珠单抗 避免产生过多的泡沫, 不要摇晃配好的曲妥珠单抗溶液, 以免影响从药瓶中吸取的曲妥珠单抗的剂量 溶液配制应采用正确的无菌操作 每瓶注射用曲妥珠单抗应由同时配送的稀释液稀释, 配好的溶液可多次使用, 曲妥珠单抗的浓度为 21mg/ml, ph 值约 6.0 配制成的溶液 4 / 45
5 为无色至淡黄色的透明液体 溶液注射前应目测有无颗粒产生和变色点 配制好的 溶液超过 28 天应丢弃 注射用水 ( 未提供 ) 也可以用于单剂量输液准备 其它液体不能用于配制溶液 应避免使用配送的稀释液之外的溶剂, 除非有禁忌症 对苯甲醇过敏的患者, 曲妥 珠单抗必须使用无菌注射用水配制 用无菌注射器将 20mL 注射用水在装有曲妥珠单抗冻干粉的西林瓶中缓慢注 入, 直接注射在冻干药饼中 轻轻旋动药瓶以帮助复溶 不得震摇! 配制好的溶液可能会有少量泡沫, 将西林瓶静止大约 5 分钟 配置溶液的稀释 根据曲妥珠单抗初始负荷剂量 4mg/kg 或之后每 1 周 2mg/kg 维持剂量计算所需 溶液的体积 : 所需溶液的体积 = 体重 (Kg) 剂量 (4mg/Kg 负荷量或 2mg/Kg 维持量 ) 21(mg/ml, 配置好溶液的浓度 ) 根据曲妥珠单抗初始负荷剂量 8mg/kg 或之后每 3 周 6mg/kg 维持剂量计算所需 溶液的体积 : 所需溶液的体积 = 体重 (Kg) 剂量 (8mg/Kg 负荷量或 6mg/Kg 维持量 ) 21(mg/ml, 配置好溶液的浓度 ) 所需的溶液量从小瓶中吸出后加入 250ml 0.9% 氯化钠输液袋中, 不可使用 5% 的葡萄糖液 ( 见配伍禁忌 ) 输液袋轻轻翻转混匀, 防止气泡产生 所有肠外用药 均应在使用前肉眼观察有无颗粒产生或变色 一旦输注液配好应立即使用 如果在 无菌条件下稀释的, 可在 2~8 冷藏保存 24 小时 配伍禁忌 使用聚氯乙烯 聚乙烯或聚丙烯袋未观察到本品失效 不能使用 5% 的葡萄糖溶液, 因其可使蛋白聚集 本品不可与其它药混合或稀释 未使用的药品 / 过期药品的处理 应最大程度地减少药品在环境中的释放 不可将药物丢弃于废水或生活垃圾中 如当地具备药物回收系统, 应使用该系统对未使用的药品或过期药品进行回收 应 根据当地的要求处理未使用 / 过期药品 应严格遵守以下几个有关使用和处置注射器和其他医用利器的要求 : 注射器和针头不能重复使用 用过的针头和注射器保存在利器收集盒中 ( 防刺穿的一次性容器 ) 5 / 45
6 不良反应 以下不良反应会在说明书的其他部分进行更详细的讨论 : 心功能不全 ( 见 注意事项 ) 输注反应 ( 见 注意事项 ) 胚胎毒性 化疗引起的中性粒细胞减少症加重 ( 见 注意事项 ) 肺部反应 ( 见 注意事项 ) 曲妥珠单抗辅助治疗乳腺癌及用于转移性乳腺癌治疗中最的不良反应是 : 发热 恶心 呕吐 输注反应 腹泻 感染 咳嗽加重 头痛 乏力 呼吸困难 皮疹 中性粒细胞减少症 贫血和肌痛 需要中断或停止曲妥珠单抗治疗的不良反应包括 : 充血性心力衰竭 左心室功能明显下降 重度的输注反应和肺部反应 曲妥珠单抗用于转移性胃癌治疗中, 最的不良反应 ( 10%), 即与化疗组相比曲妥珠单抗组增加 5% 的不良反应是 : 中性粒细胞减少症 腹泻 乏力 贫血 口腔炎 体重减轻 上呼吸道感染 发热 血小板减少症 粘膜炎症 鼻咽炎和味觉障碍 除了疾病进展外, 最的导致停止治疗的不良反应是感染 腹泻和发热性中性粒细胞减少症 临床试验中的不良反应表 1 总结了在关键临床试验中曲妥珠单抗单用或与其他化疗药物联用所报告的不良反应 所有术语都基于关键临床试验中的最高发生率 由于曲妥珠单抗常与其他化疗和放疗联合使用, 因此很难确定不良事件与特定药物 / 放疗的因果关系 每种药物不良反应的相应频率类别基于以下惯例 : ( 1/10) ( 1/100 至 <1/10) 偶见( 1/1,000 至 <1/100) 罕见( 1/10,000 至 <1/1,000) 十分罕见 (<1/10,000) 未知( 无法从现有数据估测 ) 在每种发生率分类内, 不良反应按发生率由高到低的顺序列出 表 1 在临床试验中接受赫赛汀治疗的患者中发生的药物不良反应总结 器官系统分类 不良反应 * 发生率 感染及侵染类疾病 鼻咽炎 感染 流感 咽炎 鼻窦炎 鼻炎 上呼吸道感染 尿道感染 血液及淋巴系统疾病 贫血 6 / 45
7 血小板减少症 发热性中性粒细胞减少症 白细胞计数减少 / 白细胞减少症 中性粒细胞减少症 免疫系统疾病 超敏反应 代谢与营养类疾病 体重下降 体重增加 食欲下降 精神病类 失眠 抑郁 焦虑 各类神经系统疾病 头晕 头痛 感觉异常 感觉减退 味觉障碍 张力亢进 周围神经病 嗜睡 眼器官疾病 多泪 结膜炎 耳与迷路类疾病 耳聋 偶见 心脏器官疾病 射血分数下降 +1 室上性快速性心律失常 + 心力衰竭 ( 充血性 ) 心肌病 1 心悸 血管与淋巴管类疾病 淋巴水肿 潮热 +1 低血压 高血压 血管扩张 呼吸系统 胸及纵隔疾 + 呼吸困难 病 鼻衄 口咽疼痛 咳嗽 鼻漏 哮喘 肺病 + 胸腔积液 感染性肺炎 非感染性肺炎 偶见 哮鸣 偶见 胃肠系统疾病 腹泻 呕吐 7 / 45
8 恶心腹痛消化不良便秘口腔炎 肝胆系统疾病 肝细胞损伤 黄疸 罕见 皮肤与皮下组织类疾病红斑 皮疹 脱发 手足综合征 指甲病变 痤疮 皮炎 皮肤干燥 多汗症 斑丘疹 瘙痒 甲折断 荨麻疹 偶见 肌肉骨骼与结缔组织疾 关节痛 病 肌痛 关节炎 背痛 骨痛 肌痉挛 颈痛 肢体疼痛 全身性疾病与给药部位 乏力 各种反应 胸痛 寒战 疲劳 流感样疾病 输注相关反应 疼痛 发热 外周性水肿 粘膜炎 水肿 不适 各类损伤 中毒及手术并发症 指甲毒性 * 药物不良反应 (ADR) 确定为在至少一项主要随机临床试验中与对照组相比发生率相差 至少为 2% 的不良事件 此表中的 ADRs 是按其在所有主要临床试验中的最高发生率归入 到适当的系统器官分类 (SOC) 分类中 8 / 45
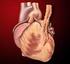
9 + 1 表示已有报道这些不良反应与死亡结局有关 表示不良反应主要与输注相关反应有关 尚未获得这些不良反应的具体百分比 心功能不全 充血性心力衰竭 (NYHA 分级 II-IV) 是曲妥珠单抗不良反应, 会导致致 命结果 接受曲妥珠单抗治疗患者中, 观察到心功能不全的体征和症状, 如呼吸困 难 端坐呼吸 咳嗽增加 肺水肿 S3 奔马律或心室射血分数减少 ( 参见 注意事 项 ) 转移性乳腺癌 在关键性转移性试验中, 根据以往心功能不全定义的标准, 与紫杉醇单药治疗 组 (1% 4%) 相比, 曲妥珠单抗 + 紫杉醇组中患者的发病率为 9% - 12%, 在曲妥珠 单抗单药治疗组中, 发病率为 6% 9% 曲妥珠单抗 + 蒽环类抗生素 / 环磷酰胺治疗 组 (27%) 中患者出现心功能不全的比率最高, 并显著高于蒽环类抗生素 / 环磷酰胺 治疗组 (7% 10%) 在对心功能前瞻性监测的后续试验中, 与多西他赛单药治疗 组 (0%) 相比, 曲妥珠单抗 + 多西他赛治疗组中患者出现有症状的心力衰竭的发病 率为 2.2% 这些试验中, 出现心功能不全的大部分患者 (79%) 接受充血性心力衰 竭标准治疗后均有所改善 早期乳腺癌 ( 辅助治疗 ) 乳腺癌辅助治疗临床试验中, 连续监测心功能 (LVEF) 在 BO16348 试验中, 中 位随访时间为 12.6 个月 ( 观察组 12.4 个月, 曲妥珠单抗治疗 1 年组 12.6 个月 ); 在 NSABP B31 和 NCCTG N9831 试验中, 中位随访时间 AC-T 组为 7.9 年,AC-TH 组为 8.3 年 在 NSABP B31 和 NCCTG N9831 中, 所有经随机分组且有 AC 后左心 室射血分数评估的患者中,6% 的患者在 AC 方案化疗后因出现心功能不全 (AC 方 案化疗结束时 LVEF < LLN 或相对基线值降低 16 %) 而没有开始曲妥珠单抗治 疗 在 NSABP B31 和 NCCTG N9831 中, 曲妥珠单抗治疗开始后, 曲妥珠单抗 + 紫 杉醇组的新发的剂量限制性心功能不全发生率高于紫杉醇单药组, 在 BO16348 试验 中, 曲妥珠单抗单药治疗一年时新发的剂量限制性心功能不全发生率高于安慰剂组 ( 见表 2, 图 1 图 2) AC-TH 组与在中位 2.0 年随访时进行的分析相比, 采用 左心室射血分数测量的新发心脏功能不全的每例患者发生率仍相似 该分析亦显示 左心室功能不全的可逆性,AC - TH 组发生有症状的充血性心力衰竭的患者中, 64.5% 在最近随访时无症状,90.3% 的左心室射血分数完全或部分恢复 表 2 a NSABP B31 NCCTG N9831 BO16348 和 BCIRG006 试验中新发的心功能不全 ( 检测指标 LVEF) 的患者比例 LVEF <50% 且相对于基线绝对下降 LVEF 绝对下降 LVEF <50% 下降 10% 下降 16% <20% 且 10% 20% 9 / 45
10 试验 NSABP B31 和 NCCTG N9831 b, c AC TH 23.1% 18.5% 11.2% 37.9% 8.9% (n=1856) (428) (344) (208) (703) (166) AC T 11.7% 7.0% 3.0% 22.1% 3.4% (n=1170) (137) (82) (35) (259) (40) 试验 BO16348 d 曲妥珠单抗 8.6% 7.0% 3.8% 22.4% 3.5% (n=1678) (144) (118) (64) (376) (59) 观察 2.7% 2.0% 1.2% 11.9% 1.2% (n=1708) (46) (35) (20) (204) (21) 试验 BCIRG006 e TCH 8.5% 5.9% 3.3% 34.5% 6.3% (n=1056) (90) (62) (35) (364) (67) AC TH 17% 13.3% 9.8% 44.3% 13.2% (n=1068) (182) (142) (105) (473) (141) AC T 9.5% 6.6% 3.3% 34% 5.5% (n=1050) (100) (69) (35) (357) (58) a 对于试验 NSABP B31 NCCTG N9831 和 BO16348, 从曲妥珠单抗治疗开始起计算事件 对于试 验 BCIRG006, 从随机分组日起计算事件 b 试验 NSABP B31 和试验 NCCTG N9831 方案 : 多柔比星和环磷酰胺序贯紫杉醇 (AC T) 或紫杉 醇加曲妥珠单抗 (AC TH) c 试验 NSABP B31 和试验 NCCTG N9831 合并的 AC TH 组中位随访时间为 8.3 年 d 一年曲妥珠单抗治疗组的中位随访时间为 12.6 个月 e 试验 BCIRG006 方案 : 多柔比星和环磷酰胺序贯多西他赛 (AC T) 或紫杉醇加曲妥珠单抗 (AC TH); 多西他赛和卡铂加曲妥珠单抗 (TCH) 10 / 45
11 图 1 NSABP B31 和 NCCTG N9831: 首次出现 LVEF 较基线下降 10% 并且绝对值低于 50% 的累积发生率, 死亡为竞争性风险事件 开始紫杉醇 + 曲妥珠单抗治疗的时间 ( 年 ) ---AC T AC T+H T: 紫杉醇 H: 曲妥珠单抗时间 0 表示开始紫杉醇或紫杉醇 + 曲妥珠单抗治疗的时间 图 2 BO16348 试验 : 首次出现 LVEF 较基线下降 10% 并且绝对值低于 50% 的累积发生率, 死亡为竞争性风险事件 时间 0 表示随机分组时的日期 随机开始时间 ( 月 ) --- 观察 曲妥珠单抗 1 年治疗 11 / 45
12 图 3 试验 BCIRG006:LVEF 相对于基线首次下降 10% 且降至低于 50% 伴死亡为竞争性风险事件的时间的累积发生率 时间 0 表示随机分组时的日期 在曲妥珠单抗联合化疗的三项关键性临床试验中, 单独化疗患者中 3/4 级心功能不全 ( 有症状的充血性心力衰竭 (CHF)) 发生率与紫杉烷类序贯曲妥珠单抗治疗的患者相似 ( %) 紫杉烷加曲妥珠单抗联合治疗患者发生率最高(2.0%) 第 3 年, 接受 AC P( 多柔比星 + 环磷酰胺之后用紫杉醇治疗 )+ H( 曲妥珠单抗 ) 治疗患者心脏不良事件发生率达 3.2%, 而 AC P 治疗组患者为 0.8% 5 年随访期未见累计心脏不良事件发病率增加 在 5.5 年时,AC D( 多柔比星 + 环磷酰胺之后用多西他赛 ) AC DH( 多柔比星 + 环磷酰胺, 之后用多西他赛 + 曲妥珠单抗 ) 和 DCarbH( 多西他赛 卡铂和曲妥珠单抗 ) 治疗组有症状的心脏事件或 LVEF 事件分别为 1.0% 2.3% 和 1.1% 对于有症状的 CHF(NCI-CTC 3-4 级 ),AC D AC DH 和 DCarbH 治疗组 5 年发生率分别为 0.6% 1.9% 和 0.4% AC D 与 DCarbH 组患者发生有症状的心脏事件的整体风险较低并且相似 ; 相对 AC D 和 DCarbH 治疗组,AC DH 治疗组发生有症状的心脏不良事件的风险增加, 表现为有症状的心脏不良事件或 LVEF 事件累计发生率持续增至 2.3%, 而两个对照治疗组 (AC D 和 DCarbH) 约为 1% 中位随访期 12 个月的结果在 1 年治疗组中, 完成辅助化疗后接受曲妥珠单抗治疗的患者出现 NYHA III-IV 级心力衰竭的比率为 0.6% 中位随访期 3.6 年后, 接受曲妥珠单抗治疗一年后的重度 CHF 和左心室功能不全发生率分别为 0.8% 和 9.8% 在研究 BO16348 中, 中位随访期 8 年的结果, 接受曲妥珠单抗治疗一年后的重度 CHF(NYHA III-IV 级 ) 发生率为 0.8%, 轻度症状性和无症状性心室功能不全发生率为 4.6% 12 / 45
13 曲妥珠单抗治疗患者中,71.4% 重度 CHF 可逆 ( 定义为事件发生后至少连续两 次测定 LVEF 值 50%);79.5% 轻症和无症状的左室功能不全的患者为可逆 约 17% 心功能不全相关的不良事件终点发生于曲妥珠单抗治疗结束后 在 NSABP B-31 研究和 NCCTG N9831 研究的联合分析中, 对 AC PH 组 ( 多 柔比星 + 环磷酰胺, 之后用紫杉醇 + 曲妥珠单抗 ) 中位随访 8.1 年, 与 AC PH 组中位随访 2.0 年进行的分析相比, 新发心功能不全的发病率 ( 检测指标 LVEF) 无 变化 :18.5% 的 AC PH 病人 LVEF 值降低 10%~ 50% 在 AC PH 组出现过有症状 的充血性心力衰竭的病人, 有 64.5% 的病人左心室功能不全可逆, 在最近一次随访 时无症状,90.3% 的病人完全或部分 LVEF 恢复 早期乳腺癌 ( 新辅助疗法 ) 在关键性临床试验 MO16432 中, 曲妥珠单抗联合新辅助化疗 ( 包括 3 个周期的 多柔比星, 其累计剂量 180 mg/m 2 ), 曲妥珠单抗治疗组中有症状的心功能不全发生 率达 1.7% 但是, 在关键性临床试验 BO22227, 曲妥珠单抗联合新辅助化疗 ( 包 括 4 个周期的表柔比星, 其累积剂量 300mg/m 2 ) 中位随访超过 70 个月时, 曲妥珠 单抗 ( 静脉给药制剂 ) 组中心力衰竭 / 充血性心力衰竭的发生率为 0.3% 转移性胃癌 在 BO18255 试验中, 筛选期时, 氟尿嘧啶 / 顺铂 (FP) 组和曲妥珠单抗 + 氟尿 嘧啶 / 顺铂 (H +FP) 组的中位 LVEF 值分别为 64%( 范围 48%~90%) 和 65%( 范 围 50%~86%) 除含曲妥珠单抗治疗组中 1 名患者 ( 其 LVEF 的下降伴有心力衰竭 ) 外,BO18255 试验中记录的多数 LVEF 下降均无临床症状 表 3 LVEF 相对于筛选期的变化情况总结 (BO18255 试验 ) LVEF 下降 : 筛选期后最低值 氟尿嘧啶 / 顺铂 (N = 290) ( 各治疗组患者百分比 ) 曲妥珠单抗 / 氟尿嘧啶 / 顺铂 (N = 294) ( 各治疗组患者百分比 ) * LVEF 下降 10%, 降至 1.1% 4.6% <50% 绝对值 <50% 1.1% 5.9% * LVEF 下降 10%, 降至 50% 11.8% 16.5% * 仅包括随访时所接受的 LVEF 检查方法与初次接受的 LVEF 检查方法相同的患者 (FP, n=187 与 H+FP,n=237) 表 4 心脏不良事件 (BO18255 试验 ) 氟尿嘧啶 / 顺铂 (N = 290) ( 各治疗组患者百分比 ) 曲妥珠单抗 / 氟尿嘧啶 / 顺铂 (N = 294) ( 各治疗组患者百分比 ) 全部心脏不良事件 6% 6% 3 级 NCI CTCAE 3.0 版 *3% **1% * 9 名患者发生 9 例事件 ** 4 名患者发生 5 例事件 13 / 45
14 总体而言, 心功能不全事件在治疗组和对照组之间未出现显著性差异 输注相关反应 (IRR)/ 超敏反应在所有曲妥珠单抗的临床试验中都监测到静脉输注曲妥珠单抗发生 IRR, 如寒战和 / 或发热 呼吸困难 低血压 哮鸣 支气管痉挛 心动过速 血氧饱和度下降和呼吸窘迫 ( 参见 注意事项 ) IRR 临床上很难与超敏反应相区分 根据不同适应症 曲妥珠单抗与化疗联合治疗或单药治疗 不同的数据采集方法, 各研究之间的各级 IRR 的发生率有所不同 转移性乳腺癌患者中, 曲妥珠单抗联合治疗组 IRR 发生率在 49% 至 54% 之间, 而对照药治疗组在 36% 至 58% 之间 ( 可能包含其他化疗 ) 曲妥珠单抗联合治疗组, 重度 IRR(3 级及以上 ) 达 5% 至 7%, 对照药治疗组达 5% 至 6% 早期乳腺癌患者中, 曲妥珠单抗联合治疗组 IRR 发生率在 18% 至 54% 之间, 而对照药治疗组在 6% 至 50% 之间 ( 可能包含其他化疗 ) 曲妥珠单抗联合治疗组, 重度 IRR(3 级及以上 ) 达 0.5% 至 6%, 对照药治疗组达 0.3% 至 5% 在早期乳腺癌新辅助疗法方案下 (BO22227), IRR 发生率与上述临床试验结果一致, 静脉输注组是 37.2%, 重度的 IRR(3 级 ) 发生率是 2.0%, 没有发生 4 级和 5 级 IRR 在个别病例中观察到过敏样反应 血液学毒性乳腺癌血液学毒性在接受曲妥珠单抗单药治疗的转移性患者中不,WHO 分级 3 级的白细胞减少症 血小板减少症和贫血发生率低于 1% 未观察到 WHO 分级 4 级的毒性 曲妥珠单抗联合紫杉醇治疗 WHO 分级 3 级或 4 级的血液学毒性高于紫杉醇单药治疗的患者 (34% 比 21%) 曲妥珠单抗联合多西他赛治疗 3 级或 4 级的血液学毒性高于多西他赛单药治疗的患者 (3/4 级中性粒细胞减少症发生率 32% 比 22%, 用 NCI-CTC 标准 ) 曲妥珠单抗联合多西他赛治疗的患者发热性中性粒细胞减少症或中性粒细胞减少性脓毒症高于多西他赛单药治疗的患者 (23% 比 17%) 用 NCI-CTC 标准, 在 BO16348 试验中, 曲妥珠单抗治疗组 0.4% 患者从基线水平上升 3 或 4 级, 对照组为 0.6% 贫血随机对照的临床试验中, 曲妥珠单抗联合化疗的患者高于单独化疗的患者, 贫血 14 / 45
15 的总体发生率 (30%vs21%[BO16348 试验 ]) NCI-CTC 2~5 级贫血的总体发生率 (12.3%vs 6.7%[NSABP B31]), 需要输血的贫血总体发生率 (0.1%vs0[NCCTG N9831]) 曲妥珠单抗单药(H0649g 中 ) 治疗后,NCI-CTC 3 级贫血发生率 < 1% 在试验 BO18255( 转移性胃癌 ) 中, 含曲妥珠单抗组与单独化疗组相比, 贫血总发生率分别为 28% 和 21%,NCI CTC 3/4 级贫血分别为 12.2% 和 10.3% 中性粒细胞减少症乳腺癌辅助治疗的随机对照临床试验中, 曲妥珠单抗联合化疗组高于单独化疗的患者,NCI-CTC 4~5 级中性粒细胞减少症的发生率 (1.7%vs 0.8%[NCCTG N9831]) 和 2~5 级中性粒细胞减少症的发生率 (6.4%vs4.3%[NSABP B31]) 转移性乳腺癌的随机对照临床试验中, 曲妥珠单抗联合骨髓抑制化疗的患者 NCI-CTC 3/4 级中性粒细胞减少症的发生率 (32%vs 22%) 和发热性中性粒细胞减少症的发生率 (23%vs 17%) 也高于单独化疗的患者 在试验 BO18255( 转移性胃癌 ) 中, 曲妥珠单抗联合化疗组与单独化疗组相比,NCI CTC 3/4 级中性粒细胞减少发生率分别为 36.8% 和 28.9%, 发热性中性粒细胞减少分别为 5.1% 和 2.8% 肝脏和肾脏毒性乳腺癌曲妥珠单抗单药治疗转移癌患者时, 有 12% 患者会出现 WHO3 或 4 级肝脏毒性, 该毒性与其中 60% 患者的肝脏疾病进展有关 与紫杉醇单药治疗患者相比, 使用曲妥珠单抗联合紫杉醇治疗的患者发生 WHO3 或 4 级肝毒性的频率更低 (7% vs 15%) 并且没有观察到 WHO3 或 4 级肾脏毒性的发生 上市后, 经病理证实有肾小球病变的肾病综合征鲜有报告 肾病发生的时间在曲妥珠单抗治疗开始 4 个月到大约 18 个月间 肾脏的病理表现有 : 膜性肾小球肾炎 局灶性肾小球硬化 纤维样肾小球肾炎 肾病的并发症有容量负荷过重和充血性心力衰竭 转移性胃癌在 BO18255 试验中, 未观察到两治疗组在肝脏和肾脏毒性方面出现显著性差异 NCI-CTC AE(3.0 版 ) 3 级肾脏毒性反应在 FP+H 组中的发生率未显著高于 FP 组 ( 两组发生率分别为 3% 和 2%) NCI-CTC AE(3.0 版 ) 3 级不良事件 (SOC 中所收录的肝胆疾病不良事件 ): 报告的唯一不良事件为高胆红素血症, 其在 FP+H 组中的发生率未显著高于 FP 组 ( 两组发生率分别为 1% 和 <1%) 15 / 45
16 感染曲妥珠单抗联合化疗的患者, 高于单独化疗的患者 感染的总体发生率 (46%vs 30%[H0648g]) NCI-CTC 2-5 级感染 / 发热性中性粒细胞减少症的总体发生率 (24.3%vs 13.4%[NSABP B31]) 和 3-5 级感染 / 发热性中性粒细胞减少症的总体发生率 (2.9%vs 1.4%[NCCTG N9831]) 辅助治疗中感染发生的最部位有: 上呼吸道 皮肤和尿道 在试验 BCIRG006 中, 曲妥珠单抗添加至 AC-T 时的感染总发生率升高, 但曲妥珠单抗添加至 TCH 时未升高 [44%(AC-TH),37%(TCH),38%(AC-T)] 三组的 NCI-CTC 3-4 级感染发生率相似 [25%(AC-TH),21%(TCH),23%(AC-T)] 治疗转移性乳腺癌的随机对照临床试验中, 曲妥珠单抗联合骨髓抑制的化疗药物组患者报告的发热性中性粒细胞减少症的发生率高于 (23%vs 17%) 单独化疗的患者 曲妥珠单抗治疗的患者观察到感染的发生率增加, 主要是临床意义较小的轻度上呼吸道感染或尿道感染 肺部反应乳腺癌辅助治疗乳腺癌辅助治疗的女性患者中, 曲妥珠单抗联合化疗的患者高于单独化疗的患者,NCI-CTC 2~5 级肺部反应的发生率 (14%vs 5%[NSABP B31]),NCI-CTC 3~ 5 级肺部反应和自发报道的 2 级呼吸困难发生率 (3.4%vs0.9%[NCCTG N9831]) 曲妥珠单抗联合化疗和单独化疗的患者最的肺部反应为呼吸困难 (NCI-CTC 2~5 级 :11.8%vs 4.6%[NSABP B31];NCI-CTC 2~5 级 :2.4%vs 0.2%[NCCTG N9831]) 肺炎 / 肺浸润的发生率, 曲妥珠单抗治疗的患者为 0.7%, 单独化疗的患者为 0.3% 曲妥珠单抗治疗的患者中,3 例发生致死性呼吸衰竭, 其中 1 例表现为多脏器功能衰竭综合征 单独化疗的患者中,1 例发生致死性呼吸衰竭 转移性乳腺癌接受曲妥珠单抗治疗的转移性乳腺癌女性患者肺部毒性的发生率也有增加 肺部的不良事件作为输注反应的一部分在上市后有报道 肺不良事件包括 : 支气管痉挛 低氧血症 呼吸困难 肺浸润 胸腔积液 非心源性肺水肿和急性呼吸窘迫综合征 具体描述见 注意事项 血栓 / 栓塞在四项随机对照的临床试验中, 三项试验发现, 曲妥珠单抗联合化疗患者血栓形成的发生率高于单独化疗的患者 (2.6%vs 1.5%[NSABP B31],2.5% 和 3.7% vs 2.2% 16 / 45
17 [BCIRG006] 和 2.1%vs 0%[H0648g]) 腹泻乳腺癌乳腺癌辅助治疗的女性患者, 曲妥珠单抗联合化疗的患者高于单独化疗的患者,NCI-CTC 2~5 级腹泻发生率 (6.7% vs 5.4%[NSABP B31]) NCI-CTC 3~5 级腹泻发生率 (2.2% vs 0%[NCCTG N9831]) NCI-CTC 1~4 级腹泻发生率 (7% vs 1%[BO16348]) 在试验 BCIRG006 中, 接受曲妥珠单抗治疗的女性中的 3-4 级腹泻 [5.7% AC-TH,5.5% TCH vs. 3.0% AC-T] 及 1-4 级腹泻 [51% AC-TH,63% TCH vs. 43% AC-T] 发生率升高 接受曲妥珠单抗 (IV) 单药治疗的转移性乳腺癌患者腹泻发生率为 27% 转移性乳腺癌中, 接受曲妥珠单抗联合化疗的患者较仅接受化疗的患者腹泻的发生率更高 转移性胃癌在 BO18255 试验中, 含曲妥珠单抗治疗组和对照组中分别有 109 名患者 (37%) 和 80 名患者 (28%) 出现了各种严重度级别的腹泻 根据 NCI-CTCAE 3.0 版的严重度标准,FP 组和 FP +H 组分别有 4% 和 9% 的患者出现了 3 级腹泻 免疫原性在早期乳腺癌 (EBC) 新辅助研究 BO22227 中, 中位随访时间超过 70 个月时, 曲妥珠单抗 ( 静脉给药制剂 ) 组中有 10.1%(30/296) 的患者产生了抗曲妥珠单抗的抗体 在 30 例本品治疗的患者中, 有 2 例的基线后样本中检测到中和的抗曲妥珠单抗的抗体 这些抗体的临床相关性尚不清楚 抗曲妥珠单抗的抗体对本品的药代动力学, 疗效 [ 按病理学完全缓解率 (pcr) 评价 ] 和无事件生存期 (EFS) 评估及安全性 [ 根据治疗相关反应 (ARRs) 事件评估 ] 无影响 抗体生成发生率高度依赖于检测方法的灵敏性和特异性 另外, 试验中检测到的抗体阳性率 ( 包括中和抗体 ) 还会受到其它因素影响, 包括分析方法 样本的处理 样本的收集时间 伴随的药物治疗和其它的合并疾病 由于这些原因, 比较曲妥珠单抗的阳性率和其它产品抗体的阳性率可能会使人误解 上市后经验 以下药物不良反应为曲妥珠单抗上市后经验中确认的不良反应 表 5 上市后治疗中报告的不良反应 器官系统分类血液及淋巴系统疾病 不良反应低凝血酶原血症免疫性血小板减少症 17 / 45
18 18 / 45 免疫系统疾病过敏样反应代谢及营养类疾病肿瘤溶解综合征眼器官疾病睫毛脱落心脏器官疾病心源性休克心动过速呼吸系统 胸及纵隔疾病支气管痉挛血氧饱和度下降呼吸衰竭间质性肺病肺浸润急性呼吸窘迫综合征呼吸窘迫肺纤维化低氧喉水肿肾脏及泌尿系统疾病肾小球性肾病肾功能衰竭妊娠期 产褥期与围产期状况肺发育不全肾发育不全羊水过少不良事件下表给出了以往接受曲妥珠单抗治疗的患者所报告的不良事件 由于没有证据表明曲妥珠单抗与这些事件之间存在因果关系, 这些事件不符合报告给管理部门的要求 表 6 不良事件器官系统分类不良事件感染与侵染类疾病蜂窝织炎丹毒脓毒脑膜炎支气管炎带状疱疹膀胱炎血液及淋巴系统疾病白血病免疫系统疾病过敏反应过敏性休克精神病类思维异常各类神经系统疾病共济失调轻瘫脑血管疾病脑水肿困倦昏迷耳与迷路类疾病眩晕心脏器官疾病心包积液心动过缓心包炎呼吸系统 胸及纵隔疾病呃逆
19 胃肠疾病肝胆系统疾病肌肉骨骼与结缔组织疾病肾脏及泌尿系统疾病生殖系统与乳腺疾病全身性疾病及给药部位各种反应 禁忌 劳力性呼吸困难胃炎胰腺炎肝功能衰竭骨骼肌肉疼痛排尿困难乳房疼痛胸部不适 禁用于已知对曲妥珠单抗过敏或者对任何本品辅料过敏的患者 本品使用苯甲醇作为溶媒, 禁止用于儿童肌肉注射 注意事项 一般情况为了提高生物制品的可追溯性, 患者文件中应清晰记录 ( 或声明 ) 所用药品的商品名和批号 曲妥珠单抗治疗仅在有癌症治疗经验的医生监督下进行 心功能不全一般考虑要点曲妥珠单抗可引起左心室功能不全 心律失常 高血压 有症状的心力衰竭 心肌病 和心源性死亡, 也可引起有症状的左心室射血分数 (LVEF) 降低 曲妥珠单抗治疗患者发生充血性心力衰竭 (CHF)( 纽约心脏病协会 [NYHA]II-IV 级 ) 或无症状心功能不全的风险增加 这些事件可见于接受曲妥珠单抗单药或含蒽环类 ( 多柔比星或表柔比星 ) 化疗序贯曲妥珠单抗联合紫杉烷类治疗的患者 心功能不全可能从中度到重度并与死亡事件相关 另外, 心脏风险高 ( 例如高血压 冠状动脉疾病 CHF 舒张功能不全 老年人) 的患者慎用本品 群体药代动力学模型的模拟显示, 停药 7 个月后, 血液循环中仍可能有曲妥珠单抗残留 ( 参见 药代动力学 ) 停用曲妥珠单抗后, 接受蒽环类抗生素治疗患者的心功能不全风险仍然可能增加 医师应尽可能避免在停用曲妥珠单抗后 7 个月内给予蒽环类抗生素类药物治疗 若需要使用蒽环类抗生素治疗, 则应密切监测患者的心脏功能 给予首剂曲妥珠单抗之前, 特别是先前有过蒽环类抗生素暴露的患者, 均应进行基线心脏评估, 包括病史 体检 心电图 (ECG) 以及通过超声心动图或 MUGA ( 放射性心血管造影 ) 扫描 监测可帮助识别出现心功能不全的患者, 包括 CHF 体征和症状 基线时进行的心脏评估, 治疗期间每 3 个月重复一次, 终止治疗后每 6 个月重复一次, 直至停止曲妥珠单抗给药治疗后 24 个月 19 / 45
20 若 LVEF 值相对基线下降 10 个百分点, 并且下降至 50% 以下, 则应暂停使用曲妥珠单抗, 并在约 3 周内重复评估 LVEF 若 LVEF 无改善, 或进一步下降, 或出现有临床意义的 CHF, 则强烈建议终止曲妥珠单抗用药, 除非认为患者的获益大于风险 对于发生无症状心功能不全的患者, 应频繁监测 ( 如每 6-8 周一次 ) 若患者的左心室功能持续减退, 但仍保持无症状, 医师应考虑终止治疗, 除非认为对个体患者的获益大于风险 对于已出现心功能不全的患者继续或重新开始使用曲妥珠单抗的安全性, 目前尚无前瞻性研究 若在曲妥珠单抗治疗期间发生了有症状的心力衰竭, 则应使用心力衰竭 (HF) 的标准疗法进行治疗 在关键性试验中, 大多数发生心力衰竭或无症状的心功能不全的患者给予标准治疗后症状得到了改善 这些标准治疗包括血管紧张素转化酶 (ACE) 抑制剂或血管紧张素受体阻滞剂 (ARB) 和 β 阻滞剂 大多数有心脏症状的曲妥珠单抗临床获益的患者, 在继续接受曲妥珠单抗治疗过程中, 未出现其它临床心脏事件 转移性乳腺癌 (MBC) 在转移性乳腺癌治疗中, 曲妥珠单抗和蒽环类抗生素不能合并使用 早期乳腺癌 (EBC) 对于 EBC 患者, 基线时进行心脏评估, 治疗期间每 3 个月重复一次, 终止治疗后每 6 个月重复一次, 直至停止曲妥珠单抗给药治疗后 24 个月 接受含蒽环类抗生素化疗的患者建议进一步监测, 并且应每年一次, 直至最终曲妥珠单抗给药治疗后 5 年, 或者如果 LVEF 持续下降那么监测时间更长 曲妥珠单抗乳腺癌辅助治疗临床试验排除有心肌梗死 (MI) 史 需药物治疗的心绞痛 CHF(NYHA II IV) 或病史 其他心肌病 需药物治疗的心律失常 具有临床意义的心脏瓣膜疾病或病史 高血压控制不佳 ( 标准药物控制好的高血压可接受曲妥珠单抗治疗 ) 和心包积液影响血液动力学的患者 辅助治疗辅助治疗中, 曲妥珠单抗和蒽环类抗生素不能合并用药 EBC 患者中, 与联合多西他赛和卡铂等非蒽环类药物治疗相比, 含蒽环类药物化疗后接受曲妥珠单抗治疗患者, 有症状和无症状心脏事件发生率增加 曲妥珠单抗与紫杉烷类合并用药治疗中有症状和无症状心脏事件发生率比紫杉烷序贯曲妥珠单抗治疗更明显 无论采用何种方案, 大部分有症状心脏不良事件均发生在治疗的前 18 个月内 4 项大型辅助治疗研究显示, 心脏事件风险因素包括高龄 (> 50 岁 ) LVEF 基线水平低和 LVEF 水平下降 (< 55%) 紫杉醇 曲妥珠单抗治疗前或治疗后 LVEF 20 / 45
21 水平低和既往用过或正在使用抗高血压药物治疗 完成辅助化疗后接受曲妥珠单抗治疗患者中, 心功能不全风险与曲妥珠单抗开始治疗前给予的蒽环类抗生素治疗蓄积剂量较高和体重指数 (BMI>25kg/m 2 ) 高有关 新辅助治疗在新辅助治疗的 EBC 患者中, 应慎用曲妥珠单抗与蒽环类抗生素合并治疗, 并且仅用于初次接受化疗的患者 低剂量蒽环类抗生素治疗方案的最大蓄积剂量不超过 180 mg/m 2 ( 多柔比星 ) 或 360 mg/m 2 ( 表柔比星 ) 如果接受新辅助治疗的患者接受低剂量蒽环类抗生素与曲妥珠单抗合并用药治疗, 则术后不得再接受细胞毒性化疗 65 岁以上患者中新辅助治疗的临床经验有限 心功能监测给予首剂曲妥珠单抗之前, 应充分评估患者心功能, 包括病史 体格检查 并通过超声心动图或 MUGA( 放射性心血管造影 ) 扫描检查测定 LVEF 值 在临床试验中, 按下述时间安排进行心功能监测 : 开始曲妥珠单抗治疗前测量 LVEF 基线值 曲妥珠单抗治疗期间每 3 个月进行一次 LVEF 测量, 且在治疗结束时进行一次 曲妥珠单抗治疗结束后至少两年内每 6 个月进行一次 LVEF 测量 曲妥珠单抗因严重左心室功能不全停药后, 每 4 周进行一次 LVEF 测量 ( 见 用法用量 ) 在 NSABP B31 中,AC-TH 组 15%(158/1031) 的患者在中位 8.7 年随访时间后, 由于心功能不全或显著的 LVEF( 左室射血分数 ) 下降的临床证据而中断曲妥珠单抗治疗 在 BO16348 试验 ( 为期一年的曲妥珠单抗治疗 ) 中, 在中位 12.6 个月随访时间后, 有 2.6%(44/1678 例 ) 的患者因心脏毒性停止使用曲妥珠单抗 在试验 BCIRG006 中,TCH 组共 2.9%(31/1056) 的患者 ( 化疗阶段 1.5%, 单药治疗阶段 1.4%),AC-TH 组 5.7%(61/1068) 的患者 ( 化疗阶段 1.5%, 单药治疗阶段 4.2%) 因心脏毒性停用了曲妥珠单抗 在 64 位接受辅助化疗出现充血性心力衰竭 (CHF) 的患者中 (NSABP B31 NCCTG N9831),1 位患者死于心肌病, 一例患者猝死, 无记录的病因,33 例患者在最后一次随访时正接受心脏药物治疗 在最后一次随访时, 约 24% 的存活患者恢复至正常左心室射血分数 ( 定义为 50%), 且在继续接受医学治疗时无症状 充血性心力衰竭发生率列于表 7 未研究出现曲妥珠单抗所致左心室功能不全的患者继续或恢复曲妥珠单抗治疗的安全性 21 / 45
22 表 7 乳腺癌辅助治疗研究中的充血性心力衰竭发生率 充血性心力衰竭发生率 试验 方案 曲妥珠单抗 对照 NSABP B31& NCCTG AC b 紫杉醇 + 曲妥珠单 3.2%(64/2000) 1.3% (21/1655) N9831 a 抗 c BO16348 d 化疗 曲妥珠单抗 2% (30/1678) 0.3% (5/1708) BCIRG006 AC b 多西他赛 + 曲妥珠单抗 2% (20/1068) 0.3% (3/1050) BCIRG006 多西他赛 + 卡铂 + 曲妥珠单抗 0.4% (4/1056) 0.3% (3/1050) a 试验 NSABP B31 和研究 2 中 AC TH 组的中位随访时间为 8.3 年 b 蒽环类 ( 多柔比星 ) 和环磷酰胺 c 包括 1 例发生致死性心肌病的患者及 1 例发生无记录的病因的猝死的患者 d 包括为期一年的曲妥珠单抗组在中位 12.6 个月随访时间时的 NYHA III & IV 级和心源性死 亡 在试验 BO16348( 为期一年的曲妥珠单抗治疗 ) 中, 在中位 8 年随访时间时, 重度充血性心力衰竭 (NYHA III 级和 IV 级 ) 的发生率为 0.8%, 轻度有症状和无症 状的左心室功能不全发生率为 4.6% 表 8 转移性乳腺癌研究中的心功能不全 a 发生率 发生率 NYHA I-IV 级 NYHA III-IV 级 试验 事件 曲妥珠单抗 对照 曲妥珠单抗 对照 H0648g(AC) b 心功能不全 28% 7% 19% 3% H0648g( 紫杉醇 ) 心功能不全 11% 1% 4% 1% H0649g c 心功能不全 7% N/A 5% N/A a 充血性心力衰竭或无症状的 LVEF 左心室射血分数显著下降 b 蒽环类 ( 多柔比星或表柔比星 ) 和环磷酰胺 c 包括 1 例发生致死性心肌病的患者 在试验 BCIRG006 中, 含曲妥珠单抗方案的 NCI-CTC 3/4 级心肌缺血 / 梗死发生 率 :(AC-TH:0.3% (3/1068),TCH:0.2% (2/1056)) 高于 AC-T(0 例 ) 输注相关反应 (IRR) 使用曲妥珠单抗注射液时 IRR IRR 临床上很难与超敏反应相区分 可采取预治疗减少 IRR 发生的风险 输注反应包括一系列症状, 表现为发热 寒战, 偶尔会有恶心 呕吐 疼痛 ( 某 些病例在肿瘤部位 ) 头痛 晕眩 呼吸困难 低血压 皮疹和乏力 ( 见 不良反 应 ) 使用曲妥珠单抗发生的严重的 IRR 包括呼吸困难 低血压 哮鸣 支气管痉挛 心动过速 血氧饱和度下降 呼吸窘迫 室上性快速性心律失常和荨麻疹 ( 见 不 良反应 ) 应监测患者是否有 IRR 的发生 中断静脉输注有助于控制此类症状, 症状减轻后, 可恢复输注给药 镇痛药或解热镇痛药如哌替啶或乙酰氨基酚, 或抗 22 / 45
23 组胺药如苯海拉明可治疗以上症状 严重反应经吸氧 β- 受体兴奋剂 皮质激素等支持疗法可成功治疗 在某些罕见病例中, 这些反应可能与患者死亡相关 由于晚期恶性肿瘤并发症或合并症导致静息状态下呼吸困难的患者, 致命性输注反应的风险可能会更高 因此, 这些患者不应接受曲妥珠单抗治疗 所有发生呼吸困难或临床严重低血压的患者, 曲妥珠单抗输注应该中断, 同时给予药物治疗 药物包括肾上腺素 皮质类固醇激素 苯海拉明 支气管扩张剂和氧气 应该评估和谨慎地监测患者直到症状和体征完全缓解 所有发生重度输注反应的患者应考虑永久停药 目前没有关于鉴别在经历了重度的输注反应后还可以再次安全地接受曲妥珠单抗治疗的患者的最合适方法的资料 在再次接受曲妥珠单抗治疗之前, 经历了严重输注反应的患者预防性应用抗组胺药和 / 或糖皮质激素, 一些患者能耐受再次曲妥珠单抗治疗, 而另一些患者尽管应用了预防性用药但还是发生了重度的反应 苯甲醇用作 440 mg 规格中无菌注射用水防腐剂的苯甲醇引起了新生儿和 3 岁以下儿童的毒性反应 已知对苯甲醇过敏的患者在给于曲妥珠单抗时应使用注射用水复溶, 每瓶曲妥珠单抗只给药 1 次 弃去未使用部分 胚胎毒性孕期妇女使用曲妥珠单抗会对胎儿造成伤害 上市后报道中, 孕期使用曲妥珠单抗会导致羊水过少及其造成肺发育不全 骨骼异常和新生儿死亡 育龄期女性使用曲妥珠单抗前应确认其怀孕状态 应告知患者孕期使用曲妥珠单抗以及停药后 7 个月内怀孕可能会对胎儿造成伤害, 并对育龄患者提供避孕咨询服务 ( 见 孕妇及哺乳期妇女用药 ) 肺部反应在上市后曲妥珠单抗的临床应用中有报道严重肺部反应事件, 这些事件偶尔会导致死亡, 也可能是 IRR 的部分表现或延迟表现 此外, 已报道病例有间质性肺疾病 ( 包括肺浸润 ) 急性呼吸窘迫综合征 肺炎 非感染性肺炎 胸腔积液 呼吸窘迫 急性肺水肿和呼吸功能不全 导致间质性肺病的风险因素包括之前或合并使用已知可引起间质性肺病的其他抗肿瘤治疗, 如紫杉烷类 吉西他滨 长春瑞滨和放疗 因晚期恶性肿瘤并发症和合并疾病而发生静息状态呼吸困难的患者可能发生肺部反应的风险更高 因此, 这些患者不应接受曲妥珠单抗治疗 化疗诱导的中性粒细胞减少症加重在曲妥珠单抗联合化疗治疗转移性乳腺癌的随机 对照临床试验中, 联合骨髓抑制化疗药物治疗组中 NCI CTC 3~4 级中性粒细胞减少症和发热性中性粒细胞减 23 / 45
24 少症的发生率比单纯化疗组高 因败血症死亡的发生率两组相似 ( 见 不良反应 ) HER2 检测检测 HER2 阳性是筛选适合接受曲妥珠单抗治疗的患者所必须的, 因为只有 HER2 阳性的患者被证明能从治疗中受益的 HER2 过度表达和 HER2 基因扩增的检测应该由被认证精通此项特殊技术的实验室完成 不正确的操作, 包括使用未达最佳固定标准的组织 没有应用特定试剂 背离特定技术指南和没有包括合适的实验对照, 可能会导致不可靠的结果 一些已获批准的商业检测有助于接受曲妥珠单抗治疗患者的选择 这些方法包括 HercepTest TM 和 CONFIRM anti-her-2/neu (4B5) Primary Antibody (HER-2/NEU 抗体 )(IHC 检测 ); HER2 FISH pharmdx TM INFORM HER2 DNA Probe(HER2 DNA 探针 ) Rabbit anti-dnp Antibody(DNP 抗体试剂 ) 和 INFORM Chromosome 17 Probe(17 号染色体探针 ) 以及 DDISH HER2 Probe(DDISH HER2 探针 ) (FISH 检测 ) 使用者应查询这些检测试剂盒包装中的说明书, 以了解每项检测的验证结果和操作方法 检验精确性 ( 特别是 IHC 方法 ) 的限制 检测结果和曲妥珠单抗靶点过度表达的直接关系 (FISH 方法 ) 的限制, 使得仅依赖一个方法排除曲妥珠单抗治疗的潜在受益不可取 FISH 阴性结果不能排除 HER2 过度表达和从曲妥珠单抗治疗中潜在受益的可能 转移性乳腺癌 (H0648g) 治疗中 IHC 和 FISH 检测与治疗结果的关系见表 13 乳腺癌辅助治疗(NCCTG N9831 和 BO16348) 中 IHC 和 FISH 检测与治疗结果的关系见表 9 评估胃癌中 HER2 过度表达和 HER2 基因扩增应使用被批准的检测方法, 这一点对胃癌尤为重要, 这是由于胃和乳腺的组织病理学差异, 包括不完全膜染色和胃癌中 HER2 基因更多异质表达 BO18255 试验中阐述了基因扩增和蛋白质过度表达的相关性不如在乳腺癌中那样好 基于 HER2 基因扩增 (BO18255 试验 ) 和蛋白质过度表达 (IHC) 检测结果的胃癌治疗效果见表 16 乳腺癌 HER2 过度表达或 HER2 基因扩增的检测曲妥珠单抗仅可以在使用准确和有效检测方法确定 HER2 过度表达或 HER2 基因扩增的患者中使用 HER2 过度表达采用基于免疫组织化学 (IHC) 的固定肿瘤组织块评价法 HER2 基因扩增采用固定肿瘤组织块的荧光原位杂交法 (FISH) 或显色原位杂交法 (CISH) 如果患者的 HER2 过度表达强度分数达 3+(IHC) 或 FISH 或 CISH 结果阳性, 则符合曲妥珠单抗治疗要求 为保证结果的准确性和重现性, 试验必须在专门实验室实施, 以充分保证试验步骤的有效性 24 / 45
25 推荐的评价 IHC 染色类型的分数系统如下 : 分数染色类型 HER2 阳性评估 0 无染色或者 < 10% 肿瘤细胞膜染色 阴性 1+ 可检测到 > 10% 的肿瘤细胞膜染色为极浅 / 几乎观察阴性不到, 细胞中仅有部分细胞膜被染色 2+ 可检测到 > 10% 的肿瘤细胞膜全部染色为弱到中等可疑程度 3+ 可检测到 > 10% 的肿瘤细胞膜全部为强染色 阳性一般情况下, 如果每个肿瘤细胞 HER2 基因拷贝数与染色体 17 拷贝数的比率大于或等于 2, 或者在无染色体 17 对比情况下, 如果每个肿瘤细胞 HER2 基因拷贝数大于 4, 则视为 FISH 阳性 一般情况下, 如果大于 50 % 的肿瘤细胞中的每个细胞核 HER2 基因拷贝数超过 5 个, 则视为 CISH 阳性 有关详细的检测方法和解释的操作指南, 请参考 FISH 和 CISH 有效检测方法的说明书, 也可以采用官方对 HER2 检测的建议 如果采用任何其它方法评估 HER2 蛋白或基因表达, 则必须在能够提供最先进的有效检查方法的实验室中实施 此类方法必须具有足够的精密度和准确度, 以检测出 HER2 过度表达, 并且必须能够区分中等阳性 (2+) 与强阳性 (3+)HER2 过度表达之间的差异 胃癌 HER2 过度表达或 HER2 基因扩增的检测必须采用准确和有效的方法检测 HER2 过度表达或 HER2 基因扩增, 推荐 IHC 作为首选检测方式, 如果还需要检测 HER2 基因扩增状况, 则必须采用银增强原位杂交法 (SISH) 或 FISH 检测法 但是, 如果需要同时进行肿瘤组织学和形态学的评价, 则推荐采用 SISH 检测法 为保证检测方法的有效性并获得具有准确度和重现性的结果, 必须在配备专业工作人员的实验室实施 HER2 检测 有关检测方法和结果解释的详细说明, 请见所采用的 HER2 检测方法试剂盒提供的产品信息说明书 在 BO18255 试验中, 肿瘤检测结果呈 IHC3+ 或 FISH 阳性的患者被定为 HER2 阳性并入组试验 基于该临床试验结果, 有效性局限于 HER2 蛋白表达水平最高的患者, 即 IHC 分数为 3+, 或 IHC 分数为 2+ 并且 FISH 结果呈阳性 在一项方法比较研究中 (D 试验 ),SISH 和 FISH 检测法对胃癌患者的 HER2 基因扩增检测结果高度一致 (>95%) 在采用 IHC 或 ISH 检测 HER2 的表达时, 应采用相对应的肿瘤组织固定模式 推荐的评价 IHC 染色类型的分数系统如下 : 25 / 45
26 分数 外科病理切片 - 染色类型 活检样本 - 染色类型 HER2 阳 性评估 0 无反应性或者 <10% 肿瘤细胞出现膜反应 1+ 10% 的肿瘤细胞出现极弱 / 几乎观察不到的膜反应 ; 细胞反应仅出现在部分细胞膜中 % 的肿瘤细胞出现弱到中等程度的全部 底外侧 或外侧的膜反应 3+ 10% 的肿瘤细胞出现很强的全部 底外侧 或外侧的膜反应 任何肿瘤细胞无反应或者膜反应 有成团的肿瘤细胞出现极弱 / 几乎观察不到的膜反应, 不考虑肿瘤细胞染色百分比有成团的肿瘤细胞出现弱到中等程度的全部 底外侧 或外侧的膜反应, 不考虑肿瘤细胞染色百分比有成团的肿瘤细胞出现很强的全部 底外侧 或外侧的膜反应, 不考虑肿瘤细胞染色百分比 阴性 阴性 可疑 阳性 一般情况下, 如果每个肿瘤细胞 HER2 基因拷贝数与染色体 17 拷贝数之间比率 大于或等于 2, 则视为 SISH 或 FISH 呈阳性 驾车和操作机器的能力 尚未进行对驾车和操作机器能力影响的研究 出现输注相关症状的患者在其症 状完全消退前不得驾车或操作机器 孕妇及哺乳期妇女用药 孕妇 妊娠期间孕妇应避免使用曲妥珠单抗, 只有在对母体的潜在获益远大于对胎儿 的潜在危险时才可使用曲妥珠单抗治疗 有报道在上市后临床中, 怀孕期间使用曲妥珠单抗的孕妇出现羊水过少, 某些 病例还引起致死性胎儿肺发育不良 育龄妇女在使用曲妥珠单抗治疗期间以及治疗 结束后 7 个月应采取有效的避孕措施 ( 参见 药代动力学 ) 应告知已孕患者对 胎儿有害的可能性 如果孕妇使用曲妥珠单抗治疗, 或者患者在曲妥珠单抗治疗期 间或最后一剂曲妥珠单抗治疗 7 个月内怀孕, 多学科专业人员要对其进行密切监测 尚不知晓曲妥珠单抗是否影响生殖能力 在动物生殖实验中没有证据表明本产品损 害生育力或对胎儿有危害 曲妥珠单抗上市后, 报告了妊娠妇女使用曲妥珠单抗单药或联合化疗治疗时发 生羊水过少以及羊水过少序列征, 表现为肺发育不良 骨骼异常及新生儿死亡 这 些妇女患者中, 有一些患者停用曲妥珠单抗后羊水指数升高 有 1 例患者在羊水指 数改善后恢复曲妥珠单抗治疗时, 羊水过少复发 对于妊娠期间使用曲妥珠单抗治疗的妇女, 应监测是否发生羊水过少 如果发 生羊水过少, 则应在合适的孕龄在专科医生指导下进行相应检查和监测 静脉补液 26 / 45
27 对曲妥珠单抗治疗时发生的羊水过少的疗效尚不肯定 生殖研究在猕猴中进行, 按每周人的维持剂量 (2mg/kg) 的 25 倍剂量给药时, 尚未有证据表明对胎儿有害 然而, 当评价对于人的生殖毒性的风险时, 啮齿类动物 HER2 受体的形成在正常胚胎发育的重要性和缺乏此受体的突变小鼠胚胎死亡的情况是要考虑在内的 妊娠早期 ( 孕龄 20~50 天 ) 和晚期 ( 孕龄 120~150 天 ) 观察到曲妥珠单抗能透过胎盘 目前还不知道孕妇使用曲妥珠单抗治疗是否对生育能力或者对胎儿有损害 动物生殖研究显示没有证据表明曲妥珠单抗对生殖能力或者胎儿有损害 哺乳期妇女尚不清楚曲妥珠单抗是否能分泌到人乳汁中, 由于人免疫球蛋白 (IgG) 可分泌到人乳汁中, 对婴儿的潜在伤害未知, 所以曲妥珠单抗治疗期间应避免哺乳 已发表的相关资料表明 : 乳汁中的抗体不能大量进入到新生儿或胎儿体循环中 对哺乳期猕猴给予 12.5 倍人类周剂量 ( 2 mg/kg ) 的曲妥珠单抗后, 母猕猴乳汁曲妥珠单抗阳性 血清曲妥珠单抗阳性的猴仔在出生后 3 个月内的生长发育过程中没有发生任何不良反应 ; 但是, 动物乳汁中曲妥珠单抗水平并不能准确反映人乳汁中的曲妥珠单抗水平 由于许多药物能分泌到人乳汁且曲妥珠单抗有可能导致哺乳期婴儿发生严重不良反应, 因此, 应根据曲妥珠单抗的 7 个月洗脱期和对母体的重要性两方面决定是否停止哺乳或停止曲妥珠单抗治疗 儿童用药 小于 18 岁患者使用本品的安全性和疗效尚未确立 本品使用苯甲醇作为溶媒, 禁止用于儿童肌肉注射 老年用药 在接受了转移性乳腺癌治疗 [H0648g 和 H0649g] 或辅助治疗 [NSABP B31 和 NCCTG N9831] 的患者中, 已有 386 例年龄在 65 岁以上的老年患者使用了曲妥珠单抗治疗 ( 其中, 乳腺癌辅助治疗有 253 例, 转移性乳腺癌有 133 例 ) 老年患者心功能不全发生的危险性均高于年轻患者 由于曲妥珠单抗作为乳腺癌辅助治疗的 4 项临床试验的设计不同和数据收集的局限性, 不能判断老年患者中曲妥珠单抗的毒性是否不同于年轻患者 已报道的临床经验也不能充分地说明, 在转移性乳腺癌治疗和乳腺癌辅助治疗中, 老年患者曲妥珠单抗的疗效改善 ( 总缓解率, 疾病进展时间, 总生存期, 无病生存期 ) 是否不同于所观察的年龄小于 65 岁的患者 肾功能不全患者 群体药代动力学分析显示, 肾功能不全对曲妥珠单抗的处置无影响 27 / 45
28 药物相互作用 尚未在人体中进行曲妥珠单抗的药物相互作用研究 临床试验显示本品与其它药物合并用药后, 未发现有临床意义的相互作用 ( 参见 药代动力学 ) 在临床试验中, 曲妥珠单抗与紫杉醇联用时, 曲妥珠单抗血清浓度相对基线升高 1.5 倍 在药物相互作用研究中, 与曲妥珠单抗联用时, 多西他赛和紫杉醇的药代动力学没有发生改变 在曲妥珠单抗与多西他赛 卡铂 阿那曲唑合用的研究中, 这些药物及曲妥珠单抗的药代动力学都没有发生改变 曲妥珠单抗不改变紫杉醇和多柔比星 ( 及其主要代谢物 6-α 羟基紫杉醇 (POH) 和阿霉素醇 (DOL)) 的浓度 但曲妥珠单抗可能增加一种多柔比星代谢物 (7- 脱氧 -13- 二羟基多柔比星酮, D7D) 的总暴露量 D7D 的生物活性和该代谢物浓度升高的临床意义尚不明确 紫杉醇和多柔比星存在时, 也没有观察到曲妥珠单抗浓度的改变 药物相互作用的子试验评估了卡培他滨和顺铂与或不与曲妥珠单抗合并用药的药代动力学 (PK) 该小型子试验的结果表明, 卡培他滨生物活性代谢产物 ( 如 5-FU) 的药代动力学不受顺铂合并用药或顺铂 + 曲妥珠单抗合并用药的影响 然而, 当与曲妥珠单抗合并用药时, 卡培他滨显示出更高浓度和更长的半衰期 该数据还表明, 顺铂的药代动力学不受卡培他滨合并用药或卡培他滨 + 曲妥珠单抗合并用药的影响 该试验未对曲妥珠单抗的药代动力学进行评价 药物过量 人体临床试验中未使用过过量曲妥珠单抗 未尝试用过单剂量 >10 mg/kg 临床试验 乳腺癌乳腺癌辅助治疗在对两项随机 开放性临床试验 ( 试验 NSABP B31 和试验 NCCTG N9831, 研究方案规定的最终总生存期分析中共有 4063 名女性 ) 第三项随机 开放性临床试验 ( 试验 BO16348, 比较一年曲妥珠单抗治疗组与观察组的最终无病生存期分析中共有 3386 名女性 ) 及第四项随机 开放性临床试验 ( 试验 BCIRG006, 共 3222 例患者 ) 进行的合并分析中, 评价了曲妥珠单抗在接受辅助化疗治疗 HER2 过表达乳腺癌的女性中的安全性和有效性 临床试验 NSABP B31 和 NCCTG N9831 中, 乳腺肿瘤标本必须表现出 HER2 阳 28 / 45
29 性 (IHC 检测示 3+) 或基因扩增 (FISH 检测为阳性 ) HER2 检查在随机分组前由中心实验室确认 (NCCTG N9831) 或被要求在参考实验室完成 (NSABP B31) 有症状的 有异常心电图 放射学或左室射血分数表现的活动性心脏病史患者或不能控制的高血压 ( 舒张压 >100mmHg 或收缩压 >200mmHg) 患者不能入组 患者随机 (1:1) 接受多柔比星和环磷酰胺后序贯紫杉醇 (AC 紫杉醇 ) 或紫杉醇加曲妥珠单抗 (AC 紫杉醇 + 曲妥珠单抗 ) 治疗 在 2 个试验中, 患者接受了 4 个 21 天疗程的多柔比星 60 mg/m 2 加环磷酰胺 600 mg/m 2 的治疗 在 NSABP B31 中, 紫杉醇每周 (80 mg/m 2 ) 或每 3 周 ( 175 mg/m 2 ) 给药一次, 为期 12 周 ; 在 NCCTG N9831 中, 紫杉醇按每周方案给药 曲妥珠单抗以 4mg/kg 的初始负荷剂量在紫杉醇起始治疗当日给药, 之后每周以 2mg/kg 的维持剂量给药, 连续 52 周 出现充血性心力衰竭或持续性 / 复发性左室射血分数下降时, 应永久性中止曲妥珠单抗的治疗 ( 参见 用法用量 ) 如果给予放射治疗, 一般应在完成化疗后开始 ER 阳性和 / 或 PR 阳性的患者可接受激素治疗 联合疗效分析的主要终点是无病生存期 (DFS), 定义为从随机分组到出现复发 对侧乳腺癌 第二原发肿瘤或死亡的时间 共 3752 例患者纳入主要终点的联合有效性分析 : 在中位 2.0 年随访后,AC 紫杉醇 + 曲妥珠单抗组的 DFS 联合分析中预先计划的最终 OS 分析包括 4063 例患者, 进行该分析的时间为中位 8.3 年随访后,AC 紫杉醇 + 曲妥珠单抗组发生 707 例死亡时 合并了试验 NSABP B31 的两组及试验 NCCTG N9831 三个研究组中的两组, 进行有效性分析 主要 DFS 分析中包括的患者的中位年龄为 49 岁 ( 范围 : 岁 ;6% > 65 岁 );84% 的患者为白人,7% 为黑人,4% 为西班牙人,4% 为亚洲人 / 太平洋岛民 疾病特征包括 90% 为浸润性导管组织学, 38% 为 T1,91% 为淋巴结受累,27% 为中度病理,66% 为高度病理,53% 为 ER+ 和 / 或 PR+ 肿瘤 在中位 8.3 年随访后, 有效性可评价人群中 AC 紫杉醇 + 曲妥珠单抗组报告的人口统计学和基线特征相似 在 BO16348 试验中, 乳腺癌标本经中心实验室检测需显示 HER2 基因过表达 (IHC 3+) 或扩增 (FISH) 淋巴结阴性患者的乳腺癌分期必须处于 T1c 期才能入选 充血性心力衰竭或 LVEF <55% 顽固性心律失常 需药物治疗的心绞痛 临床显著的心瓣膜病 ECG 显示透壁性心梗, 高血压控制不佳 ( 收缩压 > 180 mm Hg 或舒张压 > 100 mm Hg) 等这些患者不适合参与此试验 试验 BO16348 的设计为在 HER2 阳性早期乳腺癌患者中, 在手术 确立的化疗和放疗 ( 如适用 ) 后, 对持续一年及两年的每三周一次曲妥珠单抗治疗与观察组进行比较 在完成确定性手术后以及至少四个疗程的化疗时, 受试者被随机分配 (1:1:1) 为不接受其他治疗, 或接受一年曲妥珠单抗治疗或两年曲妥珠单抗治疗 进行肿块切除术的患者亦完成标准放疗 ER+ 和 / 或 PgR+ 疾病患者按照研究者的决定, 接受全身性辅助激素治疗 按 8 mg/kg 起始剂量, 然后每次 6 mg/kg, 每三周一次的后续 29 / 45
30 剂量给予曲妥珠单抗 主要结局指标为无病生存期 (DFS), 其定义与 NSABP B31 和 NCCTG N9831 相同 曲妥珠单抗组在中位 12.6 个月随访时间时进行研究方案规定的中期有效性分析, 对一年曲妥珠单抗治疗组与观察组进行比较, 该分析形成此研究的最终 DFS 结果的依据 随机分配至观察组 (n =1693) 和曲妥珠单抗一年治疗组 (n= 1693) 的 3386 例患者的中位年龄为 49 岁 ( 范围为 岁 ),83% 为白人,13% 为亚洲人 疾病特征 :94% 为浸润性导管癌,50% 为 ER+ 和 / 或 PgR+ 阳性,57% 为淋巴结阳性, 32% 为淋巴结阴性, 在 11% 的患者中, 由于既往接受过新辅助化疗, 无法评估淋巴结状态 96%(1055/1098) 的淋巴结阴性疾病患者有高危特征 : 在 1098 例淋巴结阴性疾病患者中,49%(543) 为 ER- 及 PgR-,47%(512) 为 ER 和 / 或 PgR +, 并且至少有以下高危特征中的一项 : 病理学肿瘤大小大于 2 cm 2-3 度或年龄 < 35 岁 在随机分组前,94% 的患者接受过以蒽环类为基础的化疗方案 在公布比较观察组与一年曲妥珠单抗治疗组的最终 DFS 结果后, 进行前瞻性计划的分析, 该分析包括在中位 8 年随访时, 对一年与两年曲妥珠单抗治疗进行比较 根据该分析, 将曲妥珠单抗治疗延长为两年相对于一年治疗无额外的获益 [ 在意向治疗人群 (ITT) 中, 两年曲妥珠单抗治疗与一年曲妥珠单抗治疗的无病生存期 (DFS) 风险比 = 0.99(95% CI:0.87,1.13),p 值 = 0.90, 总体生存期 (OS)=0.98(0.83, 1.15);p 值 = 0.78] 试验 BCIRG006 在试验 BCIRG006 中, 需要乳腺癌标本证实 HER2 基因扩增 ( 仅 FISH+), 在中心实验室进行测定 患者需要患有淋巴结阳性疾病, 或患有淋巴结阴性疾病且有下列高危特征中的至少一项 :ER/PR 阴性, 肿瘤大小 >2 cm, 年龄 < 35 岁, 或组织学分级和 / 或核分级为 2 度或 3 度 有充血性心力衰竭 心肌梗死 3 级或 4 级心律失常 需要药物治疗的心绞痛 具有临床意义的瓣膜性心脏病 控制不佳的高血压 ( 舒张压 > 100 mmhg) 任何 T4 或 N2 或已知的 N3 或 M1 乳腺癌史的患者无资格参加研究 患者被随机分配 (1:1:1) 为接受多柔比星和环磷酰胺序贯多西他赛 (AC-T), 多柔比星和环磷酰胺序贯多西他赛加曲妥珠单抗 (AC-TH), 或多西他赛和卡铂加曲妥珠单抗 (TCH) AC-T 组和 AC-TH 组均每 3 周给予一次 60 mg/m 2 多柔比星及 600 mg/m 2 环磷酰胺, 共四个疗程 ; 每 3 周给予一次 100 mg/m 2 多西他赛, 共四个疗程 TCH 组每 3 周给予一次多西他赛 75 mg/m 2 及卡铂 ( 目标 AUC 为 6 mg/ml/min, 输液 分钟 ), 共六个疗程 曲妥珠单抗每周给药一次 ( 初始剂量为 4 mg/kg, 然后为每周一次 2 mg/kg 剂量 ), 联合 T 或 TC, 然后作为单药疗法每 3 周给药一次 (6 mg/kg), 共 52 周 在完成化疗后开始放疗 ( 如果给予 ) ER+ 和 30 / 45
31 / 或 PR+ 肿瘤患者接受激素疗法 主要结局指标为无病生存期 (DFS) 在 3222 例经随机分组的患者中, 中位年龄为 49 岁 ( 范围为 岁 ;6% 65 岁 ) 疾病特征包括 54% 为 ER+ 和 / 或 PR+,71% 为淋巴结阳性 在随机分组前, 所有患者均进行了初次乳腺癌手术 DFS 结果 ( 试验 NSABP B31 和 NCCTG N9831 的合并分析 试验 BO16348 和试验 BCIRG006) 以及 OS 结果 ( 试验 NSABP B31 和 NCCTG N9831 的合并分析及试验 BO16348) 列于表 9 试验 NSABP B31 和 NCCTG N9831 中, 中位 2.0 年随访后 AC TH 组的无病生存期列于图 4, 中位 8.3 年随访后 AC TH 组的总生存期列于图 5 试验 BCIRG006 的无病生存期列于图 6 在所有四项研究中, 在最终 DFS 分析时, 以下每个亚组内的患者人数不足, 无法确定治疗效应与总体患者人群是否有差异 : 低度肿瘤患者 特定族裔 / 种族亚组 ( 黑人 西班牙人 亚洲人 / 太平洋岛民患者 ) 内的患者 年龄 >65 岁的患者 试验 NSABP B31 和 NCCTG N9831 中,OS 风险比为 0.64(95% CI:0.55,0.74) 在中位 8.3 年随访时 [AC TH], 估计 AC TH 组的生存率为 86.9%,AC T 组为 79.4% 试验 NSABP B31 和 NCCTG N9831 的最终 OS 分析结果表明, 按年龄 激素受体状态 阳性淋巴结数 肿瘤大小和分级及手术 / 放疗分类的 OS 获益与总体人群中的治疗效应一致 在年龄 50 岁的患者 (n=2197) 中,OS 风险比为 0.65(95% CI:0.52,0.81), 在年龄 >50 岁的患者 (n=1866) 中,OS 风险比为 0.63(95% CI:0.51,0.78) 在疾病的激素受体状态为阳性(ER 阳性和 / 或 PR 阳性 ) 的患者亚组中 (n=2223), 总生存期的风险比为 0.63(95% CI:0.51, 0.78) 在疾病的激素受体状态为阴性(ER 阴性和 / 或 PR 阴性 ) 的患者亚组中 (n=1830), 总生存期的风险比为 0.64(95% CI:0.52,0.80). 在肿瘤大小为 2 cm 的患者亚组中 (n=1604), 总生存期的风险比为 0.52(95% CI:0.39,0.71) 在肿瘤大小为 >2 cm 的患者亚组中 (n=2448), 总生存期的风险比为 0.67(95% CI:0.56, 0.80) 31 / 45
32 表 9 辅助治疗乳腺癌的有效性结果 ( 试验 NSABP B31 和 NCCTG N9831 BO16348 DFS 事件 及 BCIRG006) DFS 风险比 (95% CI) p 值 死亡 (OS 事件 ) OS 风险比 p 值 NSABP B31 和 NCCTG N9831 a AC TH 133 b 0.48 b,d 289c 0 64 c,d (n =1872) b (0.39, 0.59) (0.55, 0.74) (n = 2031) c p< e p< e AC T 261 b 418 c (n = 1880) b (n = 2032) c BO16348 f 化疗 曲妥珠单抗 (0.44, 0.67) p=ns h (n =1693) p< g 化疗 观察 (n = 1693) 试验 BCIRG006 i TCH (n=1075) ( ) p= e, j AC TH (n=1074) ( ) p< e,i AC T (n=1073) CI = 置信区间 a 试验 NSABP B31 和 NCCTG N9831 方案 : 多柔比星和环磷酰胺序贯紫杉醇 (AC T) 或紫 杉醇加曲妥珠单抗 (AC TH) b 有效性可评估人群,AC TH 组在中位 2.0 年随访后的主要 DFS 分析 c 有效性可评估人群, 在 707 例死亡 (AC TH 组中位 8.3 年随访 ) 后的最终 OS 分析 d 按临床试验 拟定紫杉醇方案 阳性淋巴结数量及激素受体状态分层, 采用 Cox 回归分析估 计的风险比 e 分层的对数秩检验 f 一年曲妥珠单抗治疗组的中位随访时间为 12.6 个月的最终 DFS 分析 g 对数秩检验 h NS= 不显著 i 试验 BCIRG006 方案 : 多柔比星和环磷酰胺序贯多西他赛 (AC T) 或紫杉醇加曲妥珠单抗 (AC TH); 多西他赛和卡铂加曲妥珠单抗 (TCH) j 每项比较的双侧 α 水平为 / 45
33 图 4 接受乳腺癌辅助治疗的患者的无病生存期 ( 试验 NSABP B31 和 NCCTG N9831) 图 5 接受乳腺癌辅助治疗的患者的总生存期 ( 试验 NSABP B31 和 NCCTG N9831) 图 6 33 / 45
34 接受乳腺癌辅助治疗的患者的无病生存期 ( 试验 BCIRG006) 根据 HER2 过表达或基因扩增, 对可获得中心实验室检测数据的试验 NCCTG N9831 和 BO16348 患者进行了 DFS 探索性分析 结果参见表 10 在试验 NCCTG N9831 中, 除 IHC 3+/FISH+ 亚组占有数据的患 者比例为 81% 外, 事件数较少 由于事件数少, 不能得出有关其他亚组内的有效性 的明确结论 试验 BO16348 中的事件数足以证明 IHC 3+/FISH 未知亚组及 FISH +/IHC 未知亚组中对 DFS 的显著效应 表 10 试验 NCCTG N9831 和试验 BO16348 中, 根据 HER2 过表达或基因扩增分类的治 疗结局 试验 NCCTG N9831 试验 BO16348 c a HER2 检测结果 患者数量 DFS 风险比 (95% CI) 患者数量 DFS 风险比 (95% CI) IHC 3+ FISH(+) (0.27, 0.64) (0.13, 2.50) FISH(-) (0.04, 11.79) 8 FISH 未知 (0.09, 5.14) (0.41, 0.69) IHC < 3+ / FISH (0.18, 5.65) 299 b 0.53 (0.20, 1.42) (+) IHC 未知 / FISH (+) (0.38, 0.93) a 在中心实验室进行的采用 HercepTest 法的 IHC 及采用 PathVysion 法的 FISH(HER2/CEP17 比值 2.0) b 试验 BO16348 中此类别的所有病例均为 IHC 2+ c 一年曲妥珠单抗治疗组的中位随访时间为 12.6 个月 BO16348 试验中包括来自中国的 122 例患者 ( 观察组 54 例和曲妥珠单抗 1 年治 疗组 68 例 ) 122 例中国患者平均年龄 46 岁 (26~67 岁 ) 绝大多数患者 (92%) 原发肿瘤病理类型为浸润性导管癌 50% 的患者为淋巴结阳性, 淋巴结阴性患者占 40%, 还有 10% 的患者由于接受了新辅助化疗而无法评估淋巴结状况 雌激素受体 34 / 45
35 阳性患者占 41% 91% 的患者辅助治疗中接受过蒽环类药物,26% 的患者接受了蒽 环类联合紫杉类药物辅助治疗 在 BO16348 试验进行 DFS 分析时, 中国患者中观 察组和曲妥珠单抗 1 年治疗组的 2 年无病生存率分别为 81.4% 和 92.9%, 曲妥珠单 抗 1 年治疗降低患者疾病复发转移或死亡风险 (HR 0.29, 95% CI , p=0.0489) 中国患者接受曲妥珠单抗辅助治疗后的临床获益趋势与 BO16348 试验总 体疗效一致 见表 11 a b 表 11 BO16348 试验中, 中国患者亚组治疗效果 中国患者 (BO16348 试验 ) 化疗 曲妥珠单抗 (n = 68) 化疗 观察 (n = 54) 主要终点 DFS 事件数 3 8 风险比 (95% CI) 0.29 (0.08, 1.08) p 值 a 次要终点 OS 事件数 1 3 风险比 95% CI 0.30 p 值 NS b 对数秩和检验 NS= 无显著差异 乳腺癌新辅助治疗 MO16432(NOAH) 试验中, 对共 10 个新辅助化疗联合曲妥珠单抗疗程 ( 蒽环 类抗生素和紫杉烷 (AP+H), 继之以 P+H, 再继之以 CMF+H) 的安全性和有效性 进行了研究 研究纳入了新诊断的局部晚期 (III 期 ) 或炎症性 HER2 表达阳性的乳 腺癌患者 实验组为新辅助 - 辅助治疗药物曲妥珠单抗合并用药, 对照组为单独新辅 助化疗, 继之以曲妥珠单抗辅助疗法, 共治疗 1 年 参数 无事件生存期出现事件的患者数量 表 12: 疗效分析概述 (MO16432/NOAH 试验 ) 化疗 + 曲妥珠单抗 (n=115) 仅化疗 (n=116) 总体病理学完全缓解 *(95% CI) 40% (31.0, 49.6) 20.7% (13.7, 29.2) * 是指乳腺和腋窝淋巴结处均未出现任何浸润癌 风险比 (95%CI) 0.65(0.44, 0.96) p= p= 对于主要研究终点 EFS, 患者接受曲妥珠单抗 + 新辅助化疗后, 继续曲妥珠单抗辅助 治疗, 共治疗 52 周, 疾病复发 / 进展的风险下降 35% 风险比转化为绝对获益值, 35 / 45
36 以 3 年无疾病生存率形式表示, 结果显示曲妥珠单抗组获益, 预估值高出 13 个百分点 (65% vs 52%) 转移性乳腺癌在一项随机对照 联合化疗的临床试验 (H0648g,n=469) 和一项开放的单药临床试验 (H0649g,n=222) 中, 对曲妥珠单抗联合化疗应用于转移性乳腺癌的安全性和有效性进行了研究 2 个试验均针对 HER2 蛋白过度表达的转移性乳腺癌患者 中心实验室免疫组化评估肿瘤组织 2 或 3 级过度表达 HER2 蛋白 ( 分为 0~3 级 ) 的患者符合入组条件 转移性乳腺癌的一线治疗 (H0648g) H0648g 为一项随机 开放的多中心临床试验, 在 469 位未接受化疗的转移性乳腺癌妇女中进行 肿瘤标本经 IHC 检测 ( 临床研究检测,CTA), 按 评分, 3+ 表示最强阳性 只有 2+ 或 3+ 阳性的肿瘤符合条件 ( 大约占筛查者 33%) 患者随机接受单一化疗或联合曲妥珠单抗治疗 曲妥珠单抗给予首剂负荷剂量 4 mg/kg 静脉输注, 之后每周 2 mg/kg 维持剂量治疗 对于在辅助治疗中曾接受蒽环类药物治疗的患者, 化疗采用紫杉醇 (175mg/m 2, 静脉输注至少 3 小时,21 天为 1 疗程, 至少 6 个疗程 ); 其他患者化疗采用蒽环类药物加环磷酰胺 (AC: 多柔比星 60 mg/m 2 或表柔比星 75mg/m 2 + 环磷酰胺 600 mg/m 2,21 天为 1 疗程,6 个疗程 ) 在此试验中,65% 随机分组接受单一化疗的患者在疾病进展时接受曲妥珠单抗治疗, 作为独立的扩展研究一部分 根据独立审查委员会的结论, 与仅接受化疗的患者相比, 随机接受曲妥珠单抗和化疗的患者中位疾病进展时间显著延长, 总缓解率 (ORR) 提高, 中位缓解持续时间延长 随机接受曲妥珠单抗和化疗的患者中位生存期亦较长 ( 见表 13) 这些治疗效果既见于接受曲妥珠单抗加紫杉醇患者, 也见于接受曲妥珠单抗加 AC 患者, 但是在联合紫杉醇组效果较好 表 13 H0648g: 转移性乳腺癌的一线治疗效果 曲妥珠单抗 + 所有化疗 (n=235) 联合治疗结果紫杉醇组 AC 组 所有化疗 (n = 234) 曲妥珠单抗 + 紫杉醇 (n = 92) 紫杉醇 (n=96) 曲妥珠单抗 + AC a (n=143) AC (n=138) 主要终点 中位 TTP( 月 ) b,c % 置信区间 7, 8 4, 5 5, 10 2, 4 7, 9 5, 7 P 值 d < < 次要终点 36 / 45
37 b 总缓解率 % 置信区间 39, 51 23, 35 28, 48 8, 22 42, 58 30, 46 e P 值 <0.001 < 中位缓解时间 ( 月 ) b,c %, 75% 四分位数 6, 15 4, 8 5, 11 4, 7 6, 15 4, 8 中位生存 ( 月 ) c % 置信区间 22, 30 17, 24 17, 29 13, 24 23, 33 18, 27 P 值 d a AC= 蒽环类药物 ( 多柔比星或表柔比星 ) 和环磷酰胺 b 由独立的评价委员会评估 c Kaplan-Meier 评估 d e χ 2 对数检验检验 H0648g 的数据显示, 临床疗效受益主要限于 HER2 蛋白过度表达水平最高 (3 +) 的患者 ( 见表 14) 表 14 H0648g 治疗效果与 HER2 阳性或扩增的关系 HER2 检测结 患者数量 疾病进展时间的相对危险性 ** 死亡率的相对危险性 ** 果 (N) (95% CI) (95% CI) CTA 2+ or (0.40, 0.61) 0.80 (0.64, 1.00) FISH (+)* (0.34, 0.57) 0.70 (0.53,0.91) FISH (-)* (0.42, 0.94) 1.06 (0.70,1.63) CTA (0.50, 1.15) 1.26 (0.82,1.94) FISH (+) (0.21, 1.35) 1.31 (0.53, 3.27) FISH (-) (0.48,1.25) 1.11 (0.68, 1.82) CTA (0.33, 0.54) 0.70 (0.51,0.90) FISH (+) (0.32, 0.55) 0.67 (0.51,0.89) FISH (-) (0.20, 0.94) 0.88 (0.39, 1.98) * 从参加试验的 469 名患者中的 451 名患者, 获得的 FISH 检测结果 ** 相对危险性代表与化疗组相比, 曲妥珠单抗加化疗组进展或死亡风险 转移性乳腺癌的二线或三线治疗 (H0649g) 在一项多中心 开放的单组临床试验 (H0649g) 中对 HER2 阳性的转移性乳腺 癌患者进行了曲妥珠单抗的单药试验, 这些患者先前针对转移性疾病接受过 1 或 2 次化疗 入选 222 位患者,66% 的患者先前接受过辅助化疗,68% 患者先前接受过 2 种化疗方案治疗转移疾病,25% 患者接受了预先清髓 造血重建治疗 患者接受曲 妥珠单抗首剂负荷剂量 4mg/kg 静脉输注, 随后每周一次 2 mg/kg 维持剂量静脉输注 治疗 37 / 45
38 由独立的评价委员会评估,ORR( 完全缓解 + 部分缓解 ) 为 14%, 其中完全缓解率为 2%, 部分缓解率为 12% 完全缓解仅见于肿瘤转移限于皮肤和淋巴结的患者 肿瘤检测为 CTA 3+ 的患者整体缓解率为 18%, 检测为 CTA 2+ 的患者缓解率为 6% 转移性胃癌在一项随机 (1:1) 对照 开放的多中心 III 期临床试验 (BO18255 试验 ) 中比较了曲妥珠单抗联合卡培他滨或 5-FU 和顺铂治疗 HER2 阳性的转移性胃癌患者的安全有效性 参加该试验的患者为此前未接受过治疗的转移性胃腺癌或胃食管交界腺癌 主要的终点指标为总生存期 总共入组 594 例患者, 从亚洲国家入组 314 例 ( 53%) 在计划的第二次中期分析时结果具有统计学意义的改善, 提前终止试验 分析时共 351 例随机入组的患者死亡 : 对照组 184 例患者 (62.2%), 试验组 167 例患者 (56.0%) 多数死亡病例与患者的癌症疾病有关 按照以下参数进行随机化分层 : 疾病程度 ( 转移与局部晚期 ) 原发部位( 胃 vs. 胃食管交界 ) 可测量肿瘤病灶( 有 vs. 无 ) ECOG 体力状况 (0 1 vs. 2) 和氟尿嘧啶 ( 卡培他滨 vs. 5- 氟尿嘧啶 ) 所有患者均为 HER2 基因扩增 (FISH+) 或 HER2 过度表达 (IHC 3+), 且要求患者具有适当的心脏功能 ( 如 LVEF > 50%) 在包含有曲妥珠单抗的治疗组中, 以静脉滴注给予曲妥珠单抗, 起始剂量 8 mg/kg, 后续剂量 6 mg/kg, 每 3 周一次, 直至出现疾病进展 在两个试验组中, 从第 1 天开始, 将顺铂以 80 mg/m 2 剂量进行 IV 给药, 滴注 2 小时, 每 3 周一次, 共 6 个周期 在两个研究组中, 将卡培他滨以 1000 mg/m 2 剂量进行口服给药, 每日两次 ( 总日剂量 2000 mg/m 2 ), 治疗 14 天, 每个周期 21 天, 共 6 个周期 另外一种氟尿嘧啶的替代治疗方法是, 从第 1 天至第 5 天, 连续静脉滴注 (CIV)5- 氟尿嘧啶 800 mg/m 2 / 天剂量, 每 3 周一次, 共 6 个周期 试验人群中位年龄 60 岁 ( 范围 :21~83 岁 );76% 为男性 ;53% 为亚洲人,38% 为高加索人,5% 为西班牙人,5% 为其它种族 / 人种 ;91% 的 ECOG PS 为 0 或 1;82% 患原发性胃癌,18% 患原发性胃食管交界腺癌 在这些患者中,23% 接受过胃切除手术,7% 接受过新辅助疗法和 / 或辅助疗法,2% 接受过放射疗法 采用非分层 log-rank 检验法分析主要终点指标 (OS), 基于 351 个死亡病例的最终 OS 分析结果具有统计学意义 ( 名义显著性水平 ), 在最终分析一年之后, 实施了 OS 更新分析 有关最终分析和更新分析的有效性结果总结, 请见表 15 和图 7 表 15 BO18255 试验 :ITT 人群总生存期 FC 组 N=296 FC + H 组 N= / 45
39 最终 ( 二次期中分析 ) 总生存期死亡数量 (%) 中位值 95% CI ( 月 ) 风险比 95% CI p 值 *, 双侧更新的总生存期死亡数量 (%) 中位值 95% CI ( 月 ) 风险比 95% CI * 与名义显著性水平 相比 184 (62.2%) 11.0 (9.4, 12.5) 227 (76.7%) 11.7 (10.3, 13.0) 0.73 (0.60, 0.91) (0.67, 0.97) 167 (56.0%) 13.5 (11.7, 15.7) 221 (74.2%) 13.1 (11.9, 15.1) 图 7 转移性胃癌患者中的总生存期更新结果 (ToGA 试验 ) 在意向性治疗人群中基于 HER2 基因扩增 (FISH) 和蛋白过表达 (IHC) 检测结果进行了 OS 探索性分析, 结果显示 HER2 阳性 (IHC 2+ 且 FISH+ 或 IHC 3+) 患者, 化疗联合曲妥珠单抗组与单纯化疗组的中位生存期分别为 16 个月及 11.8 个月,HR 0.65 (95 % CI ); 中位无进展生存期分别为 7.6 个月及 5.5 个月, HR 0.64 (95 % CI ) 其余请见表 / 45
40 表 16 采用更新的总生存期结果按 HER2 状况划分的探索性分析结果 FC (N= 296) a FC+H (N=298) b FISH+ / IHC 0, 1+ 亚组 (N=133) 死亡数量 /n (%) 中位 OS 时间 ( 月 ) 95% CI ( 月 ) 57/71 (80%) 8.8 (6.4, 11.7) 风险比 (95% CI) 1.33 (0.92, 1.92) 56/62 (90%) 8.3 (6.2, 10.7) FISH+ / IHC2+ 亚组 (N=160) 死亡数量 /n (%) 中位 OS 时间 ( 月 ) 95% CI ( 月 ) 65/80 (81%) 10.8 (6.8, 12.8) 64/80 (80%) 12.3 (9.5, 15.7) 风险比 (95% CI) 0.78 (0.55, 1.10) FISH+ or FISH-/IHC3+ c a b c 死亡数量 /n (%) 中位 OS 时间 ( 月 ) 95% CI ( 月 ) 亚组 (N=294) 104/143 (73%) 13.2 (11.5,15.2) 风险比 (95% CI) 0.66 (0.50, 0.87) 96/151 (64%) 18.0 (15.5, 21.2) 本探索性亚组分析中, 剔除了 FC 组中两例 FISH+( 但 IHC 状况不详 ) 的患者 本探索性亚组分析中, 剔除了含有曲妥珠单抗药物治疗组中 5 例 FISH+( 但 IHC 状况不详 ) 的患者 包括了化疗组 6 例 曲妥珠单抗组 10 例 FISH- IHC3+ 患者, 化疗组 8 例 曲妥珠单抗组 8 例 FISH 状况不详的 IHC 3+ 患者 中国亚组患者的有效性结果 ( 临床截止日期 2009 年 1 月 7 日 ) 中国有 15 家研究中心参与了该试验, 有 614 例患者接受了 HER2 筛选,HER2 阳性率为 22.7% 在 HER2 阳性的中国患者中 85 例符合了入选标准进入本试验 曲妥珠单抗组 36 例, 化疗组 49 例 但两个治疗组的患者人口统计学特征 疾病特征 以及随机化分层因素 ( 疾病范围 原发疾病部位 可测量性 ECOG 体力状况和化疗情况 ) 均平衡良好 约 95% 的患者具有转移疾病, 主要原发部位在胃部 ( 约 80%) 约 80% 的患者 ECOG 体力状况为 0~1, 除 1 例患者外的所有患者都接受了卡培他滨治疗 结果显示, 与单独化疗相比, 化疗方案 ( 氟尿嘧啶和顺铂 ) 中增加曲妥珠单抗治疗 HER2 阳性转移性胃癌中国患者, 总生存期得到改善 ( 中位生存期 12.6 个月 vs 9.7 个月 ),FP+H 组的死亡风险较 FP 组降低了 28%(HR 0.72; 95% CI [0.40~1.29]), 与 BO18255 试验总体人群报告的结果保持了一致 ( 中位生存期 13.8 个月 vs 11.1 个月,HR 0.74; 95% CI [0.60~0.91])( 表 17) 表 17 总生存期总结 (FAS) 40 / 45
41 氟尿嘧啶 / 顺铂 曲妥珠单抗 / 氟尿 嘧啶 / 顺铂 (N=48) (N=36) 出现事件的患者 28 (58.3%) 19 (52.8%) 无事件患者 * 20 (41.7%) 17 (47.2%) 出现事件时间 ( 月 ) 中位数 # 中位数的 95% CI# [6 ; 18] [10 ; 18] 风险比 % CI [0.40 ; 1.29] 氟尿嘧啶 : 由研究者选择使用卡培他滨或 5- FU * 已截尾 # Kaplan-Meier 评估 ## 包括已截尾的观测值 事件 = 任何原因导致的死亡 截尾 = 最后肿瘤评估 或 药物记录中的最后日期 或 试验期间最后记录的日期 或 试验 后抗肿瘤治疗的最后日期 或 存活随访的最后日期 中最后的日期 FAS: 全分析集, 包括至少接受了一次试验药物的所有随机化患者 总生存期的 Kaplan-Meier 曲线如图 8 所示, 两条曲线在 4 个月后的观察期基本 保持了分离状态 图 8 中国亚组患者的总生存期的 Kaplan-Meier 曲线 (FAS) 所有其他次要疗效终点 ( 如无进展生存期 (PFS) 疾病进展时间 (TTP) 缓 解率 临床获益率和缓解持续时间 ) 均得到了改善, 也显示出与总人群分析结果一 致的趋势 ( 表 18) 无进展生存期 参数 表 18 次要有效性终点总结 (FAS) 氟尿嘧啶 / 顺铂 曲妥珠单抗 / 氟尿嘧啶 / 顺铂 N = 48 N = / 45
42 中位数 ( 月 ) HR(95% CI) 0.69[0.41 ; 1.15] 疾病进展时间中位数 ( 月 ) HR(95% CI) 0.67[0.39 ; 1.15] 总体缓解率完全缓解 2 (4.2%) 2 (5.6%) 部分缓解 14 (29.2%) 11 (30.6%) 疾病稳定 13 (27.1%) 13 (36.1%) 疾病进展 9 (18.8%) 5 (13.9%) 缺失评估 10 (20.8%) 5 (13.9%) 缓解人数 (CR + PR) 16 (33.3%) 13 (36.1%) 临床获益率 (CR + PR + SD) 29 (60.4%) 26 (72.2%) 缓解持续时间分析中包含的患者 13 (100.0%) 16 (100.0%) 中位数 ( 月 ) HR(95% CI) 0.56[0.23 ; 1.35] HER2 表达是曲妥珠单抗治疗的靶点, 中国亚组患者中 HER2 阳性的患者分别为 FP 组 34 例,FP+H 组 28 例 HER2 阳性定义为 IHC 2+/FISH+ 和 IHC 3+ 一项探索性分析发现,HER2 阳性患者中 FP+H 组和 FP 组的中位生存期分别为 16 个月和 9.7 个月 (HR 0.55;95%CI [0.26; 1.18]) 这一结果提示,HER2 阳性患者接受曲妥珠单抗治疗可能会获得更多的临床受益 在 BO18255 试验的总分析报告中也阐述了相似的结果 药理毒理 作用机制曲妥珠单抗是一种重组人源化单克隆抗体, 特异性地作用于人表皮生长因子受体 -2(HER2) 的细胞外部位 此抗体含人 IgG1 亚型框架, 互补决定区源自鼠抗 p185 HER2 抗体, 能够与人 HER2 蛋白结合 HER2 原癌基因或 C-erbB2 编码一个单一的受体样跨膜蛋白, 分子量 185kDa, 其结构上与其他表皮生长因子受体类似 在原发性乳腺癌患者中观察到有 25%~30% 的患者 HER2 阳性 HER2 基因扩增可导致肿瘤细胞表面 HER2 蛋白表达增加, 导致 HER2 蛋白活化 曲妥珠单抗在体外及动物实验中均显示可抑制 HER2 阳性的肿瘤细胞的增殖 另外, 曲妥珠单抗是抗体依赖的细胞介导的细胞毒反应 (ADCC) 的潜在介质 在体外研究中, 曲妥珠单抗介导的 ADCC 被证明在 HER2 过度表达的癌细胞中比 HER2 非过度表达的癌细胞中更优先产生 致癌作用 遗传毒性 对生育的损害 42 / 45
43 未检测曲妥珠单抗的致癌潜能 在标准 Ames 细菌和人外周血淋巴细胞致突变试验中, 曲妥珠单抗浓度达到 5000µg/mL 时, 未观察到致突变反应 在体内微核试验中, 快速静脉注射达到 118mg/kg 的曲妥珠单抗后, 未有观察到小鼠骨髓细胞染色体损害的证据 生育研究在雌性猕猴体内完成, 曲妥珠单抗每周给药剂量高达人类维持剂量 2mg/kg 的 25 倍, 未发现生育受损 曲妥珠单抗对男性生育能力的影响未进行研究 药代动力学 在群体药代动力学模型分析中, 采用来自 18 项 I II 和 III 期试验, 接受曲妥珠 单抗静脉输注制剂治疗的 1582 例受试者的合并数据, 对曲妥珠单抗的药代动力学进 行了评价 采用二室模型, 基于来自中央室的平行线性和非线性消除途径描述了曲 妥珠单抗的浓度 - 时间曲线 由于是非线性消除途径, 总清除率随着浓度降低而升高 乳腺癌 (MBC/EBC) 的线性清除率为 L/ 日, 胃癌为 L/ 日 非线性消除 参数中, 最大消除率 (Vmax) 为 8.81 mg/ 日, 米氏常数 (Km) 为 8.92 mg/l 乳腺 癌患者的中央室容积为 2.62 L, 胃癌 (AGC) 患者为 3.63 L 表 19( 第 1 周期 ) 和表 20( 稳态 ) 给出了批准的每周给药方案和 3 周给药方案 治疗后乳腺癌和胃癌患者中群体药代动力学预测的暴露量 (5th - 95th 百分位数 ) 和 PK 参数结果在临床相关浓度 (Cmax 和 Cmin) 下的结果 表 19: 乳腺癌和胃癌患者中静脉给药方案的群体药代动力学预测的第 1 周期暴露量 结果 (5 th - 95 th 百分位数 ) 给药方案 原发肿瘤类型 N C min (µg/ml) C max (µg/ml) AUC (µg. 日 /ml) 8mg/kg + 6mg/kg MBC/EBC ( ) 178 ( ) 1373 ( ) 3 周给药 AGC ( ) 132 ( ) 1109 ( ) 4mg/kg + 2mg/kg 每周给药 MBC/EBC ( ) 88.3 (58-144) 1066 ( ) 43 / 45
44 表 20: 乳腺癌和 AGC 患者中曲妥珠单抗静脉给药方案的群体药代动力学预测的稳态暴露量结果 (5 th - 95 th 百分位数 ) 给药方案 原发肿瘤类型 N C min,ss (µg/ml) C max,ss (µg/ml) AUC ss (µg. 日 /ml) 达稳态时间 ( 周 ) 稳态时的总 CL 范围 (L/ 日 ) 8mg/kg + 6mg/kg 3 周给药 MBC/ EBC (5-115) AGC ( ) 179 ( ) 131 ( ) 1794 ( ) 1338 ( ) mg/kg + 2mg/kg 每周给药 MBC/ EBC ( ) 109 ( ) 1765 ( ) 肾功能不全的患者没有在肾功能不全的患者中进行具体的药代动力学研究 在群体药代动力学分析中显示, 肾功能不全不影响曲妥珠单抗的处置 老年人年龄对曲妥珠单抗的处置没有显示出影响 贮藏 2~8 避光保存和运输 复溶后溶液的有效期本品用配套提供的稀释液溶解后在 2~8 可稳定保存 28 天 配好的溶液中含防腐剂, 因此可多次使用 28 天后剩余的溶液应弃去 已知对苯甲醇过敏的患者在给于曲妥珠单抗时 ( 参见 注意事项 ), 应使用无菌注射用水复溶 对于使用无菌注射用水复溶后的曲妥珠单抗, 每瓶曲妥珠单抗应只给药 1 次 复溶后的溶液应被立即使用 弃去未使用部分 不得将配好的溶液冷冻 含复溶后溶液的输注用溶液的有效期含 0.9% 氯化钠溶液的配好的曲妥珠单抗输注液, 可在聚氯乙烯 聚乙烯或聚丙烯袋中 2~8 条件下稳定保存 24 小时 由于稀释后的曲妥珠单抗不含有效浓度的防腐剂, 配置和稀释后溶液最好保存在 2~8 条件下 为控制微生物污染, 输注液应马上使用 除非稀释是在严格控制和证实为无菌条件下进行的, 否则稀释后的溶液不能保存 请勿在瓶后所示的有效期后使用此药 药品应存放于小孩接触不到处 44 / 45
45 包装 1 瓶 / 盒 ( 含稀释液 ), 稀释液为含 1.1% 苯甲醇的 20ml 灭菌注射用水 有效期 2~8 避光保存和运输,36 个月 执行标准 JS 批准文号 进口药品注册证号 :S , S 分装批准文号 : 国药准字 J 生产企业 公司名称 : Roche Pharma (Schweiz) Ltd. 地址 : Schoenmattstrasse 2, 4153 Reinach, Switzerland 生产厂名称 :Genentech Inc. 地址 :4625 NE Brookwood Parkway Hillsboro, OR USA 稀释液生产厂名称 :F. Hoffmann-La Roche Ltd. 地址 :Wurmisweg,4303 Kaiseraugst,Switzerland 分装企业 : 上海罗氏制药有限公司 地 址 : 上海市浦东新区龙东大道 1100 号 邮政编码 : 电话号码 :(021) 传真号码 :(021) 免费咨询电话 : ( 手机 ), ( 固话 )( 人工接听时间 周一至周五 9:00-18:00) 由于说明书更新较快, 如需参阅最新批准的中文说明书, 请访问罗氏中国网站 : 45 / 45
Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang DNA ( CHO) 1.1% 20ml L -L -α,α mg 21mg/ml HER2 1 HER2 5- HER2 HER2 HER2 IHC3+ IHC2+
 2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 2015 11 04 2016 04 12 2017 05 11 2018 07 04 2018 07 31 24 1 / 45 Herceptin Trastuzumab Injection Zhusheyong
2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 2015 11 04 2016 04 12 2017 05 11 2018 07 04 2018 07 31 24 1 / 45 Herceptin Trastuzumab Injection Zhusheyong
Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang DNA ( CHO) 1.1% 20ml L - L-α,α mg 21mg/ml HER2 1 HER2 5- HER2 2 / 52
 2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 2015 11 04 2016 04 12 2017 05 11 24 1 / 52 Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang
2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 2015 11 04 2016 04 12 2017 05 11 24 1 / 52 Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang
Microsoft Word - 440mg_CDS RP 13.1&14.0_Clean
 2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 24 Herceptin 1 / 46 Trastuzumab Injection Zhusheyong Qutuozhu Dankang DNA ( CHO) 1.1% 20ml L-L-α,α- 20
2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 2015 01 26 24 Herceptin 1 / 46 Trastuzumab Injection Zhusheyong Qutuozhu Dankang DNA ( CHO) 1.1% 20ml L-L-α,α- 20
药 品 名 称 通 用 名 : 商 品 名 : 英 文 名 : 注 射 用 曲 妥 珠 单 抗 赫 赛 汀 Herceptin Trastuzumab Injection 汉 语 拼 音 : Zhusheyong Qutuozhu Dankang 成 份 活 性 成 份 : 曲 妥 珠 单 抗 曲
 核 准 日 期 :2009 年 07 月 31 日 修 改 日 期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 2015 年 01 月 26 日 2015 年 11 月 04 日 注 射 用 曲 妥 珠 单
核 准 日 期 :2009 年 07 月 31 日 修 改 日 期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 2015 年 01 月 26 日 2015 年 11 月 04 日 注 射 用 曲 妥 珠 单
[ ] DNA ( CHO) 1.1% 20ml L - L-α,α 20 [ ] 440mg 21mg/ml [ ] HER2 1 HER2 5- HER2 HER2 HER2 IHC3+ IHC2+/FISH+ [ ] 440 mg(20 ml)/ 2 / 44
![[ ] DNA ( CHO) 1.1% 20ml L - L-α,α 20 [ ] 440mg 21mg/ml [ ] HER2 1 HER2 5- HER2 HER2 HER2 IHC3+ IHC2+/FISH+ [ ] 440 mg(20 ml)/ 2 / 44 [ ] DNA ( CHO) 1.1% 20ml L - L-α,α 20 [ ] 440mg 21mg/ml [ ] HER2 1 HER2 5- HER2 HER2 HER2 IHC3+ IHC2+/FISH+ [ ] 440 mg(20 ml)/ 2 / 44](/thumbs/40/20823068.jpg) 2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 24 [ ] Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang 1 / 44 [ ] DNA ( CHO) 1.1% 20ml L - L-α,α 20 [
2009 07 31 2011 03 30 2011 12 13 2012 05 22 2012 08 15 2012 08 30 2012 11 29 2013 07 08 24 [ ] Herceptin Trastuzumab Injection Zhusheyong Qutuozhu Dankang 1 / 44 [ ] DNA ( CHO) 1.1% 20ml L - L-α,α 20 [
核准日期 :2009 年 07 月 31 日修改日期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 201
 核准日期 :2009 年 07 月 31 日修改日期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 2015 年 01 月 26 日 2015 年 11 月 04 日 2016 年 04 月 12 日 2017
核准日期 :2009 年 07 月 31 日修改日期 :2011 年 03 月 30 日 2011 年 12 月 13 日 2012 年 05 月 22 日 2012 年 08 月 15 日 2012 年 08 月 30 日 2012 年 11 月 29 日 2013 年 07 月 08 日 2015 年 01 月 26 日 2015 年 11 月 04 日 2016 年 04 月 12 日 2017
卡培他滨片使用说明书
 200 7 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 2014 08 27 2016 01 25 2016 07 05 2018 03 02 INR / 1 >60 Capecitabine Tablets Kapeitabin
200 7 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 2014 08 27 2016 01 25 2016 07 05 2018 03 02 INR / 1 >60 Capecitabine Tablets Kapeitabin
Microsoft Word - Perjeta_0715-PER-01_annotated
 0715-PER-01 0713-PER-01 420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA PERJETA PERJETA PERJETA - 1 1.1 PERJETA trastuzumabherceptin docetaxel HER2 HER2 1.2 PERJETA trastuzumab docetaxel HER2 2 cm [
0715-PER-01 0713-PER-01 420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA PERJETA PERJETA PERJETA - 1 1.1 PERJETA trastuzumabherceptin docetaxel HER2 HER2 1.2 PERJETA trastuzumab docetaxel HER2 2 cm [
批准日期:
 2010 02 26 2010 04 10 2010 07 29 2011 03 30 2011 07 25 2011 09 20 2011 12 16 2012 09 17 2013 01 21 2015 07 01 2015 11 25 2016 11 30 2017 05 08 1 , Avastin Bevacizumab Injection Bei Fa Zhu Dankang Zhusheye
2010 02 26 2010 04 10 2010 07 29 2011 03 30 2011 07 25 2011 09 20 2011 12 16 2012 09 17 2013 01 21 2015 07 01 2015 11 25 2016 11 30 2017 05 08 1 , Avastin Bevacizumab Injection Bei Fa Zhu Dankang Zhusheye
Microsoft Word - Perjeta_US PI 2013Apr_05.13-PER-3A01_0713-PERJ-01
 420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA - 1 PERJETA Herceptin docetaxel HER2 HER2 2 2.1 PERJETA 840 mg 60 3 420 mg 30 60 trastuzumab PERJETA trastuzumab 8 mg/kg 90 3 6 mg/kg 30 90 PERJETA trastuzumab
420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA - 1 PERJETA Herceptin docetaxel HER2 HER2 2 2.1 PERJETA 840 mg 60 3 420 mg 30 60 trastuzumab PERJETA trastuzumab 8 mg/kg 90 3 6 mg/kg 30 90 PERJETA trastuzumab
美罗华注射液
 2006 10 13 2007 05 10 2007 11 12 2008 06 03 2008 11 14 2009 03 09 2009 06 17 2009 07 30 2010 02 26 2010 05 21 2011 03 30 2012 01 04 2012 04 12 2012 05 17 2012 08 24 2013 07 11 2013 10 16 MabThera Rituximab
2006 10 13 2007 05 10 2007 11 12 2008 06 03 2008 11 14 2009 03 09 2009 06 17 2009 07 30 2010 02 26 2010 05 21 2011 03 30 2012 01 04 2012 04 12 2012 05 17 2012 08 24 2013 07 11 2013 10 16 MabThera Rituximab
Microsoft Word - Perjeta_CDS _0916-PER-01_Clean
 0916-PER-01 Product Information 420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA PERJETA PERJETA PERJETA - 1 1.1 PERJETA Herceptin (trastuzumab) docetaxel HER2 HER2 1.2 PERJETA Herceptin (trastuzumab)
0916-PER-01 Product Information 420 PERJETA Vial 420mg Pertuzumab 000942 - PERJETA PERJETA PERJETA PERJETA - 1 1.1 PERJETA Herceptin (trastuzumab) docetaxel HER2 HER2 1.2 PERJETA Herceptin (trastuzumab)
Microsoft Word - PI-Draft IM
 26 1 23 26 11 12 27 3 22 27 4 28 27 5 24 28 12 9 29 2 11 29 3 15 29 9 8 21 4 8 211 4 29 212 2 27 212 11 6 213 12 5 Tarceva Erlotinib Hydrochloride Tablets Yansuan Eluotini Pian N-(3-)-6,7- (2- )-4- C 22
26 1 23 26 11 12 27 3 22 27 4 28 27 5 24 28 12 9 29 2 11 29 3 15 29 9 8 21 4 8 211 4 29 212 2 27 212 11 6 213 12 5 Tarceva Erlotinib Hydrochloride Tablets Yansuan Eluotini Pian N-(3-)-6,7- (2- )-4- C 22
Microsoft Word - Herceptin IV_CDS17.0_0318-HER-01_clean
 0318-HER-01 150 440 440 Herceptin Vial 150 mg Vial 440 mg Trastuzumab HERCEPTIN Herceptin( )Herceptinanthracycline Herceptin Herceptin Herceptin Herceptin Herceptin 24 Herceptin Herceptin 1 Herceptin
0318-HER-01 150 440 440 Herceptin Vial 150 mg Vial 440 mg Trastuzumab HERCEPTIN Herceptin( )Herceptinanthracycline Herceptin Herceptin Herceptin Herceptin Herceptin 24 Herceptin Herceptin 1 Herceptin
沈 雷 等 乳腺癌新辅助化疗的研究进展 的关注 新辅助化疗最初应用于不可手术的局部晚期乳腺癌 # /5 患者 通过术前给予化疗 缩小肿瘤 使得许多原本不可手术的患者获得了手术治疗的机会 从而提高患者的生活质量 改善生存期 新辅助化疗在这部分患者中的应用获得了广泛的认同 随后的临床试验也证明 原本肿块
 复旦学报 医学版 乳腺癌新辅助化疗的研究进展 沈 雷 综述 张宏伟 审校 复旦大学附属中山医院普外科 上海 摘要 近年 乳腺癌新辅助化疗的研究不再局限于局部晚期乳腺癌 炎性乳腺癌或肿块较大不可保乳的乳腺癌患者 研究的范围进一步扩大到可手术的早期乳腺癌 这得益于进一步认识到新辅助化疗的优势 新辅助化疗不仅提高了保乳率 更便于了解患者对化疗方案的敏感性 甚至预测患者的预后 从而指导临床化疗方案的调整 本文将对新辅助化疗药物的选择
复旦学报 医学版 乳腺癌新辅助化疗的研究进展 沈 雷 综述 张宏伟 审校 复旦大学附属中山医院普外科 上海 摘要 近年 乳腺癌新辅助化疗的研究不再局限于局部晚期乳腺癌 炎性乳腺癌或肿块较大不可保乳的乳腺癌患者 研究的范围进一步扩大到可手术的早期乳腺癌 这得益于进一步认识到新辅助化疗的优势 新辅助化疗不仅提高了保乳率 更便于了解患者对化疗方案的敏感性 甚至预测患者的预后 从而指导临床化疗方案的调整 本文将对新辅助化疗药物的选择
美罗华注射液
 2006 10 13 2007 05 10 2007 11 12 2008 06 03 2008 11 14 2009 03 09 2009 06 17 2009 07 30 2010 02 26 2010 05 21 2011 03 30 2012 01 04 2012 04 12 2012 05 17 2012 08 24 2013 07 11 2013 10 16 2014 07 22 2015
2006 10 13 2007 05 10 2007 11 12 2008 06 03 2008 11 14 2009 03 09 2009 06 17 2009 07 30 2010 02 26 2010 05 21 2011 03 30 2012 01 04 2012 04 12 2012 05 17 2012 08 24 2013 07 11 2013 10 16 2014 07 22 2015
C 22H 23 N 3 O 4 HCl EGFR NSCLC ++ NSCLC NSCLC EGFR 15mg/
 26 1 23 26 11 12 27 3 22 27 4 28 27 5 24 28 12 9 29 2 11 29 3 15 29 9 8 21 4 8 211 4 29 212 2 27 212 11 6 213 12 5 217 1 17 217 3 1 Tarceva Erlotinib Hydrochloride Tablets Yansuan Eluotini Pian N-(3-)
26 1 23 26 11 12 27 3 22 27 4 28 27 5 24 28 12 9 29 2 11 29 3 15 29 9 8 21 4 8 211 4 29 212 2 27 212 11 6 213 12 5 217 1 17 217 3 1 Tarceva Erlotinib Hydrochloride Tablets Yansuan Eluotini Pian N-(3-)
C 22H 23 N 3 O 4 HCl EGFR NSCLC ++ NSCLC NSCLC EGFR 150mg/
 2006 10 23 2006 11 12 2007 03 22 2007 04 28 2007 05 24 2008 12 09 2009 02 11 2009 03 15 2009 09 08 2010 04 08 2011 04 29 2012 02 27 2012 11 06 2013 12 05 2017 01 17 2017 03 10 2018 07 30 Tarceva Erlotinib
2006 10 23 2006 11 12 2007 03 22 2007 04 28 2007 05 24 2008 12 09 2009 02 11 2009 03 15 2009 09 08 2010 04 08 2011 04 29 2012 02 27 2012 11 06 2013 12 05 2017 01 17 2017 03 10 2018 07 30 Tarceva Erlotinib
CFDA BRAF V mg CFDA BRAF V600 BRAF 960 mg QTc mg 2
 2017 3 10 2017 5 26, Zelboraf Vemurafenib film-coated tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 CFDA BRAF V600 240 mg CFDA BRAF V600 BRAF 960
2017 3 10 2017 5 26, Zelboraf Vemurafenib film-coated tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 CFDA BRAF V600 240 mg CFDA BRAF V600 BRAF 960
CFDA BRAF V mg CFDABRAF V600 BRAF 960 mg QTc mg 2
 2017 3 10, Zelboraf Vemurafenib Film-coated Tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 CFDA BRAF V600 240 mg CFDABRAF V600 BRAF 960 mg 240 12
2017 3 10, Zelboraf Vemurafenib Film-coated Tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 CFDA BRAF V600 240 mg CFDABRAF V600 BRAF 960 mg 240 12
使用前注意在接受帕妥珠单抗治疗前, 应进行 HER2 检测, 帕妥珠单抗只能用于 HER2 阳性的乳腺癌患者 HER2 阳性定义为经已验证的检测方法评估, 免疫组织化学法 (IHC) 得分为 3+ 或原位杂交法 (ISH) 比值 2.0 该检测必须在专业实验室进行, 以确保结果的可靠性 有关检测性能
 核准日期 :2018 年 12 月 17 日 修改日期 : 帕妥珠单抗注射液说明书 请仔细阅读说明书并在医师指导下使用 警告 : 左心室功能不全和胚胎 - 胎儿毒性 左心室功能不全 : 本品可导致亚临床和临床心力衰竭, 表现为 LVEF 下降和 CHF 治疗前和治疗期间需要评估患者的心脏功能 如果确认发生具有临床意义的左心室功能下降, 应停止本品治疗 胚胎 - 胎儿毒性 : 暴露本品可导致胚胎 -
核准日期 :2018 年 12 月 17 日 修改日期 : 帕妥珠单抗注射液说明书 请仔细阅读说明书并在医师指导下使用 警告 : 左心室功能不全和胚胎 - 胎儿毒性 左心室功能不全 : 本品可导致亚临床和临床心力衰竭, 表现为 LVEF 下降和 CHF 治疗前和治疗期间需要评估患者的心脏功能 如果确认发生具有临床意义的左心室功能下降, 应停止本品治疗 胚胎 - 胎儿毒性 : 暴露本品可导致胚胎 -
Bonviva
 核 准 日 期 :26 年 1 月 修 改 日 期 :26 年 11 月 27 年 3 月 27 年 4 月 27 年 5 月 28 年 12 月 29 年 2 月 29 年 3 月 29 年 9 月 21 年 4 月 211 年 4 月 212 年 2 月 212 年 11 月 盐 酸 厄 洛 替 尼 片 说 明 书 请 仔 细 阅 读 说 明 书 并 在 医 师 指 导 下 使 用 药 品 名
核 准 日 期 :26 年 1 月 修 改 日 期 :26 年 11 月 27 年 3 月 27 年 4 月 27 年 5 月 28 年 12 月 29 年 2 月 29 年 3 月 29 年 9 月 21 年 4 月 211 年 4 月 212 年 2 月 212 年 11 月 盐 酸 厄 洛 替 尼 片 说 明 书 请 仔 细 阅 读 说 明 书 并 在 医 师 指 导 下 使 用 药 品 名
16SlidesFirstLineArimidex
 NCCN 乳腺癌中国版指南解读 乳腺癌术后辅助治疗 中国医学科学院肿瘤医院徐兵河 国外乳腺癌治疗指南 NCCN 指南 ASCO 指南 St. Gallen 共识 国内乳腺癌治疗指南 NCCN 中国版指南 中国抗癌协会乳腺癌专业委员会 乳腺癌治疗指南 如何决定哪些患者需要化疗? 患者 : 年龄 月经状况 血常规 重要器官功能 有无其他疾病等 肿瘤 : 病理类型 分化程度 淋巴结状态 HER-2 及激素受体状况
NCCN 乳腺癌中国版指南解读 乳腺癌术后辅助治疗 中国医学科学院肿瘤医院徐兵河 国外乳腺癌治疗指南 NCCN 指南 ASCO 指南 St. Gallen 共识 国内乳腺癌治疗指南 NCCN 中国版指南 中国抗癌协会乳腺癌专业委员会 乳腺癌治疗指南 如何决定哪些患者需要化疗? 患者 : 年龄 月经状况 血常规 重要器官功能 有无其他疾病等 肿瘤 : 病理类型 分化程度 淋巴结状态 HER-2 及激素受体状况
卡培他滨片使用说明书
 200 7 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 2014 08 27 2016 01 25 2016 07 05 INR / 1 >60 Capecitabine Tablets Kapeitabin Pian
200 7 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 2014 08 27 2016 01 25 2016 07 05 INR / 1 >60 Capecitabine Tablets Kapeitabin Pian
CFDA BRAF V mg CFDA BRAF V600 BRAF 960 mg QTc mg 2 / 27
 2017 3 10 2017 5 26 2017 11 29 2018 7 24, Zelboraf Vemurafenib film-coated tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 / 27 CFDA BRAF V600 240
2017 3 10 2017 5 26 2017 11 29 2018 7 24, Zelboraf Vemurafenib film-coated tablets Weimofeini Pian -1- {3-[5-(4- )-1H- [2,3- b] -3- ]-2,4- } - C 23H 18 ClF 2 N 3 O 3 S 489.93 1 / 27 CFDA BRAF V600 240
为研究人群, 开展与原研药 头对头 比较的等效性研究, 主要终点选择敏感的疗效指标客观缓解率 (ORR) 作为替代终点 b. 选择国内已经获批适应症 未接受过化疗的 HER2 阳性转移性胃腺癌或胃食管交界腺癌 (AGC) 为研究人群, 开展与原研药 头对头 比较的等效性研究, 主要终点选择敏感的疗效
 注射用曲妥珠单抗生物类似药临床研究设计及审评考虑要点 ( 征求意见稿 ) 一 前言曲妥珠单抗 (Trastuzumab) 是由瑞士罗氏公司研发的一种重组 DNA 衍生的人源化单克隆抗体, 含人 IgG1 亚型框架, 互补决定区源自鼠抗 p185 HER2 抗体, 能够特异性地作用于人表皮生长因子受体 -2(HER2) 的细胞外部位第 IV 亚区, 竞争性阻断人体表皮生长因子与 HER2 的结合, 从而抑制肿瘤细胞的生长
注射用曲妥珠单抗生物类似药临床研究设计及审评考虑要点 ( 征求意见稿 ) 一 前言曲妥珠单抗 (Trastuzumab) 是由瑞士罗氏公司研发的一种重组 DNA 衍生的人源化单克隆抗体, 含人 IgG1 亚型框架, 互补决定区源自鼠抗 p185 HER2 抗体, 能够特异性地作用于人表皮生长因子受体 -2(HER2) 的细胞外部位第 IV 亚区, 竞争性阻断人体表皮生长因子与 HER2 的结合, 从而抑制肿瘤细胞的生长
 WHO ---- ---- , 200 5% 8.6% 18.8% 200, 140 , MS MS 60 80 X 1999 WHO MS (2004.12) 1. BMI>25 >24 >28 BMI kg / m 2 2. 6.1mmol/L, 2h 7.8mmol/L 3. BP 140/90mmHg ( ) 4. TG 1.7 mmol/l /L HDL-C C
WHO ---- ---- , 200 5% 8.6% 18.8% 200, 140 , MS MS 60 80 X 1999 WHO MS (2004.12) 1. BMI>25 >24 >28 BMI kg / m 2 2. 6.1mmol/L, 2h 7.8mmol/L 3. BP 140/90mmHg ( ) 4. TG 1.7 mmol/l /L HDL-C C
Microsoft Word - Approved PI-clean (updated )
 2007 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 INR / 1 >60 Capecitabine Tablets Kapeitabin Pian 5 --5--N-[()]- O N H N O Me 4 3
2007 02 14 2007 03 23 2008 06 30 2008 07 01 2008 07 29 2010 02 12 2010 05 27 2011 09 14 2012 05 15 2012 08 24 2014 01 06 INR / 1 >60 Capecitabine Tablets Kapeitabin Pian 5 --5--N-[()]- O N H N O Me 4 3
儿科学 儿科学 儿科学 儿科学 儿科学 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 耳鼻咽喉科学 ( 专业学位 ) 非定向 全国统考
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
Microsoft Word - Kadcyla_CDS3.0_12.13-KAD-3B01_0314-KAD-01_Current_Clean
 0314-KAD-01 寧 KADCYLA 100 160 Vial 100 mg Trastuzumab Emtansine Vial 160 mg KADCYLA Trastuzumab Trastuzumab KADCYLA - KADCYLA KADCYLA KADCYLA KADCYLA KADCYLA (2.2 5.1) KADCYLA (LVEF) KADCYLA KADCYLA (2.2
0314-KAD-01 寧 KADCYLA 100 160 Vial 100 mg Trastuzumab Emtansine Vial 160 mg KADCYLA Trastuzumab Trastuzumab KADCYLA - KADCYLA KADCYLA KADCYLA KADCYLA KADCYLA (2.2 5.1) KADCYLA (LVEF) KADCYLA KADCYLA (2.2
批准日期:
 核 准 日 期 :2010 年 02 月 26 日 修 改 日 期 :2010 年 04 月 10 日 2010 年 07 月 29 日 2011 年 03 月 30 日 2011 年 07 月 25 日 2011 年 09 月 20 日 2011 年 12 月 16 日 2012 年 09 月 17 日 2013 年 01 月 21 日 2015 年 07 月 01 日 2015 年 11 月 25
核 准 日 期 :2010 年 02 月 26 日 修 改 日 期 :2010 年 04 月 10 日 2010 年 07 月 29 日 2011 年 03 月 30 日 2011 年 07 月 25 日 2011 年 09 月 20 日 2011 年 12 月 16 日 2012 年 09 月 17 日 2013 年 01 月 21 日 2015 年 07 月 01 日 2015 年 11 月 25
 巩 雪 宿 燕 岗 潘 文 志 崔 洁 潘 翠 珍 王 蔚 柏 瑾 秦 胜 梅 葛 均 波 舒 先 红 中华临床医师杂志 ( 电子版 ) 2011年 1 月第 5卷第 2期 370 Ch in J C lin icins( E lectron ic Ed ition ), Jnury 15, 2011, V o.l 5, N o. 2 12例, 有效率 61% ( 43 / 70) 术前一般情况如年龄
巩 雪 宿 燕 岗 潘 文 志 崔 洁 潘 翠 珍 王 蔚 柏 瑾 秦 胜 梅 葛 均 波 舒 先 红 中华临床医师杂志 ( 电子版 ) 2011年 1 月第 5卷第 2期 370 Ch in J C lin icins( E lectron ic Ed ition ), Jnury 15, 2011, V o.l 5, N o. 2 12例, 有效率 61% ( 43 / 70) 术前一般情况如年龄
表现 术后 进一步评价 病理 观察偶然发现 T1a ( 切缘阴性 ) T1b 或更高 观察 肝切除 可切除 + 淋巴结切除 b CT/MRI, ± 胆道切除胸部 考虑可选择 进行 吉西他滨顺铂联合化疗 ( 分类 1) 腹腔镜 5Fu 或吉西他滨为基础的化疗方案 d 不可切除 c 5-Fu 化放疗 见
 表现术中偶然发现 术中 分期 胆囊冰冻切片 考虑扩大胆囊切除术 a 术后进一步评价 CT/MRI, 胸部 CT 可切除 胆囊切除术 + 整体肝切除 + 淋巴结切除术 ± 胆道切除 可选择 : 吉西他滨 / 顺铂联合化疗 ( 分类 1) Fu 为基础或吉西他滨为基础的不可切除化疗方案 c 氟嘧啶化放疗 b d 见 : 辅助 治疗和监测 - 病理 观察偶然发现 取决于外科医师的特长和 / 或可切除性 可切除性不明,
表现术中偶然发现 术中 分期 胆囊冰冻切片 考虑扩大胆囊切除术 a 术后进一步评价 CT/MRI, 胸部 CT 可切除 胆囊切除术 + 整体肝切除 + 淋巴结切除术 ± 胆道切除 可选择 : 吉西他滨 / 顺铂联合化疗 ( 分类 1) Fu 为基础或吉西他滨为基础的不可切除化疗方案 c 氟嘧啶化放疗 b d 见 : 辅助 治疗和监测 - 病理 观察偶然发现 取决于外科医师的特长和 / 或可切除性 可切除性不明,
Microsoft Word - 阿来替尼说明书 - CNDA approval -final clean
 2018 08 12, Alecensa Alectinib Hydrochloride Capsules Yansuan Alaitini Jiaonang 9--6,6- -8-[4- -4-G -1- ]-11--6,11--5H- [b]-3- C 30 H 35 ClN 4 O 2 519.08 E172 E172FD&C 2 E132 1-150mg ALE150 mg 1 / 20 ALK
2018 08 12, Alecensa Alectinib Hydrochloride Capsules Yansuan Alaitini Jiaonang 9--6,6- -8-[4- -4-G -1- ]-11--6,11--5H- [b]-3- C 30 H 35 ClN 4 O 2 519.08 E172 E172FD&C 2 E132 1-150mg ALE150 mg 1 / 20 ALK
干细胞和再生医学 科学学位 免考 免考 非定向 干细胞和再生医学 科学学位 免考 85 非定向 干细胞和再生医学 科学学位 免考 69 非定向 护理学 科学学位 免考 免考 非定向 护理学 科学学位
 2018 年秋季报考博士上线考生名单 序号 准考证号 报考专业名称 学位类型外语成绩专业基础课成绩报考类别 备注 1 180371 病理学与病理生理学 科学学位 免考 免考 非定向 2 180393 病理学与病理生理学 科学学位 免考 免考 非定向 3 180427 病理学与病理生理学 科学学位 免考 免考 非定向 4 180436 病理学与病理生理学 科学学位 免考 免考 非定向 5 180474
2018 年秋季报考博士上线考生名单 序号 准考证号 报考专业名称 学位类型外语成绩专业基础课成绩报考类别 备注 1 180371 病理学与病理生理学 科学学位 免考 免考 非定向 2 180393 病理学与病理生理学 科学学位 免考 免考 非定向 3 180427 病理学与病理生理学 科学学位 免考 免考 非定向 4 180436 病理学与病理生理学 科学学位 免考 免考 非定向 5 180474
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 病理学与病理生理学 病理学与病理生理学
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
晚期乳腺癌抗HER2靶向治疗策略
 乳腺癌内科治疗规范 长海医院肿瘤科 王雅杰 乳腺癌 乳腺癌分子分型 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
乳腺癌内科治疗规范 长海医院肿瘤科 王雅杰 乳腺癌 乳腺癌分子分型 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
ZmaxTM
 核 准 日 期 :213 年 1 月 22 日 修 改 日 期 :213 年 12 月 9 日 ;214 年 8 月 29 日 ;214 年 9 月 18 日 ;215 年 3 月 15 日 克 唑 替 尼 胶 囊 说 明 书 请 仔 细 阅 读 说 明 书 并 在 医 师 指 导 下 使 用 药 品 名 称 通 用 名 称 : 克 唑 替 尼 胶 囊 商 品 名 称 : 赛 可 瑞 / XALKORI
核 准 日 期 :213 年 1 月 22 日 修 改 日 期 :213 年 12 月 9 日 ;214 年 8 月 29 日 ;214 年 9 月 18 日 ;215 年 3 月 15 日 克 唑 替 尼 胶 囊 说 明 书 请 仔 细 阅 读 说 明 书 并 在 医 师 指 导 下 使 用 药 品 名 称 通 用 名 称 : 克 唑 替 尼 胶 囊 商 品 名 称 : 赛 可 瑞 / XALKORI
卡培他滨片使用说明书
 核 准 日 期 :2007 年 02 月 14 日 修 改 日 期 :2007 年 03 月 23 日 2008 年 06 月 30 日 2008 年 07 月 01 日 2008 年 07 月 29 日 2010 年 02 月 12 日 2010 年 05 月 27 日 2011 年 09 月 14 日 2012 年 05 月 15 日 2012 年 08 月 24 日 2014 年 01 月 06
核 准 日 期 :2007 年 02 月 14 日 修 改 日 期 :2007 年 03 月 23 日 2008 年 06 月 30 日 2008 年 07 月 01 日 2008 年 07 月 29 日 2010 年 02 月 12 日 2010 年 05 月 27 日 2011 年 09 月 14 日 2012 年 05 月 15 日 2012 年 08 月 24 日 2014 年 01 月 06
<4D F736F F F696E74202D20CDF5EAD8A3BABEF8BEADBAF3C8E9CFD9B0A9B8A8D6FAC4DAB7D6C3DAD6CEC1C6C1D9B4B2CBBCBFBC2DB9E3B6ABCAA1C8E9CFD9B2A1BBE1D2E9A3A8B9E3D6DDA3A9>
 绝经后乳腺癌辅助内分泌治疗临床思考 王 曦 广州珠江宾馆 2010.6.18 辅助内分泌治疗的目的 治疗目的 减少死亡 避免复发 避免因复发而导致的生活质量恶化 Chlebowski R, et al. Breast 2009; S*:S1-S11. 他莫昔芬做到了! 60 50 复发 40 率 (%) 30 20 10 0 15 年的收益为 11.8% (SE 1.3) Logrank 2p
绝经后乳腺癌辅助内分泌治疗临床思考 王 曦 广州珠江宾馆 2010.6.18 辅助内分泌治疗的目的 治疗目的 减少死亡 避免复发 避免因复发而导致的生活质量恶化 Chlebowski R, et al. Breast 2009; S*:S1-S11. 他莫昔芬做到了! 60 50 复发 40 率 (%) 30 20 10 0 15 年的收益为 11.8% (SE 1.3) Logrank 2p
Microsoft Word - Gazyva_CDS 5.0_USPI 1602_0716-GAZ-01_Clean
 0716-GAZ-01 GAZYVA Solution for Infusion obinutuzumab 000973 B (Progressive Multifocal Leukoencephalopathy; PML) B (HBV) CD20 (CD20-directed cytolytic antibodies)( GAZYVA) GAZYVA HBV GAZYVA HBV HBV GAZYVA
0716-GAZ-01 GAZYVA Solution for Infusion obinutuzumab 000973 B (Progressive Multifocal Leukoencephalopathy; PML) B (HBV) CD20 (CD20-directed cytolytic antibodies)( GAZYVA) GAZYVA HBV GAZYVA HBV HBV GAZYVA
[Table_Main]
![[Table_Main] [Table_Main]](/thumbs/91/105546610.jpg) [Table_Industry] 生物制品 分析师江琦电话 :021-20315150 邮箱 :jiangqi@r.qlzq.com.cn S0740517010002 证券研究报告 / 行业报告简版 2017 年 12 月 21 日聊聊全球销售 68 亿美元的乳腺癌 金标准 曲妥珠单抗 - 乳腺癌一线疗法地位稳固, 国内市场可达 87 亿元联系人赵磊邮箱 :zhaolei@r.qlzq.com.cn
[Table_Industry] 生物制品 分析师江琦电话 :021-20315150 邮箱 :jiangqi@r.qlzq.com.cn S0740517010002 证券研究报告 / 行业报告简版 2017 年 12 月 21 日聊聊全球销售 68 亿美元的乳腺癌 金标准 曲妥珠单抗 - 乳腺癌一线疗法地位稳固, 国内市场可达 87 亿元联系人赵磊邮箱 :zhaolei@r.qlzq.com.cn
File
 8-*+* P(M-3: (A 3-/* C&&= CC L ; = $%&& ( *+,-.*- / 0 1.*.% (1 223456 223476 89234:6 *+ 892345 ;$%*&,*$. (=* $%& (&* +, ( -%.* / 0, 1%&* 23& / (.* /& (& 43. >;/8>,8 ;>,@ABCD B;G,89 5678,99% :;=, ;,>,,
8-*+* P(M-3: (A 3-/* C&&= CC L ; = $%&& ( *+,-.*- / 0 1.*.% (1 223456 223476 89234:6 *+ 892345 ;$%*&,*$. (=* $%& (&* +, ( -%.* / 0, 1%&* 23& / (.* /& (& 43. >;/8>,8 ;>,@ABCD B;G,89 5678,99% :;=, ;,>,,
 高 云 钟良军 张源明 周晓欢 梁 平 徐 隽 探讨兔牙周炎对动脉粥样硬化炎性因子的影响及抗生素对其的作用 将 只雄性新西兰大白兔随机分为 组 组为对照组 组为牙周炎组 组为动脉粥样硬化组 组为牙周炎 动脉粥样硬化组 组为干预组 牙周炎 动脉粥样硬化 替硝唑组 各组分别按照实验设计进行相应干预处理 周末处死动物 检测牙周指标 血清中总胆固醇 三酰甘油 高密度脂蛋白胆固醇 低密度脂蛋白胆固醇 反应蛋白
高 云 钟良军 张源明 周晓欢 梁 平 徐 隽 探讨兔牙周炎对动脉粥样硬化炎性因子的影响及抗生素对其的作用 将 只雄性新西兰大白兔随机分为 组 组为对照组 组为牙周炎组 组为动脉粥样硬化组 组为牙周炎 动脉粥样硬化组 组为干预组 牙周炎 动脉粥样硬化 替硝唑组 各组分别按照实验设计进行相应干预处理 周末处死动物 检测牙周指标 血清中总胆固醇 三酰甘油 高密度脂蛋白胆固醇 低密度脂蛋白胆固醇 反应蛋白
耳鼻咽喉科医师 是 耳鼻咽喉科医师 耳鼻咽喉科医师 是 耳鼻咽喉科医师 是 耳鼻咽喉科医师 耳鼻咽喉科医师 耳鼻
 2018 年青岛市西海岸医院 ( 青岛大学附属医院西海岸院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科技师 1 180360008 65.4 是 病理科技师 2 180704001 45.2 病理科技师 2 180706010 45.3 病理科技师 2 180707012 0 病理科技师 2 180711006 47.1 病理科技师 2 180716009
2018 年青岛市西海岸医院 ( 青岛大学附属医院西海岸院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科技师 1 180360008 65.4 是 病理科技师 2 180704001 45.2 病理科技师 2 180706010 45.3 病理科技师 2 180707012 0 病理科技师 2 180711006 47.1 病理科技师 2 180716009
乳腺癌的化疗
 乳腺癌化学治疗规范 胡夕春 概要 化疗结论 先治疗有效性, 后复发危险 提高疗效 历史 1972 年美国 NSABP 用左旋溶肉瘤素 1973 年意大利国立癌症研究所用 CMF 方案 EBCTCG 荟萃分析 2005-06 乳腺癌死亡率 紫杉类 > 蒽环类 > CMF > 无化疗 50 10 年获益 4.3% (SE 1.0) Lorank 2p < 0.00001 10 年获益 4.3% (SE
乳腺癌化学治疗规范 胡夕春 概要 化疗结论 先治疗有效性, 后复发危险 提高疗效 历史 1972 年美国 NSABP 用左旋溶肉瘤素 1973 年意大利国立癌症研究所用 CMF 方案 EBCTCG 荟萃分析 2005-06 乳腺癌死亡率 紫杉类 > 蒽环类 > CMF > 无化疗 50 10 年获益 4.3% (SE 1.0) Lorank 2p < 0.00001 10 年获益 4.3% (SE
PowerPoint Presentation
 头颈部鳞癌的化疗规范与进展 复旦大学附属肿瘤医院 肿瘤内科郭晔 2012-10-11 上海 内容 概述 预测及预后因素 一线化疗 解救化疗 靶向治疗 -抗 EGFR 单克隆抗体-小分子酪氨酸激酶抑制剂 (TKI) -抗血管生成单克隆抗体 小结 概述 在所有 HNSCC 患者中, 局部晚期占 2/3, 其中超过半数的患者会出现局部复发 / 远处转移 5-10% 的患者就诊时已经出现远处转移 除了少部分患者能够接受二次根治性局部治疗,
头颈部鳞癌的化疗规范与进展 复旦大学附属肿瘤医院 肿瘤内科郭晔 2012-10-11 上海 内容 概述 预测及预后因素 一线化疗 解救化疗 靶向治疗 -抗 EGFR 单克隆抗体-小分子酪氨酸激酶抑制剂 (TKI) -抗血管生成单克隆抗体 小结 概述 在所有 HNSCC 患者中, 局部晚期占 2/3, 其中超过半数的患者会出现局部复发 / 远处转移 5-10% 的患者就诊时已经出现远处转移 除了少部分患者能够接受二次根治性局部治疗,
材料 方法
 生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
144 ) 985 Da ( 80 RA DMARDs MTX DMARDs sjia NSAIDs 2 2 sjia 80mg/4ml 200mg/10ml 400mg/20ml RA 8mg/kg 4 1 MTX DMARDs 4mg/kg 0.9% 100ml 1 100kg 800mg sj
 2013 03 26 2014 06 03 2015 11 25 2016 10 25 2017 09 25 ACTEMRA Tocilizumab Injection Tuozhudankang Zhusheye 6IL-6 CHO DNA C 6428H 9976 N 1720 O 2018 S 42 () 1 144 ) 985 Da ( 80 RA DMARDs MTX DMARDs sjia
2013 03 26 2014 06 03 2015 11 25 2016 10 25 2017 09 25 ACTEMRA Tocilizumab Injection Tuozhudankang Zhusheye 6IL-6 CHO DNA C 6428H 9976 N 1720 O 2018 S 42 () 1 144 ) 985 Da ( 80 RA DMARDs MTX DMARDs sjia
!"#$%%'% 瘤血管的生成达到间接杀灭肿瘤细胞的目的 所以 目前关于贝伐单抗的研究多是将其与化疗联合 目前 贝伐单抗主要应用于 阴性的乳腺癌患者 尤其是三阴性乳腺癌 因其缺乏特异性靶点 分子表达水平无规律可循 治疗原则多是联合化学治疗的 综合疗法 但总体预后令人担忧 是一项 期 开放的实验研究
 分子靶向药物在乳腺癌中研究进展 李鸿涛 罗 琳 马斌林 新疆医科大学附属肿瘤医院 新疆乌鲁木齐 摘要 分子靶向药物治疗是乳腺癌重要的治疗手段 研究表明 在 阳性乳腺癌患者中 使用靶向药物曲妥珠单抗能明显改善预后 无病生存期可提高 手术 放化疗与靶向治疗的联合应用 具有治疗靶点明确 临床获益确切 副反应少等优点 寻找多靶点共同抑制乳腺癌侵袭与转移是未来研究的重要方向 主题词 靶向药物 乳腺肿瘤 研究进展中图分类号
分子靶向药物在乳腺癌中研究进展 李鸿涛 罗 琳 马斌林 新疆医科大学附属肿瘤医院 新疆乌鲁木齐 摘要 分子靶向药物治疗是乳腺癌重要的治疗手段 研究表明 在 阳性乳腺癌患者中 使用靶向药物曲妥珠单抗能明显改善预后 无病生存期可提高 手术 放化疗与靶向治疗的联合应用 具有治疗靶点明确 临床获益确切 副反应少等优点 寻找多靶点共同抑制乳腺癌侵袭与转移是未来研究的重要方向 主题词 靶向药物 乳腺肿瘤 研究进展中图分类号
神经功能检查医师 是 神经功能检查医师 神经功能检查医师 神经功能检查医师 神经功能检查医师 是 神经功能检查医师 急诊内科医师 1
 2017 年青岛市西海岸医院 ( 青岛大学附属医院黄岛院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科医师 1 170907006 57.5 是 体检中心超声医师 170901013 43.7 体检中心超声医师 170906005 59.7 是 体检中心超声医师 170907015 60 是 体检中心超声医师 170907019 45.2 体检中心超声医师
2017 年青岛市西海岸医院 ( 青岛大学附属医院黄岛院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科医师 1 170907006 57.5 是 体检中心超声医师 170901013 43.7 体检中心超声医师 170906005 59.7 是 体检中心超声医师 170907015 60 是 体检中心超声医师 170907019 45.2 体检中心超声医师
 生命科学研究 房 蓓 武泰存 王景安 以玉米沈单 号为材料 用溶液培养的方法研究了缺锌 低锌和正常供锌对玉米生长发育的影响 进一步明确了一定量低锌比缺锌对玉米的伤害更大 并对其 同工酶谱及蛋白质表达进行了分析 结果表明 一定浓度的低锌培养使玉米生长受抑及受害最重 且地上部分比地下部分更敏感 低锌和缺锌处理时 种同工酶的酶谱和蛋白表达与正常供锌时均有明显的差异 尤其在一定量低锌浓度时 有些同工酶的表达增强或被特异性诱导
生命科学研究 房 蓓 武泰存 王景安 以玉米沈单 号为材料 用溶液培养的方法研究了缺锌 低锌和正常供锌对玉米生长发育的影响 进一步明确了一定量低锌比缺锌对玉米的伤害更大 并对其 同工酶谱及蛋白质表达进行了分析 结果表明 一定浓度的低锌培养使玉米生长受抑及受害最重 且地上部分比地下部分更敏感 低锌和缺锌处理时 种同工酶的酶谱和蛋白表达与正常供锌时均有明显的差异 尤其在一定量低锌浓度时 有些同工酶的表达增强或被特异性诱导
Microsoft Word - Herceptin IV all_0915-HER-01_CDS 12.0_clean_solvent site of SSF
 0915-HER-01 150 Herceptin Trastuzumab 440 440 Vial 150 mg Vial 440 mg Herceptin Herceptinanthracycline Herceptin Herceptin Herceptin Herceptin Herceptin 24 Herceptin Herceptin 1 Herceptin HER2 HER2
0915-HER-01 150 Herceptin Trastuzumab 440 440 Vial 150 mg Vial 440 mg Herceptin Herceptinanthracycline Herceptin Herceptin Herceptin Herceptin Herceptin 24 Herceptin Herceptin 1 Herceptin HER2 HER2
 遗传性原发性心律失常综合征诊断与治疗中国专家共识 作者 : 中华心血管病杂志编辑委员会心律失常循证工作组 作者单位 : 刊名 : 中华心血管病杂志 英文刊名 : Chinese Journal of Cardiology 年, 卷 ( 期 ): 2015,43(1) 引用本文格式 : 中华心血管病杂志编辑委员会心律失常循证工作组遗传性原发性心律失常综合征诊断与治疗中国专家共识 [ 期刊论 文 ]-
遗传性原发性心律失常综合征诊断与治疗中国专家共识 作者 : 中华心血管病杂志编辑委员会心律失常循证工作组 作者单位 : 刊名 : 中华心血管病杂志 英文刊名 : Chinese Journal of Cardiology 年, 卷 ( 期 ): 2015,43(1) 引用本文格式 : 中华心血管病杂志编辑委员会心律失常循证工作组遗传性原发性心律失常综合征诊断与治疗中国专家共识 [ 期刊论 文 ]-
 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
WHO/NMH/NVI/ WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland book
 概要 道路安全全球现状报告 2015 WHO/NMH/NVI/15.6 2015 www.who.int WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland+41 22 791 3264+41 22 791 4857bookorders@who.int http://www.who.int/about/licensing/
概要 道路安全全球现状报告 2015 WHO/NMH/NVI/15.6 2015 www.who.int WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland+41 22 791 3264+41 22 791 4857bookorders@who.int http://www.who.int/about/licensing/
期 焦 婉 肖菊香 锁爱莉 等 贝伐珠单抗联合化疗治疗晚期结直肠癌的疗效观察 ""# " -$" 1$ &&""# #"" ( #&2( #& ( #&" " #& ##"" "& 3# #"#( #""( #####& )(#")-$"0*+"#( " ##"#(##& ()* + # -1-1-
 第 卷第 期 年 月 西安交通大学学报 医学版!"#$## %&'& & 临床研究 贝伐珠单抗联合化疗治疗晚期结直肠癌的疗效观察 焦 婉 肖菊香 锁爱莉 赵晓艾 朱 娇 西安交通大学医学部 陕西西安 西安交通大学第一附属医院肿瘤内科 陕西西安 摘要 目的 观察贝伐珠单抗联合化疗治疗晚期结直肠癌的近期疗效 安全性及远期生存期 方法 回顾性分析 # 年 月 年 月应用贝伐珠单抗联合以奥沙利铂 伊立替康
第 卷第 期 年 月 西安交通大学学报 医学版!"#$## %&'& & 临床研究 贝伐珠单抗联合化疗治疗晚期结直肠癌的疗效观察 焦 婉 肖菊香 锁爱莉 赵晓艾 朱 娇 西安交通大学医学部 陕西西安 西安交通大学第一附属医院肿瘤内科 陕西西安 摘要 目的 观察贝伐珠单抗联合化疗治疗晚期结直肠癌的近期疗效 安全性及远期生存期 方法 回顾性分析 # 年 月 年 月应用贝伐珠单抗联合以奥沙利铂 伊立替康
材料 方法
 生物技术通报 张发洲 杨慧兰 为了构建单纯疱疹病毒 型 感染细胞多肽 真核表达质粒 应用 技术从 株 的基因组中扩增 基因 并连接至真核表达载体 对阳性克隆进行菌落 酶切和测序鉴定后 成功构建了重 组质粒 用 转染试剂盒将重组质粒 转染至 细胞中 并用 及 检测其表达情况 结果显示 基因在 细胞中得到正确表达 真核表达质粒 的构建成功 为进 一步研究 对宿主细胞的影响奠定了基础 单纯疱疹病毒 型 感染细胞多肽
生物技术通报 张发洲 杨慧兰 为了构建单纯疱疹病毒 型 感染细胞多肽 真核表达质粒 应用 技术从 株 的基因组中扩增 基因 并连接至真核表达载体 对阳性克隆进行菌落 酶切和测序鉴定后 成功构建了重 组质粒 用 转染试剂盒将重组质粒 转染至 细胞中 并用 及 检测其表达情况 结果显示 基因在 细胞中得到正确表达 真核表达质粒 的构建成功 为进 一步研究 对宿主细胞的影响奠定了基础 单纯疱疹病毒 型 感染细胞多肽
期 沈 玲 罗 波 晚期胃癌二线使用 %&' 和 &()*) 方案化疗的疗效及安全性评价 && "()#,"#"### -./# ""#& *+, "#"### /)0/11()#"# ## 胃癌是世界上发病率最高的恶性肿瘤之一 由于胃癌早期症状不明显 大部分胃癌患者确诊时已经发 + 展为晚期 化疗
 第 卷第 期 年 月 西安交通大学学报 医学版!"#$## %&'& & 临床研究 晚期胃癌二线使用 和 方案化疗的疗效及安全性评价 沈 玲 罗 波 南阳医学高等专科学校第一附属医院肿瘤内科 河南南阳 西南医科大学中西医结合学院 四川泸州 $$ 摘要 目的 探讨二线使用 %&' 表阿霉素 奥沙利铂 卡培他滨 治疗晚期胃癌的疗效及安全性 方法 收集 年 月 日至 年 $ 月 日我院收治的 例 方案化疗失败后的晚期胃癌患者
第 卷第 期 年 月 西安交通大学学报 医学版!"#$## %&'& & 临床研究 晚期胃癌二线使用 和 方案化疗的疗效及安全性评价 沈 玲 罗 波 南阳医学高等专科学校第一附属医院肿瘤内科 河南南阳 西南医科大学中西医结合学院 四川泸州 $$ 摘要 目的 探讨二线使用 %&' 表阿霉素 奥沙利铂 卡培他滨 治疗晚期胃癌的疗效及安全性 方法 收集 年 月 日至 年 $ 月 日我院收治的 例 方案化疗失败后的晚期胃癌患者
灵芝与肿瘤
 灵芝 与 肿瘤 Ganoderma lucidum and tumor 现代药理研究汇编 定位灵芝在肿瘤应用中的作用和价值 药理研究 学者观点 病例亲述 灵芝的现代药理研究已有40多年历史 肿瘤应用是 前言 其研究重点 大众对灵芝抗肿瘤虽有一定认知 然而 这种认知仍较模糊甚至是误解 本资料在学术研究基 础上 以尽可能通俗的语言 使大众了解灵芝研究状 况并正确定位灵芝在肿瘤治疗中的三个层级 目录 第一部分
灵芝 与 肿瘤 Ganoderma lucidum and tumor 现代药理研究汇编 定位灵芝在肿瘤应用中的作用和价值 药理研究 学者观点 病例亲述 灵芝的现代药理研究已有40多年历史 肿瘤应用是 前言 其研究重点 大众对灵芝抗肿瘤虽有一定认知 然而 这种认知仍较模糊甚至是误解 本资料在学术研究基 础上 以尽可能通俗的语言 使大众了解灵芝研究状 况并正确定位灵芝在肿瘤治疗中的三个层级 目录 第一部分
 穆迎春 王 芳 董双林 董少帅 朱长波 研究了盐度波动幅度对中国明对虾稚虾 蜕皮和生长的影响 实验 在水族箱内进行 实验对虾的初始体重为 投喂人工配合饲料 实验结果表 明 不同盐度波动幅度对中国明对虾稚虾的蜕皮周期有显著的影响 其中 能明 显抑制对虾的蜕皮 则能促进对虾的蜕皮 前者较后者蜕皮周期延长 不同盐度波动幅度对中国明对虾的特定生长率有显著影响 其中 和 两组对虾的特定生长率最 大 分别大于
穆迎春 王 芳 董双林 董少帅 朱长波 研究了盐度波动幅度对中国明对虾稚虾 蜕皮和生长的影响 实验 在水族箱内进行 实验对虾的初始体重为 投喂人工配合饲料 实验结果表 明 不同盐度波动幅度对中国明对虾稚虾的蜕皮周期有显著的影响 其中 能明 显抑制对虾的蜕皮 则能促进对虾的蜕皮 前者较后者蜕皮周期延长 不同盐度波动幅度对中国明对虾的特定生长率有显著影响 其中 和 两组对虾的特定生长率最 大 分别大于
SUTENT
 乳腺癌内科治疗规范 上海长海医院肿瘤科 王雅杰 2012-10-20 沈阳 乳腺癌 乳腺癌内科治疗 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
乳腺癌内科治疗规范 上海长海医院肿瘤科 王雅杰 2012-10-20 沈阳 乳腺癌 乳腺癌内科治疗 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
 : 2 A B C D E ( ) 1 2 3 4 5 6 140 Hg / 90 Hg 50% 1/3 2-3 3-5 10 7.0mmol/L 2 11.1mmol/L 5.72mmol/L 1.70mmol/L (BMI) = (cm) 105 = (kg) / (m) 2 10%
: 2 A B C D E ( ) 1 2 3 4 5 6 140 Hg / 90 Hg 50% 1/3 2-3 3-5 10 7.0mmol/L 2 11.1mmol/L 5.72mmol/L 1.70mmol/L (BMI) = (cm) 105 = (kg) / (m) 2 10%
< CBB6CABFC2BCC8A1C7E9BFF6202D20B8B1B1BE2E786C73>
 001 基础医学院 071003 生理学 8 276 325 301.9 001 基础医学院 071005 微生物学 5 282 364 321.2 001 基础医学院 071006 神经生物学 2 308 310 309.0 001 基础医学院 071007 遗传学 5 293 336 312.6 001 基础医学院 071009 细胞生物学 4 294 369 323.0 001 基础医学院 071010
001 基础医学院 071003 生理学 8 276 325 301.9 001 基础医学院 071005 微生物学 5 282 364 321.2 001 基础医学院 071006 神经生物学 2 308 310 309.0 001 基础医学院 071007 遗传学 5 293 336 312.6 001 基础医学院 071009 细胞生物学 4 294 369 323.0 001 基础医学院 071010
+
 ~ 1 ~ ~ 2 ~ 1-1 UHPLC-SEC 法对治疗性抗体的分析 TSKgel UP-SW3 UHPLC HPLC A TSKgel UP-SW3 2 μm (4.6 mm ID. 15 cm B UHPLC-SEC 1.7 μm (4.6 mm ID. 15 cm mmol/l (ph 6.7 + 2SO4 mmol/l Na +.5 % NaN3.35 ml/ 25 UV 28 nm 5
~ 1 ~ ~ 2 ~ 1-1 UHPLC-SEC 法对治疗性抗体的分析 TSKgel UP-SW3 UHPLC HPLC A TSKgel UP-SW3 2 μm (4.6 mm ID. 15 cm B UHPLC-SEC 1.7 μm (4.6 mm ID. 15 cm mmol/l (ph 6.7 + 2SO4 mmol/l Na +.5 % NaN3.35 ml/ 25 UV 28 nm 5
食 品 与 生 物 技 术 学 报 第 卷 列入我国 的植物多酚黄酮抗氧剂 防治高血脂和心血管疾病
 第 卷第 期 年 月 食品与生物技术学报 植物多酚黄酮抗氧化剂与人体健康 尤新 中国食品添加剂和配料生产应用工业协会 北京 主要综述了对植物多酚黄酮类物质的生物活性和安全性 其内容包括 茶多酚 甘草黄酮 竹叶黄酮 大豆异黄酮以及从各种鲜果提取物的功能成分 如葡萄提取物 杨梅提取物 橄榄提取 物 乌饭树果提取物等 介绍了植物多酚黄酮的国际市场信息及相关的研究机构和生产单位 多酚 黄酮 健康 食 品 与
第 卷第 期 年 月 食品与生物技术学报 植物多酚黄酮抗氧化剂与人体健康 尤新 中国食品添加剂和配料生产应用工业协会 北京 主要综述了对植物多酚黄酮类物质的生物活性和安全性 其内容包括 茶多酚 甘草黄酮 竹叶黄酮 大豆异黄酮以及从各种鲜果提取物的功能成分 如葡萄提取物 杨梅提取物 橄榄提取 物 乌饭树果提取物等 介绍了植物多酚黄酮的国际市场信息及相关的研究机构和生产单位 多酚 黄酮 健康 食 品 与
Current Role of Taxol in Breast Cancer
 遵循指南合理处方 规范用药全程管理 307 医院乳腺肿瘤科江泽飞 中国临床肿瘤学会 (CSCO) 常委 副秘书长中国抗癌协会乳腺癌专业委员会副主任委员中国抗癌协会肿瘤化疗专业委员会副主任委员中国乳腺癌诊疗指南 (cnccn) 执笔人 St.Gallen 国际乳腺癌专家共识主席团成员军事医学科学院 307 医院乳腺肿瘤科主任 江泽飞 主任医师博士生导师 门诊时间 : 每周一上午 周二下午北京市丰台区东大街
遵循指南合理处方 规范用药全程管理 307 医院乳腺肿瘤科江泽飞 中国临床肿瘤学会 (CSCO) 常委 副秘书长中国抗癌协会乳腺癌专业委员会副主任委员中国抗癌协会肿瘤化疗专业委员会副主任委员中国乳腺癌诊疗指南 (cnccn) 执笔人 St.Gallen 国际乳腺癌专家共识主席团成员军事医学科学院 307 医院乳腺肿瘤科主任 江泽飞 主任医师博士生导师 门诊时间 : 每周一上午 周二下午北京市丰台区东大街
前言 乳腺癌是女性最常见的恶性肿瘤, 近年来发病率逐年上升 全世界每年约有 0 万妇女患乳腺癌, 有 0 万妇女死于乳腺癌 在我国发达城市, 乳腺癌的发病率已在女性恶性肿瘤中占据第一位, 例如在上海, 乳腺癌的发病率已达到了 0/0 万 乳腺癌的治疗已摆脱原先单一的手术治疗模式, 取而代之的是集手术
 前言 乳腺癌是女性最常见的恶性肿瘤, 近年来发病率逐年上升 全世界每年约有 0 万妇女患乳腺癌, 有 0 万妇女死于乳腺癌 在我国发达城市, 乳腺癌的发病率已在女性恶性肿瘤中占据第一位, 例如在上海, 乳腺癌的发病率已达到了 0/0 万 乳腺癌的治疗已摆脱原先单一的手术治疗模式, 取而代之的是集手术 化疗 放疗 内分泌治疗和靶向治疗为一体的综合治疗模式 在靶向治疗中, 针对 HER- 癌基因的药物
前言 乳腺癌是女性最常见的恶性肿瘤, 近年来发病率逐年上升 全世界每年约有 0 万妇女患乳腺癌, 有 0 万妇女死于乳腺癌 在我国发达城市, 乳腺癌的发病率已在女性恶性肿瘤中占据第一位, 例如在上海, 乳腺癌的发病率已达到了 0/0 万 乳腺癌的治疗已摆脱原先单一的手术治疗模式, 取而代之的是集手术 化疗 放疗 内分泌治疗和靶向治疗为一体的综合治疗模式 在靶向治疗中, 针对 HER- 癌基因的药物
424 国际肿瘤学杂志 2017 年 6 月第 44 卷第 6 期 subtypeand10.3monthsinher 2overexpresionsubtype,withasignificantdiference(χ 2 =7.510,P= 0.006).Themostcommonadversee
 423 论著 多西他赛联合卡培他滨一线治疗转移性乳腺癌的临床疗效和不良反应 欧开萍马飞张育荣刘维丽吕剑虹周华 摘要 目的探讨多西他赛联合卡培他滨一线治疗转移性乳腺癌的临床疗效及不良反应, 并分析其在转移性乳腺癌不同分子分型中的疗效 方法回顾性分析北京市朝阳区三环肿瘤医院 2012 年 1 月 1 日至 2015 年 12 月 31 日多西他赛联合卡培他滨一线治疗转移性乳腺癌患者 108 例, 可评价病例
423 论著 多西他赛联合卡培他滨一线治疗转移性乳腺癌的临床疗效和不良反应 欧开萍马飞张育荣刘维丽吕剑虹周华 摘要 目的探讨多西他赛联合卡培他滨一线治疗转移性乳腺癌的临床疗效及不良反应, 并分析其在转移性乳腺癌不同分子分型中的疗效 方法回顾性分析北京市朝阳区三环肿瘤医院 2012 年 1 月 1 日至 2015 年 12 月 31 日多西他赛联合卡培他滨一线治疗转移性乳腺癌患者 108 例, 可评价病例
ペムブロリズマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(尿路上皮癌)の作成及び最適使用推進ガイドライン(非小細胞肺癌、悪性黒色腫、古典的ホジキンリンパ腫)の一部改正について(2)
 -1 24 CT -2-3 1 infusion reaction 11 5 ECOG Performance Status 3-4 1 EGFRALK PD-L1 TPS50% PD-L1TPS1% EGFR ALK EGFR ALK TPS PD-L1 IHC 22C3 pharmdx 1 ECOG Performance StatusPS Score 0 1 2 50% 3 50% 4 12
-1 24 CT -2-3 1 infusion reaction 11 5 ECOG Performance Status 3-4 1 EGFRALK PD-L1 TPS50% PD-L1TPS1% EGFR ALK EGFR ALK TPS PD-L1 IHC 22C3 pharmdx 1 ECOG Performance StatusPS Score 0 1 2 50% 3 50% 4 12
²3871² advantage of improving the clinical treatment and reducing associated toxicity due to adverse reactions caused by chemotherapy for patients wit
 ²3870² ² 临床论著 ² 吡柔比星和环磷酰胺联合多西他赛在乳腺癌新辅助化疗中应用效果 阙劲松 摘要 目的探讨吡柔比星和环磷酰胺联合多西他赛在乳腺癌新辅助化疗中的临床应用价值 方法选取 2012 年 6 月至 2014 年 6 月期间我院所收治的 100 例乳腺癌患者作为临床研究对象, 采用区组化随机分组法将入选研究对象随机分为研究组 50 例和对照组 50 例 研究组乳腺癌患者采用吡柔比星 环磷酰胺
²3870² ² 临床论著 ² 吡柔比星和环磷酰胺联合多西他赛在乳腺癌新辅助化疗中应用效果 阙劲松 摘要 目的探讨吡柔比星和环磷酰胺联合多西他赛在乳腺癌新辅助化疗中的临床应用价值 方法选取 2012 年 6 月至 2014 年 6 月期间我院所收治的 100 例乳腺癌患者作为临床研究对象, 采用区组化随机分组法将入选研究对象随机分为研究组 50 例和对照组 50 例 研究组乳腺癌患者采用吡柔比星 环磷酰胺
乳腺癌内科治疗策略
 乳腺癌内科治疗策略 上海长海医院肿瘤科 王雅杰 乳腺癌内科治疗 乳腺癌 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
乳腺癌内科治疗策略 上海长海医院肿瘤科 王雅杰 乳腺癌内科治疗 乳腺癌 ER/PR+ 65-75% HER2+ 15-20% Luminal A ER+ PR>20% Her2- Ki67
附属八一医院 中西医结合临床 04 普通外科疾病中西医临床研究 按专业录取 第一临床医学院 中医内科学 07 内分泌疾病临床研究 按专业录取 第一临床医学院 中医妇科学 01
 2014 级七年制选择 5+3 培养模式转段结果 学号 拟录取单位 拟录取专业 研究方向 备注 032014101 002 第一临床医学院 105701 中医内科学 06 肾脏病临床研究 按专业录取 032014102 024 附属八一医院 105709 中西医结合临床 02 肿瘤内科诊治临床研究 按专业录取 032014103 002 第一临床医学院 105709 中西医结合临床 02 心血管疾病中西医临床研究
2014 级七年制选择 5+3 培养模式转段结果 学号 拟录取单位 拟录取专业 研究方向 备注 032014101 002 第一临床医学院 105701 中医内科学 06 肾脏病临床研究 按专业录取 032014102 024 附属八一医院 105709 中西医结合临床 02 肿瘤内科诊治临床研究 按专业录取 032014103 002 第一临床医学院 105709 中西医结合临床 02 心血管疾病中西医临床研究
第 期 等 乙腈 碳酸氢钠溶液混合物电嫁接叔丁氧羟基 乙二胺 7B7! " # $% # &'#! "% #!! #& (& )&# &#&# #*$% + %!, # $% "( ( # ( # "! #-.& #% & (& %" & %& & #& (& & )&# &#& # & "%&/
 第 (, 卷第 ( 期 ( 1 年 月 )0 2032 =F 0=< D@ 6 G H7!.2(,222 7.2( $&.22( 1,./.,( EI.! "&7. B ( 2 '>20.2*' & &.201 21 -(5>2, 22222222222222222222222 # /, B, 1 -( 15 (, 2 2222222222222222222222222222222 >EE! "&7..:.!
第 (, 卷第 ( 期 ( 1 年 月 )0 2032 =F 0=< D@ 6 G H7!.2(,222 7.2( $&.22( 1,./.,( EI.! "&7. B ( 2 '>20.2*' & &.201 21 -(5>2, 22222222222222222222222 # /, B, 1 -( 15 (, 2 2222222222222222222222222222222 >EE! "&7..:.!
中 草 药
 中 草 药 致 谢 李 沛 赵 继 敏 郑 智 敏 江 亚 楠 等 病 理 生 理 学 教 研 室 老 师 在 实 验 中 给 予 的 指 导 和 帮 助 狄 建 彬 顾 振 纶 赵 笑 东 钱 培 刚 蒋 小 岗 郭 次 仪 中 草 药 中草药 Chinese Traditional and Herbal Drugs 第 41 卷第 8 期 10 年 8 月 1324 LDL C 非常明显升高 (
中 草 药 致 谢 李 沛 赵 继 敏 郑 智 敏 江 亚 楠 等 病 理 生 理 学 教 研 室 老 师 在 实 验 中 给 予 的 指 导 和 帮 助 狄 建 彬 顾 振 纶 赵 笑 东 钱 培 刚 蒋 小 岗 郭 次 仪 中 草 药 中草药 Chinese Traditional and Herbal Drugs 第 41 卷第 8 期 10 年 8 月 1324 LDL C 非常明显升高 (
黑嘴子公示版本.doc
 大 连 市 环 境 保 护 有 限 公 司 -I- 大 连 市 环 境 保 护 有 限 公 司 -II- 西 岗 区 黑 嘴 子 码 头 及 周 边 地 块 改 造 项 目 环 境 影 响 报 告 书 大 连 市 环 境 保 护 有 限 公 司 -III- 大 连 市 环 境 保 护 有 限 公 司 -IV- 西 岗 区 黑 嘴 子 码 头 及 周 边 地 块 改 造 项 目 环 境 影 响 报 告
大 连 市 环 境 保 护 有 限 公 司 -I- 大 连 市 环 境 保 护 有 限 公 司 -II- 西 岗 区 黑 嘴 子 码 头 及 周 边 地 块 改 造 项 目 环 境 影 响 报 告 书 大 连 市 环 境 保 护 有 限 公 司 -III- 大 连 市 环 境 保 护 有 限 公 司 -IV- 西 岗 区 黑 嘴 子 码 头 及 周 边 地 块 改 造 项 目 环 境 影 响 报 告
国环评证甲字第2606号
 i 目 录 前 言... - 1-1 总 则... - 4-1.1 项 目 由 来... - 4-1.2 编 制 依 据... - 5-1.3 环 境 影 响 因 素 识 别 及 评 价 因 子 筛 选... - 7-1.4 环 境 功 能 区 划 及 评 价 标 准... - 9-1.5 评 价 目 的... - 14-1.6 评 价 重 点 与 评 价 工 作 等 级 和 范 围... - 14-1.7
i 目 录 前 言... - 1-1 总 则... - 4-1.1 项 目 由 来... - 4-1.2 编 制 依 据... - 5-1.3 环 境 影 响 因 素 识 别 及 评 价 因 子 筛 选... - 7-1.4 环 境 功 能 区 划 及 评 价 标 准... - 9-1.5 评 价 目 的... - 14-1.6 评 价 重 点 与 评 价 工 作 等 级 和 范 围... - 14-1.7
失眠防治(四).doc
 ( 20 010010) 787 1092 1/32 498.50 4 980 2004 9 1 2004 9 1 1 1 000 ISBN 7-204-05940-9/R 019 1880.00 ( 20.00 ) ...1...3...4...5...8... 11...12...14...15...16...18...20...21...25...27...29...30...32 I ...32...33...36...37...38...41...44...46...49...54...55...58...60...65...66...69...70...73...84...85...88
( 20 010010) 787 1092 1/32 498.50 4 980 2004 9 1 2004 9 1 1 1 000 ISBN 7-204-05940-9/R 019 1880.00 ( 20.00 ) ...1...3...4...5...8... 11...12...14...15...16...18...20...21...25...27...29...30...32 I ...32...33...36...37...38...41...44...46...49...54...55...58...60...65...66...69...70...73...84...85...88
第 期 黄雪莲等 响应面优化绿色木霉菌培养基 材料与方法 菌种 仪器与试剂 菌种的活化 单因素试验 响应面优化试验 优化工艺的验证 数据处理 结果与分析
 第 卷第 期 年 月 食品与生物技术学报 响应面优化绿色木霉菌培养基 黄雪莲 于新 仲恺农业工程学院轻工食品学院 广东广州 利用响应面分析法对绿色木霉菌的培养基进行优化 通过测量不同营养条件下绿色木霉 菌落生长直径研究其生物学特性 在单因素实验的基础上 选定葡萄糖添加量 丙氨酸添加量和磷酸二氢钾添加量 个因素进行中心组合实验 建立二次回归方程 并应用响应面分析法进行优化 结果表明 绿色木霉菌最佳培养基为葡萄糖
第 卷第 期 年 月 食品与生物技术学报 响应面优化绿色木霉菌培养基 黄雪莲 于新 仲恺农业工程学院轻工食品学院 广东广州 利用响应面分析法对绿色木霉菌的培养基进行优化 通过测量不同营养条件下绿色木霉 菌落生长直径研究其生物学特性 在单因素实验的基础上 选定葡萄糖添加量 丙氨酸添加量和磷酸二氢钾添加量 个因素进行中心组合实验 建立二次回归方程 并应用响应面分析法进行优化 结果表明 绿色木霉菌最佳培养基为葡萄糖
福建农业学报 材料与方法 试验菌株 引物 主要仪器 主要试剂 细菌培养 模板的制备 反应条件 扩增产物的检测 特异性试验 敏感性试验 分离菌株检测 产物的克隆及序列测定 结果与分析
特点和作用
 2006 10 2007 02 2010 08 2010 11 2015 02 2015 05 2017 03 Valganciclovir Hydrochloride Tablets Yan Suan Xie Geng Xi Luo Wei Pian 1.L-,- 2[(2-- 1,6- -6-- 9H-- 9-) ]-3-- 2.9-[[2--1- ] ] L- O H H 2 N N N N
2006 10 2007 02 2010 08 2010 11 2015 02 2015 05 2017 03 Valganciclovir Hydrochloride Tablets Yan Suan Xie Geng Xi Luo Wei Pian 1.L-,- 2[(2-- 1,6- -6-- 9H-- 9-) ]-3-- 2.9-[[2--1- ] ] L- O H H 2 N N N N
<4D F736F F F696E74202D20CEE2B9FAC3F720CDEDC6DA4E53434C43BBBCD5DFD2BBCFDFD6CEC1C6B2DFC2D42E707074>
 晚期 NSCLC 患者一线治疗策略 第三军医大学新桥医院 吴国明 一线治疗 2011.V3 NCCN 指南 - 根据组织学和 状态 腺癌 大细胞癌及组织学类型不明确的 阴性或未知的 NSCLC 的一线治疗 腺癌 大细胞癌及组织学类型未明确的 阳性的 NSCLC 患者一线治疗 鳞癌的一线治疗 * * 鳞癌患者 实际发生率不到 3.6%, 观察到的发生率 2.7% 故鳞癌患者 NCCN 指南不推荐常规做
晚期 NSCLC 患者一线治疗策略 第三军医大学新桥医院 吴国明 一线治疗 2011.V3 NCCN 指南 - 根据组织学和 状态 腺癌 大细胞癌及组织学类型不明确的 阴性或未知的 NSCLC 的一线治疗 腺癌 大细胞癌及组织学类型未明确的 阳性的 NSCLC 患者一线治疗 鳞癌的一线治疗 * * 鳞癌患者 实际发生率不到 3.6%, 观察到的发生率 2.7% 故鳞癌患者 NCCN 指南不推荐常规做
250 ZYTIGA Tablets 250 mg
 250 ZYTIGA Tablets 250 mg 026139 1 ZYTIGA CYP17 prednisone prednisolone 1 chemotherapy is not yet clinically indicated 2 docetaxel 3 2 2.1 ZYTIGA 1,000 4 250 prednisone prednisolone 5 1 ZYTIGA 1,000 4
250 ZYTIGA Tablets 250 mg 026139 1 ZYTIGA CYP17 prednisone prednisolone 1 chemotherapy is not yet clinically indicated 2 docetaxel 3 2 2.1 ZYTIGA 1,000 4 250 prednisone prednisolone 5 1 ZYTIGA 1,000 4
女性美容保健(四).doc
 ...1...4...6...8...9...10... 11...12...13...15...18...20...21...22...26...33...39...43 I II...47...52...53...59...60...63...65...68...69...71...73 1.5 ml...78...79...85...88...90...94...95...97...98...
...1...4...6...8...9...10... 11...12...13...15...18...20...21...22...26...33...39...43 I II...47...52...53...59...60...63...65...68...69...71...73 1.5 ml...78...79...85...88...90...94...95...97...98...
材料 方法
 生物技术通报 陆敏 许黎明 吴宏宇 张继恩 李国栋 黄青山 溶葡萄球菌酶 是一种能高效裂解葡萄球菌细胞壁的肽链内切酶 已有研究表明其能够有效预防和去除奶牛乳腺中葡萄球菌的感染 但该酶在牛奶中的性质研究还缺少详细的研究数据 现对重组溶葡萄球菌酶在牛奶中的一些性质进行研究 检测了加入溶葡萄球菌酶后牛奶性状的变化和重组溶葡萄球菌酶在牛奶中的酶活的稳定性以及溶葡萄球菌酶在牛奶中的抑 杀菌活性 结果显示 重组溶葡萄球菌酶未改变牛奶的外观性状
生物技术通报 陆敏 许黎明 吴宏宇 张继恩 李国栋 黄青山 溶葡萄球菌酶 是一种能高效裂解葡萄球菌细胞壁的肽链内切酶 已有研究表明其能够有效预防和去除奶牛乳腺中葡萄球菌的感染 但该酶在牛奶中的性质研究还缺少详细的研究数据 现对重组溶葡萄球菌酶在牛奶中的一些性质进行研究 检测了加入溶葡萄球菌酶后牛奶性状的变化和重组溶葡萄球菌酶在牛奶中的酶活的稳定性以及溶葡萄球菌酶在牛奶中的抑 杀菌活性 结果显示 重组溶葡萄球菌酶未改变牛奶的外观性状
总生存期和无进展生存期 然而由于其客观治疗有 7"/.6.& ) ) /-.6.& 效率低 且起初接受曲妥珠单抗治疗有效的多数患者 在用药 年内 肿瘤细胞对药物即产生明显抗药性 导致药效降低甚至无效 /-&"&/" & '/$"%%.%/ & 曲妥珠单抗获得性耐药机制 等通路激活 参与细胞周期的调控
 曲妥珠单抗获得性耐药机制及应对策略 常晋霞 李兴妍 刘文虎 # & 川北医学院基础医学院 四川南充 %#& 汉中市城固县食品药品检验检测中心 陕西汉中 ##& 川北医学院药学院 四川南充 %# 摘要 曲妥珠单抗是靶向人表皮生长因子 的单克隆抗体药物 对 表达阳性乳腺癌及胃癌治疗效果确切 然而多数患者在用药 年内出现了获得性耐药 导致其疗效降低甚至无效 研究表明 信号通路异常激活 表皮生长因子受体 (
曲妥珠单抗获得性耐药机制及应对策略 常晋霞 李兴妍 刘文虎 # & 川北医学院基础医学院 四川南充 %#& 汉中市城固县食品药品检验检测中心 陕西汉中 ##& 川北医学院药学院 四川南充 %# 摘要 曲妥珠单抗是靶向人表皮生长因子 的单克隆抗体药物 对 表达阳性乳腺癌及胃癌治疗效果确切 然而多数患者在用药 年内出现了获得性耐药 导致其疗效降低甚至无效 研究表明 信号通路异常激活 表皮生长因子受体 (
 臧晓南 张学成 王高歌 刘金姐 张晓辉 刘 滨 对两种丝状蓝藻 钝顶节旋藻和盐泽螺旋藻 在基因工程中常用作选择试剂的 种抗生素 氯霉素 氨苄青霉素 红霉素 链霉素 卡那霉素 庆大霉素和新霉素 的敏感性作比较实验 结果表明 两种蓝藻对抗生素的敏感性既有共同的特点 也有 明显的差异 它们对红霉素 氯霉素和链霉素最敏感 致死浓度分别为 和 两种蓝藻对氨苄青霉素比较敏感 的氨苄青霉素即可抑制 和 的生长 但
臧晓南 张学成 王高歌 刘金姐 张晓辉 刘 滨 对两种丝状蓝藻 钝顶节旋藻和盐泽螺旋藻 在基因工程中常用作选择试剂的 种抗生素 氯霉素 氨苄青霉素 红霉素 链霉素 卡那霉素 庆大霉素和新霉素 的敏感性作比较实验 结果表明 两种蓝藻对抗生素的敏感性既有共同的特点 也有 明显的差异 它们对红霉素 氯霉素和链霉素最敏感 致死浓度分别为 和 两种蓝藻对氨苄青霉素比较敏感 的氨苄青霉素即可抑制 和 的生长 但
材料! 方法! # 基因的扩增及其序列分析
 生物技术通报 黄艳燕 黄靖华 卢福芝 孙靓 彭立新 周兴 黄日波 利用 的方法从鼠李糖乳杆菌基因组 中扩增到 乳酸脱氢酶基因 并连接到载体 上 构建表达质粒 将重组质粒 转化大肠杆菌 重组菌株经 诱导表达 电泳分 析表明 在大肠杆菌中实现了表达 表达产物的分子量约为 同时采用紫外分光光度法测定 乳酸脱氢酶的酶活 测得重组菌株的 乳酸脱氢酶活力为 最适反应温度为 最适 乳酸脱氢酶 克隆 表达 鼠李糖乳杆菌
生物技术通报 黄艳燕 黄靖华 卢福芝 孙靓 彭立新 周兴 黄日波 利用 的方法从鼠李糖乳杆菌基因组 中扩增到 乳酸脱氢酶基因 并连接到载体 上 构建表达质粒 将重组质粒 转化大肠杆菌 重组菌株经 诱导表达 电泳分 析表明 在大肠杆菌中实现了表达 表达产物的分子量约为 同时采用紫外分光光度法测定 乳酸脱氢酶的酶活 测得重组菌株的 乳酸脱氢酶活力为 最适反应温度为 最适 乳酸脱氢酶 克隆 表达 鼠李糖乳杆菌
主要内容 胃癌辅助治疗相关 JACCRO 晚期胃癌相关 靶向治疗方面 ü VEGFR 通路 (Ab 4036) ü HER-2 (Ab 4011 和 Ab 4038) ü STAT3 信号通路抑制剂 ( BRIGHTER 研究 Ab 4010) 免疫治疗方面 ü KEYNOTE 061 (Ab 40
 主要内容 胃癌辅助治疗相关 JACCRO 晚期胃癌相关 靶向治疗方面 ü VEGFR 通路 (Ab 4036) ü HER-2 (Ab 4011 和 Ab 4038) ü STAT3 信号通路抑制剂 ( BRIGHTER 研究 Ab 4010) 免疫治疗方面 ü KEYNOTE 061 (Ab 4056 和 Ab 4062 Oral) 止吐相关 Abs 10019 和 Abs 1078 胃癌辅助治疗方面
主要内容 胃癌辅助治疗相关 JACCRO 晚期胃癌相关 靶向治疗方面 ü VEGFR 通路 (Ab 4036) ü HER-2 (Ab 4011 和 Ab 4038) ü STAT3 信号通路抑制剂 ( BRIGHTER 研究 Ab 4010) 免疫治疗方面 ü KEYNOTE 061 (Ab 4056 和 Ab 4062 Oral) 止吐相关 Abs 10019 和 Abs 1078 胃癌辅助治疗方面
第一章 总论
 陕 西 盛 华 冶 化 有 限 公 司 30000 吨 金 属 钙 ( 一 期 15000 吨 金 属 钙 生 产 线 ) 建 设 项 目 前 言 前 言 一 项 目 由 来 金 属 钙 是 一 种 活 泼 的 轻 有 色 金 属, 在 工 业 领 域 中 的 应 用 广 泛, 随 着 现 代 科 学 技 术 的 不 断 发 展, 其 应 用 范 围 与 应 用 领 域 在 不 断 拓 展, 国 际
陕 西 盛 华 冶 化 有 限 公 司 30000 吨 金 属 钙 ( 一 期 15000 吨 金 属 钙 生 产 线 ) 建 设 项 目 前 言 前 言 一 项 目 由 来 金 属 钙 是 一 种 活 泼 的 轻 有 色 金 属, 在 工 业 领 域 中 的 应 用 广 泛, 随 着 现 代 科 学 技 术 的 不 断 发 展, 其 应 用 范 围 与 应 用 领 域 在 不 断 拓 展, 国 际
第 期 曹 源 等 形式化方法在列车运行控制系统中的应用
 第 卷 第 期 年 月 交通运输工程学报 曹 源 唐 涛 徐田华 穆建成 为了确保列车运行控制系统设计和开发的正确性 比较了仿真 测试和形式化 种能够验证 系统设计正确性的方式 根据列车运行控制系统对安全的苛求性 提出了 个与系统安全相关的重要特性 即实时性 混成性 分布 并发 性 反应性 并分析了与这些特性相关的具体形式化方法 通 过对每种形式化方法的数学基础和应用范围的分析和归类 给出了各种方法的优势和不足
第 卷 第 期 年 月 交通运输工程学报 曹 源 唐 涛 徐田华 穆建成 为了确保列车运行控制系统设计和开发的正确性 比较了仿真 测试和形式化 种能够验证 系统设计正确性的方式 根据列车运行控制系统对安全的苛求性 提出了 个与系统安全相关的重要特性 即实时性 混成性 分布 并发 性 反应性 并分析了与这些特性相关的具体形式化方法 通 过对每种形式化方法的数学基础和应用范围的分析和归类 给出了各种方法的优势和不足
 é SI 12g C = 6 12 = 1 H2( g) + O2( g) H2O( l) + 286kJ ( 1) 2 1 1 H 2( g) + O2( g) H2O( l) H = 286kJ mol ( 2) 2 1 N 2 ( g) + O2( g) NO 2 ( g) 34kJ 2 1 1 N 2 ( g) + O2( g) NO 2 ( g) H = + 34kJ mol 2 1 N
é SI 12g C = 6 12 = 1 H2( g) + O2( g) H2O( l) + 286kJ ( 1) 2 1 1 H 2( g) + O2( g) H2O( l) H = 286kJ mol ( 2) 2 1 N 2 ( g) + O2( g) NO 2 ( g) 34kJ 2 1 1 N 2 ( g) + O2( g) NO 2 ( g) H = + 34kJ mol 2 1 N
南通大学杂志社 南通大学学报 医学版. */(& 0 1&( () (' / ' '-& -' (- 评价血清 %'8$ 在肝细胞肝癌诊断中的作用 张 玉 邵建国 陈 琳 卞兆连 管海涛 南京中医药大学 南京 江苏省南通市第三人民医院肝病研究所 摘 要 目的 探讨血清 %'8$ 作为一种新的生物标志
 .*/& 0 1&) '/' '-& -'- 评价血清 %'8$ 在肝细胞肝癌诊断中的作用 张 玉 邵建国 陈 琳 卞兆连 管海涛 南京中医药大学 南京 江苏省南通市第三人民医院肝病研究所 摘 要 目的 探讨血清 %'8$ 作为一种新的生物标志物在肝细胞肝癌 2&-*&/ -&/-'%&3 44 诊断中 的作用 方法 采用实时定量聚合酶链式反应 /&$'% 9*&'&' 2%/& -&' /&-'3
.*/& 0 1&) '/' '-& -'- 评价血清 %'8$ 在肝细胞肝癌诊断中的作用 张 玉 邵建国 陈 琳 卞兆连 管海涛 南京中医药大学 南京 江苏省南通市第三人民医院肝病研究所 摘 要 目的 探讨血清 %'8$ 作为一种新的生物标志物在肝细胞肝癌 2&-*&/ -&/-'%&3 44 诊断中 的作用 方法 采用实时定量聚合酶链式反应 /&$'% 9*&'&' 2%/& -&' /&-'3
三 消除阶段的监测 2
 中疾控传防发 2015 139 号附件 全国消除疟疾监测方案 (2015 版 ) 一 原则与目的 二 监测相关定义 1 三 消除阶段的监测 2 3 4 5 6 7 8 四 消除后阶段的监测 9 10 11 五 数据的收集 分析和反馈 六 监测能力维持 12 13 七 质量控制 14 八 组织管理 15 九 附件和附表 16 附件 1 一 调查时间 二 调查方法 三 注意事项 17 附件 2 一 监测时间
中疾控传防发 2015 139 号附件 全国消除疟疾监测方案 (2015 版 ) 一 原则与目的 二 监测相关定义 1 三 消除阶段的监测 2 3 4 5 6 7 8 四 消除后阶段的监测 9 10 11 五 数据的收集 分析和反馈 六 监测能力维持 12 13 七 质量控制 14 八 组织管理 15 九 附件和附表 16 附件 1 一 调查时间 二 调查方法 三 注意事项 17 附件 2 一 监测时间
 390 1975 23 664 25 117 1986 Km % % % I 3.61 23.1 387.8 15.4 35.8 A 2.21 14.1 300.1 11.9 33.44 B 1.40 9.0 87.7 3.5 2.36 II 6.11
390 1975 23 664 25 117 1986 Km % % % I 3.61 23.1 387.8 15.4 35.8 A 2.21 14.1 300.1 11.9 33.44 B 1.40 9.0 87.7 3.5 2.36 II 6.11
13 对蒽环类化疗药物耐药的转移性乳腺癌患者的治疗效果并不理想 此类患者的后继治疗中, 吉西他滨联合紫杉醇 (GT 方案 ) [3] 及单药长春瑞滨方案 (NVB 方案 ) [4] 均为复发或转移乳腺癌的可选治疗方案, 有研究报道 GT 方案在有效率 (responserate, RR) 疾病进展时
![13 对蒽环类化疗药物耐药的转移性乳腺癌患者的治疗效果并不理想 此类患者的后继治疗中, 吉西他滨联合紫杉醇 (GT 方案 ) [3] 及单药长春瑞滨方案 (NVB 方案 ) [4] 均为复发或转移乳腺癌的可选治疗方案, 有研究报道 GT 方案在有效率 (responserate, RR) 疾病进展时 13 对蒽环类化疗药物耐药的转移性乳腺癌患者的治疗效果并不理想 此类患者的后继治疗中, 吉西他滨联合紫杉醇 (GT 方案 ) [3] 及单药长春瑞滨方案 (NVB 方案 ) [4] 均为复发或转移乳腺癌的可选治疗方案, 有研究报道 GT 方案在有效率 (responserate, RR) 疾病进展时](/thumbs/91/105546641.jpg) 12 临床研究 吉西他滨联合紫杉醇方案与长春瑞滨单药方案治疗蒽环类耐药的转移性乳腺癌的临床观察 张杰, 徐可, 王少龙 ( 成都医学院第一附属医院, 成都 610500) [ 摘要 ] 目的 : 评价吉西他滨联合紫杉醇方案与单药长春瑞滨方案在治疗蒽环类耐药的转移性乳腺癌患者中的疗效及不良反应 方法 :2009 年 10 月至 2012 年 12 月, 我科收治的符合治疗条件的晚期乳腺癌患者共 126
12 临床研究 吉西他滨联合紫杉醇方案与长春瑞滨单药方案治疗蒽环类耐药的转移性乳腺癌的临床观察 张杰, 徐可, 王少龙 ( 成都医学院第一附属医院, 成都 610500) [ 摘要 ] 目的 : 评价吉西他滨联合紫杉醇方案与单药长春瑞滨方案在治疗蒽环类耐药的转移性乳腺癌患者中的疗效及不良反应 方法 :2009 年 10 月至 2012 年 12 月, 我科收治的符合治疗条件的晚期乳腺癌患者共 126
CANCER DU RECTUM
 大肠癌规范化内科治疗 上海肿瘤医院 肿瘤内科 李进 一 大肠癌的辅助治疗 二 大肠癌的姑息化疗 一 大肠癌的辅助治疗 二 大肠癌的姑息化疗 IFL ( 依立替康联合 5-FU/LV) CALG B 89803 随机对照研究 CPT-11 125mg/m² LV 20mg/m² iv 5FU 500mg/m² iv (IFL 方案 ) LV 500mg/m² iv 5FU 500mg/m²iv (Roswell
大肠癌规范化内科治疗 上海肿瘤医院 肿瘤内科 李进 一 大肠癌的辅助治疗 二 大肠癌的姑息化疗 一 大肠癌的辅助治疗 二 大肠癌的姑息化疗 IFL ( 依立替康联合 5-FU/LV) CALG B 89803 随机对照研究 CPT-11 125mg/m² LV 20mg/m² iv 5FU 500mg/m² iv (IFL 方案 ) LV 500mg/m² iv 5FU 500mg/m²iv (Roswell
Microsoft Word - Avastin_CDS34.0_CRC TML_0718-AVA-01_clean
 0718-AVA-01 Injection Bevacizumab AVASTIN () 0.3-3.2% ( 2.4.1()) 28 28( 2.4.1( )) ( ) (5 ) ( 2.4.1()) 1. 1.1 / ATC Code: L01X C07 1.2 1.3 (i.v. ) ( 2.4.1 ) 1.4 / 1.5 Bevacizumab [(VEGF) ] 1 100 400 4 16
0718-AVA-01 Injection Bevacizumab AVASTIN () 0.3-3.2% ( 2.4.1()) 28 28( 2.4.1( )) ( ) (5 ) ( 2.4.1()) 1. 1.1 / ATC Code: L01X C07 1.2 1.3 (i.v. ) ( 2.4.1 ) 1.4 / 1.5 Bevacizumab [(VEGF) ] 1 100 400 4 16
韩敏, 等 : 曲妥珠单抗联合紫杉醇脂质体及卡培他滨对 HER 2 阳性复发转移性乳腺癌患者血清 LCN 2 及 Six1 表达的影响 / 8 #' >/ / B " "! # ' </ / 7 Conclusion:$'! "! " 2*,. 30 $4.! " " Keywords!!. 乳腺癌
 曲妥珠单抗联合紫杉醇脂质体及卡培他滨对 HER 2 阳性复发转移性乳腺癌患者血清 LCN 2 及 Six1 表达的影响 韩敏, 王坚, 郑玮薇 ( 马鞍山市人民医院肿瘤放疗科, 安徽马鞍山 243000) 摘要 目的 : 探讨曲妥珠单抗联合紫杉醇脂质体及卡培他滨 (HPX 联合方案 ) 对于人表皮生长因子 2(human epidermalgrowthfactor 2,HER 2) 阳性复发性转移乳腺癌患者血清脂质运载蛋白
曲妥珠单抗联合紫杉醇脂质体及卡培他滨对 HER 2 阳性复发转移性乳腺癌患者血清 LCN 2 及 Six1 表达的影响 韩敏, 王坚, 郑玮薇 ( 马鞍山市人民医院肿瘤放疗科, 安徽马鞍山 243000) 摘要 目的 : 探讨曲妥珠单抗联合紫杉醇脂质体及卡培他滨 (HPX 联合方案 ) 对于人表皮生长因子 2(human epidermalgrowthfactor 2,HER 2) 阳性复发性转移乳腺癌患者血清脂质运载蛋白