5 WHO laboratory manual for the examination and processing of human semen 译者谷翊群陈振文卢文红姚康寿朱伟杰于和鸣熊承良梁小薇姜辉商学军裴开颜唐文豪周善杰周芳审校贾孟春罗宏志朱伟杰金杰黄宇烽王晓峰朱积川王一飞
|
|
|
- 供 徐
- 5 years ago
- Views:
Transcription
1
2 5 WHO laboratory manual for the examination and processing of human semen 译者谷翊群陈振文卢文红姚康寿朱伟杰于和鸣熊承良梁小薇姜辉商学军裴开颜唐文豪周善杰周芳审校贾孟春罗宏志朱伟杰金杰黄宇烽王晓峰朱积川王一飞
3 5 世界卫生组织 2010 年出版 WHO laboratory manual for the examination and processing of human semen,5 th ed World Health Organization,2010 世界卫生组织总干事授予人民卫生出版社本书中文版翻译权, 人民卫生出版社只对中文版负责 在本出版物采用的名称和陈述的材料并不意味着世界卫生组织对任何国家 领地 城市或地区及其当局的合法地位表示任何的意见, 也不意味着世界卫生组织对其边界或分界线的确定表示任何的意见 地图上的虚线表示可能尚未完全达成一致的大致边界线 凡提及某些公司或某些制造商的产品时, 并不意味着它们已被世界卫生组织认可或推荐, 或比其他未提及的同类公司或产品更好 除差错和疏忽外, 凡专利产品名称均冠以大写字母, 以示区别 世界卫生组织不保证包含在本出版物中的信息是完整和准确的, 并且对使用所造成的任何损害不承担责任 图书在版编目 CIP 数据世界卫生组织人类精液检查与处理实验室手册 / 世界卫生组织著 ; 谷翊群等译. 北京 : 人民卫生出版社, ISBN Ⅰ.1 世 Ⅱ.1 世 2 谷 手册 Ⅳ.1R Ⅲ.1 人类 - 精液鉴定 - 中国版本图书馆 CIP 数据核字 (2010) 第 号 谷翊群等 人民卫生出版社 ( 中继线 ) 北京市朝阳区潘家园南里 19 号 E - mail pmph.com 新华书店 / 千字 2011 年 9 月第 1 版 2011 年 9 月第 1 版第 1 次印刷 ISBN /R 元 pmph.com ( 凡属印装质量问题请与本社销售中心联系退换 )
4 3 谷翊群国家人口和计划生育委员会科学技术研究所陈振文国家人口和计划生育委员会科学技术研究所卢文红国家人口和计划生育委员会科学技术研究所姚康寿浙江省计划生育科学技术研究所朱伟杰暨南大学生命科学技术学院生殖免疫研究所于和鸣国家人口和计划生育委员会科学技术研究所熊承良华中科技大学同济医学院计划生育研究所梁小薇国家人口和计划生育委员会科学技术研究所姜辉北京大学第三医院商学军南京军区南京总医院裴开颜国家人口和计划生育委员会科学技术研究所唐文豪北京大学第三医院周善杰国家人口和计划生育委员会科学技术研究所周芳国家人口和计划生育委员会科学技术研究所 贾孟春国家人口和计划生育委员会科学技术研究所罗宏志国家人口和计划生育委员会科学技术研究所朱伟杰暨南大学生命科学技术学院生殖免疫研究所金杰北京大学第一医院黄宇烽南京军区南京总医院王晓峰北京大学人民医院朱积川北京大学人民医院王一飞上海交通大学医学院
5 4
6 5 本手册由 UNDP/UNFPA/WHO/ 世界银行人类生殖研究 发展与培训特别计划 (HRP) 和 WHO 生殖健康与研究部 (RHR) 出版 对下列参与手册准备与编辑的人员深表谢意 Dr Trevor G Cooper Centre of Reproductive Medicine and Andrology of the University, Münster, Germany (WHO Collaborating Centre for Research in Male Reproduction) Dr John Aitken Biological Sciences School of Life and Environmental Sciences University Drive Callaghan, New South Wales, Australia Dr Jacques Auger Service de Biologie de la Réproduction Pavillon Cassini Hôpital Cochin Paris, France Dr HW Gordon Baker University of Melbourne Department of Obstetrics and Gynaecology Royal Women s Hospital Carlton, Victoria, Australia Dr Chris LR Barratt Division of Maternal and Child Health Sciences The Medical School Ninewells Hospital Dundee, Scotland Dr Hermann M Behre Centre for Reproductive Medicine and Andrology Martin-Luther-University Halle, Germany Dr Lars Björndahl Andrology Centre, Karolinska University Hospital and Institute, Stockholm, Sweden Ms Charlene Brazil Center for Health and the Environment University of California Davis, CA, USA Dr Christopher De Jonge University of Minnesota Reproductive Medicine Center Minneapolis, MN, USA Dr Gustavo F Doncel CONRAD Department of Obstetrics and Gynecology Eastern Virginia Medical School Norfolk, VA, USA Dr Daniel Franken Department of Obstetrics and Gynaecology Tygerberg Hospital Tygerberg, South Africa Dr Trine B Haugen Faculty of Health Sciences Oslo University College Oslo, Norway Dr Aucky Hinting Andrology Unit, Department of Biomedicine School of Medicine Airlangga University, Surabaya, Indonesia
7 6 致谢 Mr Godwin E Imade Department of Obstetrics and Gynaecology Faculty of Medical Sciences University of Jos Jos, Nigeria Dr Thinus F Kruger Reproductive Biology Unit Stellenbosch University Tygerberg, South Africa Dr Hesbon O Odongo Department of Zoology University of Nairobi Nairobi, Kenya Ms Elizabeth Noonan Fred Hutchinson Cancer Research Center Statistical Center for HIV/AIDS Research and Prevention Seattle, WA, USA Dr Steven M Schrader National Institute for Occupational Safety and Health Centers for Disease Control and Prevention Cincinnati, OH, USA Dr Christina CL Wang Harbor-UCLA Medical Center Torrance, CA, USA Dr William Shu-Biu Yeung Department of Obstetrics and Gynaecology University of Hong Kong Hong Kong SAR, China WHO Secretariat, Department of Reproductive Health and Research Dr Kirsten M Vogelsong Scientist Research Area Manager Dr Sigrid von Eckardstein Former Acting Research Area Manager Dr Michael T Mbizvo Director ad interim Ms Maud Keizer Secretary 另外要感谢 :Ms Cathy Treece Ms Charlene Tollner 和 Jim Overstreet 教授 (University of California,Davis,CA,USA) 提供形态学显微照片并核对培养基 ;Dr Rune Eliasson (Sophiahemmet Hospital,Stockholm,Sweden) 在定义非精子细胞上提供的帮助 ;Dr Timothy Farley( 瑞士, 日内瓦,WHO) 复查质量控制部分 ;Dr Gary N Clarke(The Royal Women s Hospital,Carlton,Australia),Dr Roelof Menkveld(Tygerberg Academic Hospital and University of Stellenbosch,Tygerberg,South Africa), 以及 Pieter Wranz 教授 (University of Stellenbosch, Tygerberg,South Africa) 提供手册编辑所用的附注 非常感谢国际男科学会给予的财政支持 谨以此手册献给已故的 Geoffrey Waites( ) 先生,WHO 男性生育调节专题委员会前负责人, 这本实验室手册第 版的共同编辑者 Geoff 的正直 公正和对贫困者的关心, 激励着编委们怀着敬意投入此次编写任务
8 7 Ab antibody 抗体 AI artificial insemination 人工授精 AID artificial insemination with donor semen 供精人工授精 AIH artificial insemination with husband s semen 夫精人工授精 ALH amplitude of lateral head displacement 精子头侧摆幅度 ANOVA analysis of variance 方差分析 APAAP alkaline phosphatase anti-alkaline phosphatase 碱性磷酸酶 - 抗碱性磷酸酶复 complex 合物 AR acrosome-reacted 顶体反应 ART assisted reproductive technology 辅助生殖技术 ASA anti-sperm antibody 抗精子抗体 BAEE N-benzoyl-L-arginine ethyl ester N- 苯甲酰 ( 基 )-L- 精氨酸乙酯 BCF beat-cross frequency (Hz) 鞭打频率 (Hz) BSA bovine serum albumin 牛血清白蛋白 CASA computer-aided sperm analysis 计算机辅助精子分析 CASMA computer-aided sperm morphometric assessment 计算机辅助精子形态计量分析 CBAVD congenital bilateral absence of the vas deferens 先天性双侧输精管缺如 CD compact disk 光盘 CD cytoplasmic droplet 胞浆小滴 CD45 cluster of determination 45 (pan-leukocyte marker) 抗原决定簇 45( 白细胞共同抗 原标志物 ) CD46 cluster of determination 46 (acrosomal antigen) 抗原决定簇 46( 顶体抗原 ) CI confidence interval 可信区间 CL confidence limits 可信限 CO 2 carbon dioxide 二氧化碳 DMSO dimethyl sulfoxide 二甲基亚砜 DNA deoxyribonucleic acid 脱氧核糖核酸 DPBS Dulbecco s phosphate-buffered saline Dulbecco s 磷酸盐缓冲液 DVD digital versatile disc 数字多功能光盘 EDTA ethylenediamine tetra-acetic acid 乙二胺四乙酸 EQA external quality assurance 外部质量保证 EQC external quality control 外部质量控制 ERC excess residual cytoplasm 过量残留胞浆 FITC fluorescein isothiocyanate 异硫氰酸荧光素 FMLP formyl-methionyl-leucyl-phenylalanine 甲酰 - 甲硫氨酰 - 亮氨酰 - 苯丙氨酸
9 8 缩写词 GIFT gamete intrafallopian transfer 输卵管内配子移植术 GPC glycerophosphocholine 甘油磷酸胆碱 H 2O 2 hydrogen peroxide 过氧化氢 HBSS Hanks balanced salt solution Hanks 平衡盐溶液 HBV hepatitis B virus 乙型肝炎病毒 hcg human chorionic gonadotrophin 人绒毛膜促性腺激素 HCV hepatitis C virus 丙型肝炎病毒 HIV human immunodeficiency virus 人类免疫缺陷病毒 HOP hamster oocyte penetration 仓鼠卵母细胞穿透 HOS hypo-osmotic swelling 低渗膨胀 HPF high-power field 高倍视野 HRP horseradish peroxidase 辣根过氧化物酶 HSA human serum albumin 人血清白蛋白 HTF human tubal fluid 人输卵管液 IB immunobead 免疫珠 IBT immunobead test 免疫珠实验 ICSI intracytoplasmic sperm injection 卵胞浆内单精子注射技术 Ig immunoglobulin 免疫球蛋白 IM immotility 不活动 IQC internal quality control 内部质量控制 IU international unit 国际单位 IUI intrauterine insemination 宫腔内人工授精 IVF in-vitro fertilization 体外受精 KRM Krebs-Ringer Medium Krebs-Ringer 培养液 LIN linearity 直线性 LLQ lower limit of quantification 定量下限 LPF low-power field 低倍视野 MAD mean angular displacement 平均角位移 MAI multiple anomalies index 多重异常指数 MAR mixed antiglobulin reaction 混合抗球蛋白反应 NA numerical aperture 数值孔径 NP non-progressive (motility) 非前向 ( 运动 ) PBS phosphate-buffered saline 磷酸盐缓冲液 PDCA plan, do, check, act 计划, 执行, 检查, 行动 PMA phorbol 12-myristate 13-acetate 佛波 13 酯 PMSG pregnant mare serum gonadotrophin 孕马血清促性腺激素 PNPG p-nitrophenol glucopyranoside 对 - 硝基苯酚吡喃葡萄糖苷 PR progressive (motility) 前向 ( 运动 ) PSA Pisum sativum agglutinin 豌豆凝集素 QA quality assurance 质量保证
10 缩写词 9 QC quality control 质量控制 RCF relative centrifugal force 相对离心力 RI refractive index 折光率 RNA ribonucleic acid 核糖核酸 ROS reactive oxygen species 活性氧类物质 r.p.m. revolutions per minute 每分钟转数 SD standard deviation 标准差 SDI sperm deformity index 精子畸形指数 SDS sodium dodecyl sulfate 十二烷基硫酸钠 SE standard error 标准误 SOP standard operating procedure 标准操作程序 STR straightness (VSL/VAP) 前向性 (VSL/VAP) TBS Tris-buffered saline 三羟甲基氨基甲烷缓冲液 TGG Tyrode s glucose glycerol Tyrode s 葡萄糖甘油 TZI teratozoospermia index 畸形精子指数 VAP average path velocity 平均路径速率 VCL curvilinear velocity 曲线速率 VSL straight-line (rectilinear) velocity 直线速率 WHO World Health Organization 世界卫生组织 WOB wobble (VAP/VCL) 摆动性 (VAP/VCL)
11 10
12 第一部分精液分析 准备 以诊断或研究为目的的精液采集 用于辅助生殖的精液无菌采集 用于微生物学分析的精液无菌采集 在家采集精液 使用避孕套采集精液 标本的安全处理 液化 精液的黏稠度 精液外观 精液体积 精液 ph 值 精液充分混匀和代表性取样 制备湿片 精子聚集 精子凝集 非精子细胞成分 精子运动分类 17
13 12 目录 制备和评估精液样本的精子活力 样例 参考值下限 应用伊红 - 苯胺黑的精子存活率试验 单用伊红的精子存活率试验 应用低渗膨胀的精子存活率试验 计数板类型 改良 Neubauer 血细胞计数板 使用血细胞计数板网格 计数板的保养 稀释精液的固定液 计数足够精子的重要性 如何确定精液所需的稀释倍数 稀释精液样本并加入血细胞计数板的计数池中 评估计数池内的精子数目 计算精液中精子浓度 样例 精子浓度的参考值下限 计算每次射出精液的精子总数 精子总数的参考值下限 不做进一步处理 离心样本后检测精子 检测非离心标本中活动精子数目 在整个改良 Neubauer 血细胞计数板计数池中评估精子数目少的样本 ( 相差显微镜 ) 用一次性大容量计数板计数精子少的样本 ( 荧光显微镜 ) 计数精液中圆细胞浓度 方法的灵敏度 44
14 目录 样例 正常精子的概念 精液涂片的制备 传统的固定和染色方法 用于精子形态学分析的巴氏染色程序 用于精子形态学分析的 Shorr 染色程序 精子形态的快速染色程序 正常精子形态学的分类 异常精子形态学的分类 正常精子形态的评估 样例 参考值下限 异常精子形态的评估 样例 特定精子缺陷的评估 使用邻甲苯胺染细胞内过氧化物酶的步骤 混合抗球蛋白反应试验 直接免疫珠试验 间接免疫珠试验 多重形态缺陷指数的计算 样例 原理 试剂 100
15 14 目录 步骤 体内试验 ( 性交后试验 ) 体外试验 体外简化玻片试验 毛细管试验 精浆锌的测定 精浆果糖的测定 精浆中性 α- 葡糖苷酶的测定 引言 使用 CASA 评估精子的活力 CASA 用于评估精子浓度 计算机辅助精子形态学计量分析 引言 精子悬液活性氧的检测 顶体状态荧光检测方法的操作步骤 诱导顶体反应的检测 方案 128 第二部分 精子制备 精子从精浆中的分离 制备方法的选择 135
16 目录 将精子与精浆和感染性微生物分离的效率 试剂 程序 试剂 程序 试剂 程序 酶学方法 机械方法 处理精子悬液用于 ICSI 标准程序 少精子症标本和手术取精的冷冻方案 麦管的标记和记录 147 第三部分质量保证 7 151
17 16 目录 外购的 QC 样本 实验室自制的 QC 样本 储存的 QC 样本 ( 外购或自制 ) 新鲜的 QC 样本 ( 实验室自制 ) X bar 图 S 图 157 X S 如何识别失控值 失控的原因 对失控值的回应 两个或两个以上检测人员之间结果比较 月均值的监控 EQC 结果的评估 对失控结果的回应 分析精子浓度遇到问题时的实用建议 精子形态学分析遇到问题时的实用建议 精子活力分析遇到问题时的实用建议 精子存活率分析遇到问题时的实用建议 169 参考文献 171 附录
18 目录
19 18 目录 图 图 2-1 在 1 年半期间精子总数和精子浓度的变异 6 图 2-2 精液中精子的非特异性聚集 14 图 2-3 精子不同凝集程度的示意图 15 图 2-4 辅助评估精子活力 18 图 2-5 在亮视野显微镜下观察伊红 - 苯胺黑涂片 22 图 2-6 人精子在低渗透压作用下的特征性形态变化的示意图 24 图 2-7 改良 Neubauer 血细胞计数板 26 图 2-8 网格中方格的精子计数 27 图 2-9 观察整个盖玻片区域寻找活动精子 37 图 2-10 正常 形态精子 45 图 2-11 用于精子形态学分析的精液涂片方法 47 图 2-12 制备一张正常精液的涂片 47 图 2-13 人精子一些异常形态的示意图 55 图 2-14 人精液中过氧化物酶阳性与阴性细胞 88 图 3-1 精液中的白细胞 102 图 3-2 Kremer 精子穿透计 108 图 3-3 CASA 系统检测参数的标准术语 117 图 4-1 酵母多糖刺激白细胞产生的化学发光信号 122 图 4-2 细胞悬液中白细胞和精子的活性氧产生的相对量 123 图 4-3 人精子豌豆凝集素 (PSA) 荧光染色 126 图 4-4 含有人精子的去卵透明带仓鼠卵母细胞的相差显微镜照片 132 图 7-1 精子浓度的 X bar 图 158 图 7-2 精子浓度 S 图 159 图 7-3 前向运动精子百分率的人工和 CASA 测量值 Bland-Altman 图 161
20 目录 19 图 7-4 精子浓度测量值 Youden 图 162 图 A2-1 根据转子半径和转速测定相对离心力 (RCF) 的列线图 198 图 A5-1 玻片上干燥的宫颈黏液羊齿状结晶形成示例 211 图 A7-1 根据评估的精子总数得出的两次重复计数之间的可接受差异 220 图 A7-2 对应于真实百分率和所测精子总数的两次重复测量所得百分 率之间的可接受差异 222 图 A7-3 辅助评估精子活力 226 图 A7-4 通过带有网线 ( 红色栅格 ) 的目镜观察 227 图 A7-5 监视器上显示的镜台测微尺录像和覆盖在监视器上的绘制栅格, 说明见文内 228 方框 方框 2-1 证实精液采集容器的相容性 8 方框 2-2 菠萝蛋白酶的准备 11 方框 2-3 充分混匀精液 14 方框 2-4 制备湿片的深度 14 方框 2-5 评估百分率的误差 19 方框 2-6 重复百分率的比较 19 方框 2-7 评估精子数目的误差 28 方框 2-8 在改良 Neubauer 血细胞计数池的中央 3 个网格对每个重复样本 计数 200 个精子 29 方框 µm 深的湿片, 每高倍镜视野所观察的精液体积 30 方框 2-10 重复计数的比较 33 方框 2-11 每个样本在改良 Neubauer 血细胞计数板的全部 9 个网格计数达到 200 个精子 38 方框 2-12 在 100µm 深的大容量一次性计数板上, 每个重复样本可计数达到 200 个精子 41 方框 2-13 在 100µm 深的大容量一次性计数板上, 每高倍镜视野观察到的体积 42 方框 2-14 封片剂 49 方框 3-1 蜡 - 凡士林混合物的制备 104 方框 3-2 在制备的 100µm 厚度黏液玻片中每个高倍视野所观察的体积 105 方框 4-1 诱发仓鼠排卵 129 方框 4-2 制备玻璃移液管 131 方框 6-1 精液冷冻保存的原因 143
21 20 目录 方框 6-2 人精液冷冻保存的风险评估 144 方框 7-1 质量保证和质量控制术语 152 方框 7-2 确定 X bar 图的警戒限和处置限 157 方框 7-3 计算 X bar 控制限的另一方法 : 由合并标准差计算 157 方框 7-4 确定 S 图的警戒限和处置限 158 方框 7-5 质控图的基本控制规则 160 方框 7-6 评估检测人员之间的系统性差异 163 方框 7-7 IQC 的主要特性 164 方框 7-8 QC 日程表 166 方框 7-9 QC 检验概要 166 方框 A2-1 离心力的计算 197 方框 A3-1 物镜 202 方框 A5-1 测定采集到的宫颈黏液体积 213 方框 A5-2 厚度 100µm 的黏液制片每高倍视野的体积 214 表 表 2-1 从重复计数 200 个精子 ( 总共计数 400 个精子 ) 确定所给出平均值的 两个百分率之间的可接受差异 19 表 2-2 根据计数的精子总数四舍五入的取样误差 (%) 29 表 2-3 精液标本所需的稀释倍数, 如何进行稀释, 使用的计数板和可能 评估的区域 30 表 2-4 对于一定总数的两个重复计数可接受的差异 32 表 2-5 对于一定总数的两次计数之间可接受的差异 : 低精子浓度 39 表 2-6 精子形态学彩图中注释的解释 56 表 2-7 用于免疫珠试验的精液量 94 表 3-1 多重精子缺陷指数的计算 99 表 3-2 生育和不育夫妇中男性的精子缺陷指数 99 表 3-3 精子穿透密度的等级顺序 109 表 3-4 毛细管试验结果的分级 109 表 7-1 X bar 图和基于平均标准差 (S bar) 的 S 图的控制限的决定因素 156 表 7-2 精子浓度分析时变异 ( 误差 ) 的来源和建议的解决方案 167 表 7-3 精子形态学分析时变异 ( 误差 ) 的来源和推荐的解决方案 168 表 7-4 精子活力分析时变异 ( 误差 ) 的来源和建议的解决方案 168 表 7-5 精子存活率分析时变异 ( 误差 ) 的来源和推荐的解决方案 169
22 目录 21 表 A1-1 精液特性的参考值下限 ( 第 5 个百分位数,95% 可信区间 ) 192 表 A1-2 源自性伴侣在停止使用避孕措施后 12 个月内怀孕的男性精液 参数值的分布 192 表 A1-3 与精液质量相关的术语 193 表 A7-1 对应于特定总数的两次重复计数之间的可接受差异 220 表 A7-2 对应于重复计数 100 个 ( 总共 200 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 223 表 A7-3 对应于重复计数 200 个 ( 总共 400 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 223 表 A7-4 对应于重复计数 400 个 ( 总共 800 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 224
23 22 目录
24 1 1.1 为了适应人类精液检测方法标准化需求日益增加的形势,1980 年首次出版了 WHO 人类精液和精子 - 宫颈黏液相互作用实验室检验手册 该手册至今已更新了 3 次, 被翻译成多种文字 在过去的 30 年里, 该手册被公认提供了全球性的标准, 被广泛地应用于世界各地的研究和临床实验室 尽管如此成功, 鉴于新证据的出现, 以及一些概念需要更详尽的解释和支持性证据, 手册先前几个版本中的一些推荐显然需要修改 上述考虑促使 WHO 成立了一个编辑委员会, 审查旧版手册里描述的所有方法, 以期认可 修改或更新它们 在很多情况下, 使用手册里描述方法所得到的数据不充分, 很难被证实 在某些情况下, 虽然几个信誉良好的独立实验室得到一致的结果, 但是这些结果尚未得到其他实验室的认可 针对这种情况, 编辑委员会在评估相关文献之后达成了一致意见 由于手册中介绍的很多方法需要更详细的描述, 技术人员和科学家提供了一些补充推荐意见 旧版本缺乏详细方法描述, 意味着一些实验室可能使用他人描述的方法, 或者开发他们自己版本的方法, 而仍宣称是按照 WHO 手册做精液分析 为了更加容易地在全球范围内进行比较, 手册新版本做了更详细的描述, 并且在提供另一种分析方法时, 对其原理进行了解释 建议实验室发表研究结果时, 应该注明采用了本手册中哪种特定的方法 第 5 版由三部分组成 : 精液分析 ( 第 2~4 章 ); 精子制备 ( 第 5~6 章 ) 和质量 保证 ( 第 7 章 ) 第一部分涉及精液分析, 与以前的版本类似, 但是分成 3 章, 包 括 :1 标准方法, 这是检测精液质量的基本常规方法 ;2 可选择的试验, 这是在某 些情况下使用或由实验室选择的方法 ;3 研究性试验, 目前不作为常规方法使用 由于精液培养不作为男科学实验室的常规项目, 因此仅在精液的无菌采集部分提 及 在精子制备部分, 将从射精液中获得的精子, 扩展到从睾丸和附睾中获得的 精子 穿插的方法说明包括注释 ( 方法学说明 ) 评述 ( 结果的解释 ) 和方框 ( 含有 额外的解释资料 ) 第 5 版的主要特征概述如下 : 在精液分析章节中包括所有工作液 操作步骤 计算方法和解释等细节, 以使 所给出的每种方法学基本上是完整的, 尽量减少与手册的其他部分相互参照 精子制备部分扩展了内容, 新增了精子冷冻保存一章 涉及宫颈黏液分析的 操作步骤分别写在了可选择方法一章及黏液特性的附录中 附录比旧版本有所减少, 删减了那些限于特殊的或很少需要的资料
25 2 第 1 章背景 精子数目的评估检测 精液标本的稀释方法和用于测量精液标本中精子数的 计数池的面积作了修改, 使之能够每次重复计数 200 个精子 强调了取样误 差和获得准确数字结果的重要性 编辑委员会认为, 每份射出精液的总精 子数比精子浓度能更准确地评估睾丸功能, 但是必须精确测量这份精液的 体积 无精子症的检测 诊断无精子症表面上简单, 但是受到很多因素的困扰, 例 如计数很少精子时误差变大 要分析大量的显微视野以及难于检查充满碎片 的离心后的精子团 建议的改动包括, 检测固定的 未离心处理的标本, 以及 指明所采用计数方法的灵敏度 然而, 为收集到足够数量的精子用于治疗方 案, 进行离心处理是必要的, 而且为了评估输精管切除术后的精液, 检查非固 定的标本的活动精子时也需用离心处理 精子活力的评价 与以往版本最大不同是精子活力的分类 现在建议把精子 活力分类为前向运动 非前向运动和不活动三类精子 ( 替代 a b c 或 d 分级 ) 精子形态学的评价 一些实验室仅评估正常形态精子, 而另一些实验室认为 形态异常精子的类型 部位和程度更重要 这些鉴别或半定量的检测方法是 否能够提高精液分析的价值尚有不同见解 有证据支持正常形态 ( 按严格分 类法或计算机辅助形态学分析所定义的 ) 精子百分率与体内受精率存在一定 关系, 从而表明, 试图确定精液中独特形态的精子亚群是有道理的 在这一 版的手册里, 采纳了更多质量较好的 被认为是正常形态和处于边缘的精子 显微照片, 并附有解释每个精子为何被如此分类的理由 这将有助于培训技 术人员能始终如一地进行精子分类 最近根据一个有生育力人群的数据获得 了正常形态精子百分率的参考值 质量控制 完全重写了这一章 精液分析中严格的质量控制, 对于健全分析 方法是必需的 当质量控制结果不令人满意时, 该章内容对如何改善实验室 操作给予了提示和建议 参考值范围和参考限 特定为有生育力的男性 ( 使其性伴侣能在 12 个月内或 更短时间内怀孕 ) 的精液质量的数据提供了本手册的参考范围 从来自 3 大 洲的 8 个国家 大约 400~1900 份新近当父亲的精液标本的原始数据, 产生 了参考值范围 传统的统计学惯例通常是从双侧参考区间取 2.5% 作为阈值, 低于此值被认为来自不同的人群 然而, 精液参数被认为更适用单侧参考区 间, 因为任何精液参数的高值对生育力不可能是有害的 5% 定为参考值的 下限, 附录 1 中列出了每项精液参数的完整分布 1.3 本手册所描述的方法旨在试图提高精液分析的质量和提高结果的可比性, 不应该作为地方 国家或全球认证机构的强制性标准 精液分析对于临床和研究部门调查男性生育力状况, 以及实施和随访男性生育调节时监测精子发生情况, 都是有用的
26
27
28 5 2.1 在射精过程中, 储存在双侧附睾内的高度浓缩精子悬液与附性腺分泌液混合 和稀释, 形成了精液 精液分成数段射出 比较输精管切除术前后的精液体积, 显示约 90% 的精液量是由附性腺的分泌液组成 (Weiske,1994), 主要来源于前列 腺和精囊腺, 少量来源于尿道球 (Cowper s) 腺和附睾 精液具有两个主要的可量化属性 : 精子总数, 其反映睾丸的精子生产量和睾丸后输精管道系统的通畅性 各个附性腺分泌的液体总量, 其反映附性腺的分泌活性 要的 精子的性状 ( 存活率 活力和形态 ) 和精浆的成分对于精子功能来说是同样重 在性交过程中, 射出精液的初始部分是富含精子的前列腺液, 与延伸至阴道 内的宫颈黏液相接触 (Sobrero & MacLeod,1962), 其余的精液则作为储池存积在 阴道内 与此不同, 在实验室环境场所中, 全部的整份精液采集在一个容器里, 精子被束缚在精囊腺所分泌的蛋白形成的凝胶状物胶冻样凝块中, 随后胶冻样凝 块在前列腺蛋白酶的作用下液化, 液化期间精液渗透压升高 (Björndahl & Kvist, 2003;Cooper et al.,2005) 有证据表明, 不同的诱导射精方法会使精液标本的质量发生改变 在实验室 附近的房间中, 通过手淫诱导射入容器的精液质量, 可能低于在家性交时使用不 含杀精子剂避孕套获取的精液质量 (Zavos & Goodpasture,1989) 这种差异可以 反映出不同的性唤醒方式, 手淫取精所需时间的长短, 其反映了射精前精液溢出 的程度, 也会影响精液质量 (Pound et al.,2002) 在特定采集条件下, 精液质量取决于通常不能被改变的因素, 诸如睾丸生成 精子量 附性腺分泌量和近期患病情况 ( 尤其是发热 ), 以及其他的因素, 例如禁欲 时间, 这些因素都应该被记录下来并在分析结果时加以考虑 精液质量的实验室测定结果取决于以下因素 : 采集标本是否完整 射精时, 射出的初始部分精液主要是富含精子的前列腺 液, 而后面部分的精液则主要是精囊液 (Björndahl & Kvist,2003) 因此, 如 果射精时丢失了富含精子的初始部分, 对精液检测结果的影响将远远大于丢 失最后的部分 附性腺的分泌活动, 射精时精浆稀释高浓度的附睾精子 (Eliasson,2003) 由 于受到其他生殖器官功能的影响, 衡量睾丸精子产出量的直接指标不是精子 浓度, 而是射出的精子总数 ( 精子浓度 精液量 ) 例如, 年轻人和老年人精 液的精子浓度可能相同, 但精子总数可能有所不同, 因为随着年龄的增加, 精 浆量和精子总产出量会降低, 至少在一部分人如此 (Ng et al.,2004) 末次性活动以来的时间间隔 缺乏射精情况下, 精子在附睾内蓄积, 然后溢
29 6 第一部分精液分析 入尿道, 随尿液流出 (Cooper et al.,1993;de Jonge et al.,2004) 除非干扰附 睾功能 (Correa-Perez et al.,2004), 否则禁欲时间延长不会影响精子的存活率 和染色质 (Tyler et al.,1982b;de Jonge et al.,2004) 前次禁欲时间 由于一次射精不能完全排空附睾 (Cooper et al.,1993), 有些 精子是以前射精时存留的 这种情况影响了精液中精子老化程度和精子质量 (Tyler et al.,1982a) 这种影响的程度难以确定, 故很少予以考虑 睾丸大小影响着每次射精的精子总数 (Handelsman et al.,1984;who,1987; Behre et al.,2000;andersen et al.,2000) 睾丸大小反映了精子发生活动的水 平, 对精子形态学也有影响 (Holstein et al.,2003) 精液质量大范围的生物学变异 (Castilla et al.,2006) 是上述很多因素的反 应, 因此要求所有精液检测应该精确 这些大量不可控制的易变因素解释了众所周知的精液成分个体内变异的原 因 (Baker & Kovacs,1985;Alvarez et al.,2003) 图 2-1 显示了一段时间内精液成 分的变化情况, 精液来源于参与一项男性激素避孕研究安慰剂组的 5 例年轻健康 志愿者, 采用 WHO 推荐的方法检测 对于解释精液分析的结果, 注意这种变异 2-1 在 1 年半期间精子总数和精子浓度的变异 (Data courtesy of Schering Plough and Bayer Schering Pharma AG)
30 第 2 章标准程序 7 性是重要的 : 通过一份精液标本的评估不可能确定一位男性精液质量的特征 检测 2~3 份精液标本有助于获取基线数据 (Poland et al.,1985;berman et al.,1996;carlsen et al.,2004;castilla et al.,2006;keel,2006) 尽管检测全部射出的精子也不能阐明少数到达受精部位精子的受精能力, 不 过精液分析提供了一位男性的临床状况的基本信息 如果要使检测结果提供有效 且有用的信息, 精液采集和分析的所有方面必须完全遵循标准化的操作程序 本 章所描述的试验是公认的程序, 包含了精液评估时的基本步骤 精液分析包括以下步骤 ( 在以后的章节另有详细描述 ) 在开始的 5 分钟 : 将标本容器放在实验台上或者孵育箱内 (37 ), 待精液液化 30~60 分钟 : 评估精液的液化状况和外观 测量精液体积 测定精液 ph 值 ( 如果需要 ) 制备湿片用于观察显微镜下外观 精子活力, 以及估计测定精子数目所需的 稀释度 检测精子存活率 ( 如果活动精子百分率低 ) 制备精液涂片用于评估精子形态 稀释精液用于检测精子浓度 评估精子数目 进行混合抗球蛋白反应试验 (the mixed antiglobulin reaction test,mar)( 如果 需要 ) 检测过氧化物酶阳性细胞 ( 如果需要观察圆细胞 ) 制备精子用于免疫珠试验 (the immunobead test)( 如果需要 ) 离心处理精液 ( 如果需要检测生物化学标志物 ) 3 小时之内 : 将标本送至微生物学实验室 ( 如果需要 ) 4 小时之后 : 固定 染色和检测精液涂片, 以评估精子形态学 当天晚些时间 ( 如果标本已冻存, 或者在次日 ): 测定附性腺标志物 ( 如果需要 ) 进行间接免疫珠试验 ( 如果需要 ) 为了限制精液暴露于温度波动的环境和控制从采集到检测的时间, 应该安排在靠近实验室的私密房间内采集标本 ( 特殊情况时参见 和 节 )
31 8 第一部分精液分析 应该禁欲至少 2 天 最多 7 天后, 采集精液标本 如果需要多次采集标本, 每 次禁欲天数均应尽可能一致 应该给予受检者关于精液标本采集的清晰的书面和口头指导, 应该强调精液 标本采集必须完整, 以及受检者要报告精液标本任何部分的丢失情况 检测报告单上应该记录以下资料 ( 见附录 6,A6.1 节 ): 受检者姓名 出生日期 个人编码代码数字 禁欲时间 标本采集日期和时间 标本的完整性 获取标 本遇到的任何困难 标本采集与开始精液分析的时间间隔 手淫法采集标本, 精液射入一清洁广口的玻璃或者塑料容器内, 已证实该批 次容器对精子无毒性 ( 方框 2-1) 标本容器应该保持在 20~37 环境中, 以避免精子射入容器后, 由于大的 温度变化对精子产生影响 容器上必须标记受检者姓名 编码 采集日期和 时间 精液液化期间, 标本容器放置在实验台上或者孵育箱内 (37 ) 如果标本不完整, 尤其是富含精子的初始部分丢失时, 要在检测报告上注明 如果标本不完整, 应该在禁欲 2~7 天后重新采集标本检测 2-1 选择数份精子浓度高和活力好的精液标本, 将每份标本的一半放在已知无毒性的容器内 ( 对照组 ), 另一半放在待检测的容器内, 在 4 小时内 室温或者 37 下每间隔 1 小时重复评估 1 次精子活力 ( 见 2.5 节 ) 如果每个时间点在对照组与测试组之间没有差异 ( 配对 t 检验,P > 0.05), 即可认为待检测的容器对精子是无毒性的, 达到精液采集的要求 依照用于诊断目的的采集方法来采集精液 ( 见 节 ), 但是标本容器 移液 器吸头和混匀用的吸液管必须是无菌的 在这种情况下, 必须避免非精液来源的微生物污染 ( 例如, 来自皮肤的共栖微 生物 ), 标本容器 移液器吸头和混匀用的吸液管必须是无菌的 受检者应该 : 排尿 用肥皂清洗双手和阴茎, 减少来自皮肤共栖微生物所致的标本污染的风险 冲洗掉肥皂沫 使用一次性新的毛巾擦干手和阴茎 精液射入无菌容器 从精液标本采集到开始在微生物学实验室进行检测的时间不能超过 3 小时
32 第 2 章标准程序 在特殊情况下, 例如在门诊不能够通过手淫获取标本, 或者实验室附近缺乏 合适的房间, 可以在家采集精液标本 应该给予受检者关于精液标本采集的清晰书面和口头指导, 应该强调精液标 本采集必须完整, 即采集包括富含精子的初始部分在内的所有精液, 以及受 检者要报告精液标本任何部分的丢失情况 如果标本不完整, 应该记录在检 测报告中 给予受检者一个预先称重的 标记上其姓名和编码的标本容器 受检者应该记录获取精液的时间, 并在采集后的 1 小时之内将标本送至实 验室 在运送至实验室期间, 标本应该保持在 20~37 检测报告应该记录标本是在家采集或者是在实验室外面的其他场所采集 仅在特殊情况下, 例如不能通过手淫成功获取标本, 可以在性交时将精液射 入避孕套来采集标本 仅可使用专门为采集精液设计的无毒性避孕套, 市场上可以买到这种避孕套 应该告知受检者, 源自制造厂商的关于怎样使用 封闭避孕套, 以及怎样将避 孕套送至实验室等事项 受检者应该记录获取精液的时间, 并在采集后的 1 小时之内将标本送至实 验室 在运送至实验室期间, 标本应该保持在 20~37 检测报告应该记录, 标本是在家或者在实验室外面的其他场所, 性交时使用 专用的避孕套采集的 普通的乳胶避孕套不能用于精液采集, 因为它含有损害精子活力的物质 (Jones et al.,1986) 1 性交中断法不是精液采集的可靠方法, 因为含有最多精子的初始部分 精液或许会丢失 此外, 标本可能受到细胞和细菌的污染, 以及低 ph 值的阴 道分泌液可能对精子活力有不良影响 2 如果受检者不能提供精液标本, 性交后实验 ( 见 节 ) 或许可以提供 其精子的一些信息 精液标本可能含有危险的传染性病原体, 例如人类免疫缺陷病毒 (HIV) 肝炎病毒或者单纯疱疹病毒, 因此应视为生物危险品处理 如果标本用于生物检测 宫腔内人工授精 (intra-uterine insemination,iui) 体外受精 (in-vitro fertilization,
33 10 第一部分精液分析 IVF) 卵母细胞质内单精子注射 (intracytoplasmic sperm injection,icsi)( 见 5.1 节 ) 或者进行精液培养 ( 见 节 ), 处理标本过程中必须使用无菌物品和无菌技术 应该严格遵守附录 2 所列的安全指南, 良好的实验室规范 (good laboratory practice) 是实验室安全的基础 (WHO,2004) 2.3 精液分析应在液化不久后立即开始简单的检查, 最好在射精后 30 分钟时, 不要超过 1 小时, 以避免脱水或温度变化影响精液质量 精液射到收集容器后很快呈现典型的半固体凝胶的团块 通常在室温下几分钟内, 精液开始液化 ( 变得稀薄 ), 此时精液中可见异质性混合团块 随着继续液化, 精液变得更加均质和十分稀薄, 在液化最后阶段仅存留少量小凝团 在室温下, 通常在 15 分钟内, 精液标本完全液化, 很少超过 60 分钟或更长时间 如果 60 分钟仍未完全液化, 应作记录 在家中或使用避孕套收集精液标本, 当将标本送到实验室时, 一般已经液化 正常液化的精液标本可能含有不液化的胶冻状颗粒 ( 凝胶状团块 ), 这不表明任何临床意义 然而, 黏液丝的存在可能干扰精液分析 1 液化可以通过如上描述的肉眼观察和显微镜进行识别 随着精液的液化, 不动精子获得活动的能力 如果在显微镜下观察精子不动, 则需要更长时间来完成液化过程 2 液化期间, 置室温下或 37 孵箱中, 在一个二维摇动器上, 不断地轻轻 混匀或旋转样本容器, 有助于产生一个均质的精液标本 3 如果精液在 30 分钟内不液化, 不要开始进行精液分析, 而是再等待 30 分钟 如果 60 分钟后仍未液化, 按 节处理精液 液化延迟有时候精液可能不液化, 这使得精液评估变得困难 在这种情况下, 需要另行处理, 机械混匀或酶消化可能是必要的 1. 一些标本通过加入等体积的生理培养液 ( 如 Dulbecco 磷酸缓冲盐水, 见附录 4,A4.2 节 ), 并且用加样器反复吹打, 可使其液化 2. 精液反复 (6~10 次 ) 缓慢地通过接在注射器上的 18 号钝性针头 ( 内径 0.84mm) 或 19 号针头 ( 内径 0.69mm), 可降低精液的非均匀状态 3. 应用一种广谱蛋白水解酶 (EC ) 菠萝蛋白酶消化, 有助于促使精液液化 ( 方框 2-2)
34 第 2 章标准程序 用 Dulbecco 磷酸缓冲盐水制备 10IU/ml 的菠萝蛋白酶 ( 见附录 4,A4.2 节 ) 菠萝蛋白酶很难溶解, 通过搅拌, 大部分酶应该在 15~20 分钟内溶解 用 10IU/ml 的菠萝蛋白酶液与等体积的精液 (1 + 1) 进行稀释 (1 2), 用移液管吸头的尖部搅拌,37 孵育 10 分钟 在进一步分析之前充分混匀精液 这些处理可能影响精浆的生化 精子活力和精子形态, 使用它们必须作 记录 当计算精子浓度时, 必须考虑 加入菠萝蛋白酶液使精液按 1 2 稀释 精液液化后, 通过轻轻地将精液吸入一支广口径 ( 直径约 1.5mm) 一次性的塑料吸液管, 评估标本的黏稠度, 使精液借助重力滴下, 观察任何拉丝的长度 正常精液形成不连续的小滴从吸液管口滴下 如果黏稠度异常, 液滴会形成超过 2cm 的拉丝 另一种方法是, 将一玻璃棒插入标本, 提起玻璃棒, 观察拉丝长度来评估标本的黏稠度 当拉丝长度超过 2cm 时, 应记录为不正常的黏稠度 与不完全液化的标本相比, 黏稠的精液标本呈现均质黏性, 并且其黏稠度不随时间而变化 通过标本的弹性可以识别高黏稠度, 当尝试使用吸液管吸取高黏稠度标本时, 它会紧紧黏住吸液管 降低黏稠度的方法与延迟液化的处理方法相同 ( 见 节 ) 高黏稠度干扰精子活力 精子浓度 精子表面抗体和生化标志物的检测 正常液化精液标本呈现均质性 灰白色的外观 如果精子浓度非常低, 精液 可显得透明些 ; 精液颜色也可以不同, 例如 : 有红细胞时 ( 血精 ) 精液呈红褐色, 黄 疸病人的精液和服用维生素或药物者的精液可呈黄色 精液的体积主要由精囊腺和前列腺的分泌液构成, 包括少量来自尿道球腺和 附睾分泌的液体 由于要计算精液中的精子总数和非精子细胞, 所以, 精确测量 精液体积是任何精液评价的基础 最好通过称重收集量器中的精液来测量精液体积 用一个预先称重 干净 处理过的容器收集精液 称重盛有精液的容器 减去容器的重量 由精液的重量计算出精液体积, 假设精液的密度为 1g/ml(Auger et al.,1995) [ 精液密度的变化范围在 1.043~1.102g/ml(Huggins et al.,1942;brazil et al., 2004a;Cooper et al.,2007)]
35 12 第一部分精液分析 空的标本容器重量可能不同, 因此每个容器需预先单独称重 将容器交 给受检者前, 应预先在容器上标记重量 使用永久性标记笔标记在容器上或标 签上 如果用标签记录重量, 应该在称量空容器前贴好它 精液体积也可以直接测量 将精液标本直接采集到一个改良的广口带刻度玻璃量杯中, 现在市场上可购 到这种量杯 直接从刻度上读取精液体积 ( 精确到 0.1ml) 不推荐将精液从量杯中吸到移液管和注射器 或倒入量筒中来测量体积, 因为不能完全回收精液, 因此会低估精液体积 丢失的体积可以在 0.3~0.9ml 之间 (Brazil et al.,2004a;iwamoto et al.,2006;cooper et al.,2007) 1 精液体积小是射精管阻塞或先天性双侧输精管缺如 (CBAVD)(de la Taille et al.,1998;daudin et al.,2000;von Eckardstein et al.,2000;weiske et al., 2000), 以及精囊腺发育不良的特征 2 精液体积小也可能是采集问题 ( 丢失了一部分射精液 ) 不完全逆行射 精, 或者雄激素缺乏所致 3 精液体积大可能反映附性腺活动性炎症情况下的活跃分泌 参考值下限 精液体积参考值下限是 1.5ml[ 第 5 个百分位数,95% 的可信限 (CI),1.4~1.7] ph 精液 ph 值反映了不同附性腺分泌液 ph 值之间的平衡, 主要是碱性的精囊 腺分泌液和酸性的前列腺分泌液之间的平衡 ph 值应在液化后的同一时间测量, 最好在 30 分钟后, 但无论如何要在射精后 1 小时内测量, 因为精液 ph 值会受射 精后精液中 CO 2 逸出的影响 对于正常精液标本, 应该使用测量范围在 6.0~10.0 的 ph 试纸 充分混匀精液标本 ( 方框 2-3) 在 ph 试纸上均匀地涂上一滴精液 等待浸渍区的颜色变得均匀 (< 30 秒 ) 与标准条带进行颜色对比, 读出 ph 值 应用已知的标准品来检验 ph 试纸的精确性 对于黏稠的标本, 使用为测量黏稠液体而设计的 ph 计来测量少量精液的 ph 值 (Haugen & Grotmol,1998)
36 第 2 章标准程序 参考值目前来自有生育力男性精液的 ph 参考值很少 在获得更多数据之前, 本手册仍采用将 ph 7.2 作为临界值的一致观点 1 如果精液 ph 值 < 7.0, 并伴随体积小和精子数量少, 可能存在射精管阻塞或先天性双侧输精管缺如 (de la Taille et al.,1998;daudin et al.,2000;von Eckardstein et al.,2000;weiske et al.,2000), 以及精囊腺发育不良 2 由于精液的自然缓冲能力降低, 精液的 ph 值会随时间延长而升高, 因 此升高的 ph 值不能提供有用的临床信息 2.4 建议使用相差显微镜进行新鲜精液未染色制片的所有检查 ( 如何使用显微镜 见附录 3) 精液标本的显微镜初步检查是在总倍数为 100 倍 ( 也就是 10 倍的物 镜和 10 倍的目镜 ) 视野下观察标本制片的情况 显微镜初检可以对标本作一般观察, 能够显示 : 黏液丝的形成 ; 精子的聚集或凝集 ; 除精子外存在的细胞, 例如上皮细胞 圆细胞 ( 白细胞和不成熟生精细胞 ) 和单独的精子头或尾 然后, 标本制片应在 200 倍或 400 倍的总放大倍数下观察 (20 倍或 40 倍物镜 配上 10 倍目镜 ) 这样可以用于 : 评估精子活力 ( 见 2.5 节 ); 确定用于精确测量精子数目所需的精液稀释倍数 ( 见 2.8 节 ) 精液的液化状态使得为精液分析而进行代表性取样成为问题 如果精液混 匀不充分, 两次分别取样的精子的活力 存活率 浓度和形态学分析结果都可能出 现显著差异 为确实获得可重复的数据, 在取样用于检测之前, 应充分混匀标本 当重复取样的结果一致时才能认可此测定值 应用 Poisson 分布来确定重复取样 精子计数结果之间的一致性 ( 方框 2-7, 表 2-4 和 2-5), 应用二项分布确定百分率 ( 方框 2-5 和 2-6, 表 2-1) 充分混匀精液标本 ( 方框 2-3) 混匀后立即取精液样本, 使精子没有从悬浮液沉降的时间 在取出重复精液样本前, 再次充分混匀精液 取出的精液体积和盖玻片的规格必须标准化, 以便于在固定深度约 20µm( 方
37 14 第一部分精液分析 框 2-4) 的制片上进行精液分析, 这样精子可以自由泳动 : 取一定标准体积的精液, 例如,10µl, 置于洁净的载玻片上 盖上盖玻片, 例如,10µl 精液采用 22mm 22mm 的盖玻片, 形成一约 20µm 深的池 ( 方框 2-4) 盖玻片的重量使标本散开 小心尽量避免在盖玻片和载玻片之间形成气泡 一旦制片内精液不再漂移, 立即评估此新鲜制备的湿片 2-3 在取精液样本用于评估前, 要在原取精容器中充分混匀精液, 但不要太剧烈振荡而产生气泡 可将标本吸入大口径 ( 直径约 1.5mm) 的一次性塑料吸管 ( 如有必要使用无菌的 ) 中 10 次, 充分混匀精液 不要在旋涡振荡器上高速混匀, 这样会损伤精子 2-4 湿片的深度 (D,µm) 为取样的体积 (V,µl = mm 3 ) 除以它扩散的面积 (A,mm 2 ):D = V/A 因此, 取 10µl 体积的精液置于一张洁净的载玻片上, 将 22mm 22mm 的盖玻片 ( 面积为 484mm 2 ) 覆盖其上, 形成一个深度为 20.7µm 的池 ;18mm 18mm 的盖玻片 ( 面积为 324mm 2 ) 覆盖在 6.5µl 体积的标本上, 形成一个深度为 20.1µm 的池 ;21mm 26mm 的盖玻片 ( 面积为 546mm 2 ) 覆盖在 11µl 的标本上, 形成一个深度为 20.1µm 的池 偶尔需要深些的池 : 用 24mm 50mm 的盖玻片 ( 面积为 1200mm 2 ) 覆盖 40µl 的样本, 形成一个深度为 33.3µm 的池 1 深度 < 20µm 的池限制精子的螺旋式运动 (Le Lannou et al.,1992;kraemer et al.,1998) 2 如果池太深, 精子游进和游出焦点视野, 难以检测精子 3 如果每个视野中精子的数量相差显著, 那么标本是不均质的 在这种情况下, 应再一次充分混匀精液标本 ( 方框 2-3), 按上述方法制备新的湿片 4 缺乏均质性也可能是由于异常的黏稠度 异常的液化 ( 见 节 ) 精子聚集 ( 见 节 ) 或精子凝集所致 ( 见 节 ) 不活动精子之间 活动精子与黏液丝 非精子细胞或细胞碎片之间黏附在一起, 为非特异性聚集 ( 图 2-2), 这种情况应如实记录 2-2 精液中精子的非特异性聚集精子与上皮细胞 (a), 与细胞碎片 (b), 与精子 (c,d) 的聚集 (Micrographs courtesy of C Brazil)
38 第 2 章标准程序 精子凝集特指活动精子以头对头 尾对尾或混合型相互黏附在一起的现象 精子经常呈现活跃的快速摆动方式, 但是有时精子凝集太严重, 以致其活动受制 约 应该记录所有活动精子通过头 尾 中段黏附在一起的情况 应当记录主要的凝集类型 [ 反映凝集的程度 (1~4 级 ) 和黏附部位 (A~E 级 )] (Rose et al.,1976)( 图 2-3): 1 级 : 零散的每个凝集 < 10 个精子, 有很多自由活动精子 2 级 : 中等的每个凝集 < 10~50 个精子, 存在自由活动精子 2-3 精子不同凝集程度的示意图 [Reproduced from Rose et al.(1976)by permission of Wiley-Blackwell]
39 16 第一部分精液分析 3 级 : 大量的每个凝集 > 50 个精子, 仍有一些自由活动精子 4 级 : 全部的所有的精子凝集, 数个凝集又粘连在一起 活动精子黏附细胞或细胞碎片, 或不活动精子之间相互黏附 ( 聚集 ), 不应 该记为凝集 1 存在凝集不足以推断免疫因素导致不育, 但暗示存在抗精子抗体 ; 需要 做进一步的实验证明 ( 见 2.20 节 ) 2 严重的凝集影响精子活力和浓度的评估 精液中含有非精子细胞, 其中一些细胞可能有临床意义 非精子细胞包括来源于泌尿生殖道的上皮细胞, 以及白细胞和不成熟的生精细胞, 后两者统称为 圆细胞 (Johanisson et al.,2000) 在放大 1000 倍的显微镜视野下观察染色涂片, 可以识别这些细胞 ( 见 2.12 节,2.19 节, 彩图 13 和彩图 14) 通过检测过氧化物酶活性 ( 见 2.18 节 ) 或 CD45 抗原 ( 见 3.2 节 ), 可以更精确地鉴别和定量这些细胞 可以像精子那样, 从湿片上评估这些细胞的浓度 ( 见 节 ), 或通过从染色涂片上检测到的这些细胞与精子数目的比率和精子浓度来评估 ( 见 节 ) 2.5 前向精子活动力的程度 ( 见 节 ) 与妊娠率相关 (Jouannet et al.,1988; Larsen et al.,2000;zinaman et al.,2000) 涉及计算机辅助分析 (CASA) 检测精子 活力的方法见 节的描述 标本液化后, 应尽快检测精子活力, 最好在 30 分钟内, 任何情况下都应在射 精后 1 小时内检测, 以防止脱水 ph 值或温度变化对精子活力的有害影响 充分混匀精液标本 ( 方框 2-3) 混匀后立即取精液样本, 使精子没有从悬浮液沉降的时间 在取出重复精液样本前, 再次充分混匀精液 对于每份重复样本, 制备一个大约 20µm 深的湿片 ( 见 节 ) 等待湿片内精液样本停止漂移 ( 在 60 秒内 ) 在 200 或 400 倍数的相差显微镜视野下观察玻片 为评估不同精子活力级别百分率, 每份重复样本约计数 200 个精子 比较两个重复样本值, 核查两值的接近程度是否可以接受 如果可以接受, 计算百分率 ; 否则, 制备新样本再作检测 1 应在室温或带有加热 37 载物台的显微镜下进行检查, 每个实验室的 操作程序需标准化 例如在 37 评估精子的活力, 这个标本应该在同样温度下 孵育, 并使用预热的载玻片和盖玻片制备样本
40 第 2 章标准程序 17 2 推荐使用带有网线和网格的目镜, 以限制观察区域 ( 图 2-4a) 这样使得两次评估时观察的是载玻片上相同的区域 首先评估前向运动的精子, 然后是非前向运动精子和不活动精子 ( 见 节 ) 对观察区域作了限制, 因此也限制了区域内所检测的精子数目, 这样可以保证制片的几个区域内精子活力得以检测 推荐使用一个评估精子活力等级的简单系统, 将精子分类为前向运动 非前 向运动和不活动的精子 每个精子的活力按以下分级 : 前向运动 (PR): 精子主动地呈直线或沿一大圆周运动, 不管其速度如何 非前向运动 (NP): 所有其他非前向运动的形式, 如以小圆周泳动, 尾部动力 几乎不能驱使头部移动, 或者只能观察到尾部摆动 不活动 (IM): 没有运动 1 本手册以前版本推荐, 前向运动精子应分类为快速和慢速运动,37 时 速度 > 25µm/s 界定为 a 级 然而, 技术人员很难无偏差地精确界定前向运动 (Cooper & Yeung,2006) 2 当讨论精子活力时, 重要的是确定总的精子活动率 (PR + NP) 或前向运 动 (PR) 的精子活动率 如果在 37 评估精子活力, 保温板应预热 10 分钟, 使温度保持恒定 制备一个 20µm 深的湿片 ( 见 节 ) 用 200 或 400 倍的相差显微镜观察载玻片 等待湿片内精液样本停止漂移 为防止干燥影响观察精子活力的效果, 应在距离盖玻片边缘至少 5mm 的区 域观察精子 ( 图 2-4b) 按顺序仔细观察玻片, 避免重复观察相同的区域 经常更换视野 避免根据 看见一定数量的活动精子来选择视野 ( 应随机选择视野 ) 在一定区域, 应随机立即开始评估计数 不要等精子游入观察区域或网格中 才开始评估 在视野中界定的区域内评估所有精子的活力, 应用带有网格的目镜很容易做 到 ( 图 2-4a) 根据精子浓度选择部分视野或网格评估, 例如, 如果精子浓度 高, 则仅在网格的最上一行评估 ; 如果精子浓度低, 则评估整个网格 快速浏览和计数, 以避免高估活动精子的数量 需做的是立即计数网格内的 所有活动精子 避免既计数先前存在的精子, 又计数了在评估过程中游入网 格的精子, 这会使结果偏于活动精子而发生偏差 开始先仔细观察网格区, 计数前向运动精子 ( 见 节 ) 在相同的网格部
41 18 第一部分精液分析 2-4 辅助评估精子活力 (a) 使用带网格的目镜, 更易于评估活动和不活动精子 ;(b) 顺序地选择评估精子活力的区域, 至少距离盖玻片边缘 5mm 分, 接下来计数非前向运动精子, 最后计数不活动的精子 根据经验, 可以一 次计数 3 类精子的运动, 并且可以观察更大区域的网格 借助实验室计数器, 记录每种活力级别的精子数目 为获得一个可接受的低取样误差, 在总共至少 5 个视野中, 每份重复样本至 少评估 200 个精子 ( 方框 2-5) 在重复的湿片中, 计算最常见的活力级别 ( 前向运动 非前向运动或不活动 ) 的两个百分率之间的平均百分率和差异 从表 2-1 和图 A7-2 附录 7 中确定差异的可接受性 ( 每个数值显示两个百分 率之间的最大差异, 此差异为预期在 95% 样本中仅由取样误差所造成 ) 如果百分率之间的差异可以接受, 报告每类活力级别 ( 前向运动 非前向运动 或不活动 ) 的百分数 如果差异太大, 从精液样本中重新取两份新样本, 制备 两张新的湿片, 重新评估精子活力 ( 方框 2-6) 以最接近的整数报告每种活力级别的平均百分数 1 仅评估完整精子的活力 ( 完整精子定义为有头部和尾部 ; 见 节 ), 因为 评估精子浓度只计数完整的精子, 不计数活动的大头针状精子 (motile pinheads) 2 如果精子分两个阶段评定 ( 例如先评定前向运动, 再评定同区域的非前向运动和不活动的精子 ), 在评定完那个区域所有活力级别的精子之前, 已经数到 200 个精子, 则要继续评定超过 200 个精子, 直到评定完所有活力级别的精子, 以避免先评定的活力级别发生偏差 3 高估精子活力是很常见的, 但是可以通过颠倒分析次序 ( 先计数非前向 运动和不活动的精子 ) 来避免, 使用带有网格的目镜, 有意识地尽可能避免各种 潜在的偏差 ( 见 节 ) 4 对一些不常见的精液标本, 例如非均质的精液标本, 甚至取第三批重复 样本仍不能获得可接受的差异 在这种情况下, 计算所有重复样本的平均值, 并记录在报告中
42 第 2 章标准程序 如何确定所评估的百分率, 不仅取决于计数到的精子数量 (N), 还取决于一个真实的 但是未知的百分数 (p)( 二项分布 ) 如果百分率在 20%~80%, 大概的标准误 (SE) 是 [(p(100 p)]/n 超出这个范围, 更合适的方法是使用角转换 ( 反正弦平方根 ),z = sin 1 (p/100), 带有一个 1/(2 N) 弦度的标准差, 这仅依赖于所计数的精子数量, 不是真正的百分率 2-1 从重复计数 200 个精子 ( 总共计数 400 个精子 ) 确定所给出平均值的两个百分率之间的可接受差异 平均值 % 可接受差异 * 平均值 % 可接受差异 * ~ ~ ~88 7 3~4 4 89~92 6 5~7 5 93~95 5 8~ ~ ~ ~ ~ ~65 10 * 基于四舍五入取整数的 95% 可信区间 2-6 百分率应调整为最接近的整数 习惯是调整 0.5% 至最接近的偶数, 例如 32.5% 调降至 32%, 而 3.5% 调升至 4% 注意所调的百分率不能加升至 100% 对一个给出的平均百分率, 如果重复百分率的差异小于或等于表 2-1 中列出的相对应的差异, 那么评估是可接受的, 这个平均值可以作为结果 大于可接受差异表示存在计数错误或者取样误差, 或者精子未充分混匀, 以及在计数池或载玻片上精子未随机分布 当两个百分率间的差异大于可接受差异, 放弃第一次的两个值并重新评估 ( 不要计数第三个样本, 取 3 个值的平均值, 或者取 3 个值中最相近的两个值的平均值 ) 对于评估精子活力, 或单独用伊红评估存活率, 或用低渗膨胀试验 (HOS) 评估存活率, 要从精液中重新取样来制备新鲜的重复样本 对于评估精子形态学和用伊红 - 苯胺黑涂片评估精子存活率, 要重复取样再次评价玻片 用 95% 可信区间的临界值, 大约 5% 的重复样本有可能超出限值 ( 见附录 7,A7.3 节 ) 可以通过计算机计算出精确的二项分布的可信限, 本手册在图和表中提供了这些数据, 用以评估重复样本的一致性 重复计数 200 个精子评估精子活力的结果为 : 前向运动是 30% 和 50%; 非前向运动是 5% 和 15%; 不活动的是 65% 和 35% 最常见的活力级别是不活
43 20 第一部分精液分析动精子, 平均值为 50%, 差异为 30% 从表 2-1 中看出, 平均值为 50% 时, 随机差异的上限是 10% 由于得到的差异超过 10%, 应摒弃结果, 并重新制备两张玻片, 再次评估精子活力 2 重复计数 200 个精子评估精子活力的结果为 : 前向运动是 37% 和 28%; 非前向运动是 3% 和 6%; 不活动精子是 60% 和 66% 最常见的活力级别是不活动精子, 平均值为 63%, 差异为 6% 从表 2-1 中看出, 平均值是 63% 时, 随机误差的上限是 10% 由于得到的差异小于 10%, 结果是可以接受的, 报告平均值为前向运动 32%, 非前向运动是 4%, 不活动的是 63% 精子总活力 (PR + NP) 的参考值下限是 40%( 第 5 个百分位数,95% 可信区间是 38~42) 前向运动精子 (PR) 的参考值下限是 32%( 第 5 个百分位数,95% 可信区间为 31~34) 精液中前向运动精子的总数具有生物学意义, 此数值用精液中精子总数乘以前向运动精子百分率得出 ( 见 节 ) 2.6 精子的存活率通过检测精子膜的完整性来评价, 可以常规检测所有标本的存活率, 但对于前向运动精子少于 40% 的精液标本特别重要 这个试验能够核查活力评估的准确性, 因为死精子的百分数不应超过 ( 在取样误差中 ) 不活动精子的百分数 活精子百分率正常是超过活动精子百分率的 通过染料拒染法或低渗膨胀试验来鉴别细胞膜完整的精子, 从而得出活精子的百分率 染料拒染法基于损伤的细胞膜, 例如在非活的 ( 死 ) 细胞上的膜, 允许非透过膜性染料进入膜内染色 低渗膨胀试验假设只有细胞膜完整的细胞 ( 活细胞 ) 能够在低渗溶液中发生膨胀 每种试验的例子如下所述 : 精液标本一旦液化应该立即检测精子存活率, 最好在 30 分钟内, 任何情况下不能超过 1 小时, 以防止脱水或温度变化对精子存活率的有害影响 1 阐明不活动精子是活精子还是死精子有重要的临床意义 同一份精液标本的存活率结果应该会同活力结果一起评价 2 活的但不活动的精子占有很大比例可能提示精子鞭毛有结构缺陷 (Chemes & Rawe,2003); 高百分率的不活动精子和死精子 ( 死精症 ) 可能提示附 睾病理改变 (Wilton et al.,1988;correa-perez et al.,2004) 使用苯胺黑一步染色技术, 可以提高背景和与精子头之间的对比度, 使精子
44 第 2 章标准程序 21 头更易辨别 也可以保存玻片用于再次评估和作为质量控制用途 (Björndahl et al.,2003) 试剂准备 伊红 Y: 将 0.67g 伊红 Y( 颜色指数 45380) 和 0.9g NaCl 溶解在 100ml 纯水中, 稍微加热 伊红 - 苯胺黑 : 将 10g 苯胺黑 ( 颜色指数 50420) 加入 100ml 伊红 Y 溶液中 将悬液煮沸, 然后冷却至室温 用滤纸 ( 例如 90g/m 2 ) 过滤溶液, 除去残渣和凝胶状沉淀物, 储存在暗色的密封玻璃瓶中 步骤 充分混匀精液标本 ( 方框 2-3) 取 50µl 精液, 与等体积的伊红 - 苯胺黑悬液混匀, 例如, 在一瓷制点样板的凹井内 (a porcelain spot plate well) 或试管中混匀, 等待 30 秒 重复取样前, 再次混匀精液标本, 取样与伊红 - 苯胺黑液混合, 按上述步骤 2 处理 用每个悬液, 在载玻片上制成涂片 ( 见 节 ), 空气中干燥 干燥后立即检查, 或使用非水性永久封固液封片后, 以后再观察 用亮视野显微镜在 1000 倍油镜下检查每张玻片 借助实验室计数器, 计数染色精子 ( 死精子 ) 和非染色精子 ( 活精子 ) 每个重复样本评估 200 个精子, 以达到可接受的低取样误差 ( 方框 2-5) 计算重复玻片的两个活精子百分率的平均值和差异 从表 2-1 或图 A7-2 附录 7 中确定差异的可接受性 ( 每个数值显示两个百分率之间的最大差异, 此差异为预期在 95% 样本中仅由取样误差所造成 ) 如果两个百分率之间的差异是可接受的, 报告活精子的平均百分率 如果差异太大, 重新两次精液取样制备两张新鲜玻片, 再次评估玻片 ( 方框 2-6) 以最接近的整数报告活精子的平均百分率 评定 苯胺黑形成了黑色背景, 使淡染的精子更易分辨 用亮视野显微镜观察, 活精子头部呈白色, 死精子头部呈红色或暗粉红色 ( 图 2-5) 头部呈淡粉红色的精子认为是活精子 如果染色只限于颈部区域, 头部的其余区域未染色, 这种情况考虑是 颈部膜渗漏, 这不是精子死亡和整个细胞膜破裂的征象信号 这些精子应被评估为活精子 参考值下限 精子存活率 ( 膜完整的精子 ) 的参考值下限是 58%( 第 5 个百分位数,95% 可 信区间为 55~63)
45 22 第一部分精液分析 2-5 在亮视野显微镜下观察伊红 - 苯胺黑涂片精子头部染成红色 (D1) 或暗粉红色 (D2) 的认为是死精子 ( 膜损伤 ), 而精子头部呈白色 (L) 或浅粉红色的认为是活精子 ( 膜完整 )(Micrograph courtesy of TG Cooper) 精液中膜完整精子的总数具有生物学意义, 此数值用精液中精子总数乘 以膜完整精子百分率得出 ( 见 节 ) 这种方法简单和快速, 但湿片不能保存作为质量控制用途 试剂准备 NaCl,0.9%(w/v): 将 0.9g NaCl 溶于 100ml 纯水中 伊红 Y,0.5%(w/v): 将 0.5g 伊红 Y(C.I.45380) 溶于 100ml 0.9% NaCl 中 一些商品化伊红溶液是低渗水溶液, 会使精子受到低渗压力, 从而得出 假阳性结果 (Björndahl et al.,2004) 如果使用这样的溶液, 需添加 0.9g NaCl 至 100ml 溶液中, 以提高溶液的渗透压 步骤 充分混匀精液标本 ( 方框 2-3) 取 5µl 精液和 5µl 伊红溶液置于载玻片上, 用移液器吸头混合 搅拌玻片上的样本 覆盖 22mm 22mm 盖玻片, 静止 30 秒 再次混匀精液标本, 取一份重复样本, 与伊红溶液混匀, 如上述步骤 2 和 3 处理样本
46 第 2 章标准程序 检查每张玻片, 最好用负相差显微镜在 200 倍或 400 倍下观察 ( 使用正相差显微镜很难分辨淡粉红色的精子头部 ) 借助实验室计数器, 计数染色精子 ( 死精子 ) 和非染色精子 ( 活精子 ) 的数目 每份重复样本评估 200 个精子, 以达到可接受的低取样误差 ( 方框 2-5) 计算重复玻片的两个活精子百分率的平均值和差异 从表 2-1 或图 A7-2 附录 7 中确定差异的可接受性 ( 每个数值显示两个百分率之间的最大差异, 此差异为预期在 95% 样本中仅由取样误差所造成 ) 如果两个百分率之间的差异是可接受的, 报告活精子的平均百分率 如果差异太大, 重新两次精液取样制备两张新鲜玻片, 再次评估玻片 ( 方框 2-6) 以最接近的整数报告活精子的平均百分率 评定 活精子头部呈白色和淡粉红色, 死精子头部呈红色和暗粉红色 如果染色只限于颈部区域, 头部的其余区域未染色, 这种情况考虑是 颈部膜渗漏, 这不是精子死亡和整个细胞膜破裂的征象 这些精子应被评估为活精子 如果很难分辨染成淡粉红色的精子头部, 使用苯胺黑以提高背景的对比度 ( 见 节 ) 参考值下限精子存活率 ( 膜完整的精子 ) 的参考值下限是 58%( 第 5 个百分位数,95% 可信区间为 55~63) 精液中膜完整精子的总数具有生物学意义, 此数值用精液中精子总数乘以膜完整精子百分率得出 ( 见 节 ) 作为染料拒染法的替代试验, 低渗膨胀试验 (HOS) 可以用来评估精子的存活 率 (Jeyendran et al.,1984) 当必须避免精子染色的时候, 这种方法是有用的, 例 如, 为 ICSI 选择精子的时候 膜完整的精子在低渗溶液中 5 分钟内发生膨胀, 在 30 分钟之内所有尾部的形状是稳定的 (Hossain et al.,1998) 因此, 使用 : 作为常规的诊断, 孵育 30 分钟 ; 但是 当精子处理用于治疗用途时, 孵育 5 分钟 准备试剂 1. 用于诊断目的的膨胀液 :0.735g 枸橼酸钠和 1.351g D- 果糖溶于 100ml 纯 水中 将溶液以 1ml 分装, 冻存于 20 溶液 2. 用于治疗用途的膨胀液 : 按 1 份溶液加 1 份灭菌纯水, 即 1 2 的比例稀释
47 24 第一部分精液分析 步骤 解冻冻存的膨胀液, 使用前充分混匀 取 1ml 膨胀液或 1ml 1 + 1(1 2) 稀释溶液, 置于一支加盖的微量离心管中, 37 温热 5 分钟 充分混匀精液标本 ( 方框 2-3) 取 100μl 精液, 加入膨胀液中 用移液管轻轻地吸进和排出, 加以混匀 在 37 孵育精确 5 分钟或 30 分钟 ( 如上所述 ), 然后取 10µl 加到洁净载玻片上, 覆盖 22mm 22mm 盖玻片 重新混匀精液标本, 取重复样本与膨胀液混合, 如上所述, 孵育并制备另一张重复玻片 使用相差显微镜, 在 200 倍或 400 倍视野下, 检查每张玻片 借助实验室计数器, 计数未膨胀 ( 死的 ) 和膨胀 ( 活的 ) 精子 每份重复样本评估 200 个精子, 以达到可接受的低取样误差 ( 方框 2-5) 计算重复玻片的两个活精子百分率的平均值和差异 从表 2-1 或图 A7-2 附录 7 中确定差异的可接受性 ( 每个值显示两个百分率之间的最大差异, 此差异为预期在 95% 样本中仅由取样误差所造成 ) 如果两个百分率之间的差异是可接受的, 报告活精子的平均百分率 如果差异太大, 重新两次精液取样制备两张新鲜玻片, 再次评估玻片 ( 方框 2-6) 以最接近的整数报告活精子的平均百分率 评定 发生膨胀的精子通过精子形状的改变来辨别, 如显示尾部卷曲 ( 图 2-6) 通过精子尾部卷曲来辨别活精子 ; 评定所有尾部膨胀类型的精子为活精子 2-6 人精子在低渗透压作用下的特征性形态变化的示意图 (a) 未发生改变 ;(b)~(g) 尾部变化的不同类型 灰色区域表示尾部膨胀 [ 图片复制于 Jeyendran RS,Van der Ven HH,Perez-Pelaez M,Crabo BG,Zaneveld LJD(1984)Journal of Reproduction and Fertility,70: Society for Reproduction and Fertility (1984).Reproduced by permission]
48 第 2 章标准程序 参考值下限低渗膨胀试验的参考值与伊红试验的参考值相近 (Carreras et al.,1992) 精子存活率 ( 膜完整的精子 ) 的参考值下限是 58%( 第 5 个百分位数,95% 可信区间为 55~63) 精液中膜完整精子的总数具有生物学意义, 此数值用精液中精子总数乘以膜完整精子百分率得出 ( 见 节 ) 2.7 每次射精的精子总数和精子浓度与妊娠时间 (Slama et al.,2002) 和妊娠率 (WHO,1996;Zinaman et al.,2000) 存在联系, 并且可以预测受孕 (Bonde et al., 1998;Larsen et al.,2000) 精子总数与生殖结局相关的更多数据已被认可 精液的精子总数可以通过精液评估中测定的精子浓度来计算 对于正常射精, 当男性输精管道是畅通的且禁欲时间短的时候, 精液中精子总数与睾丸体积相关 (Handelsman et al.,1984;who,1987;andersen et al.,2000;behre et al.,2000), 因此精子总数可以衡量睾丸产生精子的能力和男性输精管道畅通的程度 精液中精子浓度与受精率和妊娠率相关, 精子浓度受精囊腺和前列腺分泌液量的影响 (Eliasson,1975), 不是衡量睾丸功能的特异性指标 1 术语 精子总数 和 精子浓度 不是同义的 精子浓度指每单位体积精液中的精子数目, 是一个射出精子数目与稀释精子液体体积的函数 精子总数指一次完整射精的精液中的精子总数, 由精子浓度乘以精液体积得出 2 概括而言, 精子总数反映睾丸的精子产生能力, 但这一概念不适用于脊 髓损伤男性采用电刺激诱导的射精, 或者雄激素缺乏 长期禁欲后采集的精液 标本或部分或不完全逆行射精的标本 3 当意指精子浓度 (sperm concentration)( 每单位体积数目 ) 时, 不应使用 术语 精子密度 sperm density ( 每单位体积的质量 ) 确定精子数量由以下步骤组成 ( 具体的描述见以下章节 ): 将充分混匀 未稀释的液化精液滴加在载玻片上, 盖上盖玻片进行检查, 确定 合适的稀释度和使用合适的计数板 ( 见 节 ) 这是评估精子活力常用的 湿片制备程序 ( 见 节 ) 混匀精液, 准备含有固定液的稀释液 在血细胞计数板的计数池上加样, 在一个湿盒中使精子沉降 在 10~15 分钟内评估精液样本 ( 过长时间, 水分蒸发后对计数池内精子的位 置会有显著影响 ) 每份重复样本计数至少 200 个精子
49 26 第一部分精液分析 比较两份重复样本的数值, 看其差异的接近程度是否可以接受 如果可以接 受, 则计算数据 ; 如果不能接受, 制备新的稀释样本 计算每毫升精液中的精子浓度 计算每次射精的精子总数 推荐使用 100µm 深的血细胞计数板 在这里本手册给出了改良 Neubauer 血 细胞计数板的稀释系数 另外可以使用其他深度的血细胞计数板, 但它们有不同 的体积和网格类型, 计算时需要不同的系数 测定精子浓度的一次性计数板有商 品化产品 (Seaman et al.,1996;mahmoud et al.,1997;brazil et al.,2004b), 但这类 一次性计数板得出的结果可能与改良的 Neubauer 计数板的结果不同 计数板的 浅池是借助毛细作用填充液体, 由于液体流动可能使精子分布不均匀 (Douglas- Hamilton et al.,2005a,2005b) 这个问题可以纠正 (Douglas-Hamilton et al.,2005a), 但不建议处理 (Björndahl & Barratt,2005) 必须通过校验计数池的尺寸 ( 见附录 7 A7.8 节 ), 与改良的 Neubauer 血细胞计数板方法的结果加以比较, 来确定这些 替代计数池的有效性, 以获得外部质量控制显示的满意结果 为精确评估低精子 浓度, 有必要使用大体积计数板 ( 见 节 ) Neubauer 改良 Neubauer 血细胞计数板有两个独立的计数池, 每个计数池有一个刻在 玻璃表面的 3mm 3mm 微小网格 用均一厚度的盖玻片 ( 厚度数 4,0.44mm) 覆 盖在网格上, 由计数池突起 0.1mm 的玻璃柱支撑着 每个计数区域划分为 9 个 1mm 1mm 的网格 图 2-7 用数字表示了这些网格 2-7 改良 Neubauer 血细胞计数板所刻划区域表示 : 血细胞计数板的一个计数池上全部 9 个网格 ( 左图 ); 中央网格 ( 第 5 号 ) 有 25 个大方格 ( 中间图 ); 填充样本后计数池的部分显微照片 ( 右图 ), 显示中央 25 个大方格中的一个 ( 中间图画圆圈的方格 ), 用 3 条线作边界, 含有 16 个小方格 (Micrograph courtesy of C Brazil) 每个网格的深度是 100μm, 容积是 100nl 第 号 4 个网格, 每个网 格含有 4 排, 每排 4 个方格, 每个方格容积是 6.25nl; 第 2 8 号 2 个网格含有 4 排, 每排 5 个方格, 每个方格容积是 5nl; 第 4 6 号 2 个网格含有 5 排, 每排 4 个方格,
50 第 2 章标准程序 27 每个方格容积是 5nl; 中央的第 5 号网格含有 5 排, 每排 5 个方格, 每个方格容积 是 4nl( 图 2-7, 中间图 ) 第 5 号网格有 25 个方格, 每个方格分为 16 个更小的方 格 ( 图 2-7, 右图 ) 因此, 第 号网格, 每个网格含有 4 排, 每排容积 是 25nl, 而第 号网格, 每个网格含有 5 排, 每排容积是 20nl 依据稀释倍数和要计数的精子数目, 用计数池不同区域检测精子浓度 对于 (1 20) 和 1 + 4(1 5) 稀释度, 计数第 5 号网格的所有排的精子, 当有必要时 再计数第 4 号和第 6 号网格 ( 见 2.8 节 ) 对于 1 + 1(1 2) 稀释倍数, 为计数 200 个以上精子, 必要时需计数所有 9 个网格 ( 见 节 ) 仅计数完整的精子 ( 带有头部和尾部 ) 是否计数一个精子由精子头部的位置决定 ; 精子尾部的摆放位置不重要 方 格的边界由 3 条线的中间线表示 因此, 如果精子头大部分位于两条内侧线 中间, 计数这条精子, 但如果精子头大部分位于两条外侧线中间, 则不计数这 条精子 ( 图 2-8, 左图 ) 为避免在相邻的方格里计数同一个精子, 精子的头部位于分隔两个相邻方格 的线上, 仅当此线是两条互成直角的分界线的其中一条时, 才应被计数 例 如, 如果精子头部大部分位于下侧分界线或左角分界线, 且这两条线形成一 个 L 形时 ( 图 2-8, 中间图 ), 应该计数这条精子, 但如果精子位于上侧分界线 或右角分界线时, 则不计数 ( 图 2-8, 右图 ) 如果有很多无头精子的尾部 ( 大头针状头 ) 或无尾的精子头, 应在报告中 记录这种情况 如果考虑有必要, 应以评估精子浓度相同的方式 ( 见 2.8 节 ) 检 测它们的浓度, 或者通过染色制片 ( 见 节 ) 来确定它们与精子的相关发 生率 2-8 网格中方格的精子计数三条线的中间线为方格的边界 ( 黑线, 左图 ) 计数中央方格中的所有精子, 也计数头部在两条内侧线之间的精子 ( 白圈 ), 但不计数头位于两条外侧线之间的精子 ( 黑圈 ) 如果精子头大部分位于中间线, 只有这条中间线是方格的下侧线或左侧线 ( 中间图, 白圈 ) 时, 才计数精子 如果精子头大部分位于方格的上侧线或右侧线时, 不计数精子 ( 右图, 黑圈 )(Micrographs courtesy of C Brazil)
51 28 第一部分精液分析 血细胞计数板使用特殊厚度的盖玻片 ( 厚度 4 号,0.44mm) 血细胞计数板和盖玻片使用后, 用水清洗, 并用纸巾擦干, 因为任何干燥的残 渣都可能妨碍加样 轻擦网格表面, 除去先前标本的任何残留精子 在消毒剂中隔夜浸泡可再次使用的计数板和盖玻片 ( 见附录 2,A2.54 节 ), 避 免精液中潜在感染因素的污染 将 50g NaHCO 3 和 10ml 35%(v/v) 甲醛溶液加入 1000ml 纯水中 如果需要, 添加 0.25g 台盼蓝 (C.I. 颜色指数 23859) 或 5ml 饱和 (> 4mg/ml) 龙胆紫 (C.I.42555) 加深背景显示出精子头部 4 保存 如果溶液中形成结晶, 使用前, 用 0.45μm 过滤器过滤 为减少取样误差, 必须计数足够数量的精子 ( 最好至少计数 400 个精子, 每个 重复样本计数大约 200 个精子 )( 方框 2-7 和表 2-2) 2-7 评估精子数的精确性取决于所数的精子数目 在 Poisson 分布中, 计数的标准误 (SE) 是计数 (N) 的平方根 ( N), 一定体积精液中精子数目的 95% 可信区间 (CI) 大约是 N ± 1.96 N( 或 N ± 大约 2 N) 如果计数 100 个精子, 标准误是 10( 100),95% 可信区间是 80~120(100 ± 20) 如果计数 200 个精子, 标准误是 14( 200),95% 可信区间是 172~228(200 ± 28) 如果计数 400 个精子, 标准误是 20( 400),95% 可信区间是 360~440(400 ± 40) 取样误差可以方便地表示为计数的一个百分率 (100 ( N/N)) 这些数值见表 2-2 这些数值只是近似值, 因为围绕估值, 可信区间不总是对称的 根据 Poisson 分布的性质, 计数 400 个精子, 确切的 95% 可信区间是 361~441, 计数 100 个精子的是 81.4~121, 计数 10 个精子的是 4.8~18.4, 计数 1 个精子的是 0.03~5.57, 计数 0 个精子的是 0.00~ 如果计数精子数目太少, 得出的结果将会不可靠 ( 见附录 7,A7.1 节 ), 这将影响到临床的诊断和治疗 ( 见附录 7,A7.2 节 ) 如果精子用于治疗目的和 精子数目少, 出现不确切结果是难以避免的 2 如果精液量小, 并且计数的精子数目少于建议数目, 所获得结果精确性 就会显著降低 如果每个重复样本计数的精子数目 < 200 个, 按照表 2-2 所给 出的值, 报告取样误差
52 第 2 章标准程序 根据计数的精子总数四舍五入的取样误差 (%) 总数 N 取样误差 % 总数 N 取样误差 % 总数 N 取样误差 % 对于精子浓度在一定范围内的标本, 稀释倍数 1 5(1 + 4) 和 1 20(1 + 19) 是 合适的, 这样稀释可使血细胞计数池的 1 个网格或在第 4 5 和 6 号网格中的所有 精子数目达到约 200 个 ( 表 2-3 和方框 2-8) 2-8 Neubauer 如果在最初湿片 4nl 的每高倍镜视野 (HPF) 有 100 个精子 ( 方框 2-9), 从理论上讲, 每 nl 应有 25 个精子 ( 每 μl 有 个精子或每 ml 有 个精子 ) 改良 Neubauer 血细胞计数池的中央网格 ( 第 5 号网格 ) 的容积是 100nl, 该网格内应有 2500 个精子 精液标本以 1 5(1 + 4) 进行稀释, 这样可以降低本底, 并且每个网格的精子数目约有 500 个精子, 这样的精子数目对于达到一个可接受的低取样误差是足够的 如果湿片的每高倍镜视野有 10 个精子, 每 nl 则约有 2.5 个精子, 中央网格内应有 250 个精子 按建议以 1 2(1 + 1) 稀释精液标本后, 可以降低本底, 并且每个网格内约有 125 个精子 ; 这样, 在第 4 5 和 6 号 3 个网格内共有 375 个精子, 可以达到一个可接受的低取样误差 由于计数很少精子且精液体积也并不准确, 所以计算出的精子浓度仅是 粗略估计 在计数池内, 未稀释精液的估测浓度可能是由稀释样本得出浓度的 30%~130% 通过评估未稀释精液标本, 可以获得能准确检测精子浓度的精液标本稀释倍数 这往往通过用于评估精子活力的湿片来确定精液标本所需的稀释倍数 ( 见 节 ) 按照 节描述的方法制备湿片, 观察 1 张制备好的湿片, 计数每高倍镜视野的精子数目 (200 倍或 400 倍 )
53 30 第一部分精液分析 在 200 倍和 400 倍高倍镜下, 每高倍镜视野下的容积分别约为 16nl 和 4nl( 方 框 2-9) 如果在高倍镜下观察到精子, 计数精子, 依据表 2-3 确定所需的稀释倍数, 然 后按照 节进行操作 如果在高倍镜下未观察到精子, 检查另一张重复湿片 在第 2 张湿片上, 如 果仍然没有观察到精子, 则按照 2.9 节进行操作 µm 每个显微镜视野下精液体积主要取决于视野面积 (πr 2,π 约为 3.142,r 是显微视野的半径 ) 和计数池的深度 ( 湿片中这个深度为 20.7µm) 显微视野的直径可以用千分尺测量, 或者用目镜孔径的直径除以物镜放大倍数得出 如果显微镜物镜为 40 倍,10 倍目镜孔径为 20mm, 显微视野直径约为 500µm(20mm/40) 在这种情况下,r = 250µm,r² = µm 2,πr² = µm 2, 精液体积约为 µm 3 或约 4nl 如果显微镜物镜为 20 倍,10 倍目镜孔径为 20mm 目镜, 每个视野直径约为 1000µm (20mm/20) 在这种情况下,r = 500µm,r 2 = µm²,πr 2 = µm², 精液体积约为 µm 3 或约 16nl 2-3 精液标本所需的稀释倍数, 如何进行稀释, 使用的计数板和可能评估的区域 每 400 倍视野下精子数目 每 200 倍视野下精子数目 需稀释倍数 精液量 固定液 µl µl 计数池 > 101 > (1 + 19) 改良 Neubauer 血细 胞计数板 16~100 64~ (1 + 4) 改良 Neubauer 血细 胞计数板 2~15 8~60 1 2(1 + 1) 改良 Neubauer 血细 胞计数板 < 2 < 8 1 2(1 + 1) 改良 Neubauer 血细 胞计数板或大容积 的计数池 计数区域 第 网格 第 网格 第 网格 所有 9 个网格或整张玻片 1 白细胞加样器和自动加样器都是依靠空气置换加样的, 所以对于黏稠 精液进行定量稀释是不够准确的 ; 建议使用正向置换式移液器 2 用于诊断目的, 对于待分析的精液标本, 取样体积应不少于 50µl, 以避 免体积太小所带来的加样误差 3 如果按照推荐的倍数稀释后, 每个显微镜视野中精子数目太少, 则应降 低稀释倍数再作稀释, 制备另一张湿片 如果按照推荐的倍数进行稀释后, 每 显微镜视野中有很多精子重叠, 则应增大稀释倍数再作稀释, 制备另一张湿片 4 如果稀释倍数 1 20(1 + 19) 不合适, 使用稀释倍数为 1 50(1 + 49)
54 第 2 章标准程序 31 1 如果最初湿片中精子数目少 ( 每 400 倍高倍镜视野 < 4 个 : 约为 /ml), 那就可能得不到准确的精子数目 ( 见 2.10 节 ) 2 精子浓度低时 ( 每 400 倍高倍镜视野 < 2 个 : 约 < /ml), 为了准 确评估, 建议对改良 Neubauer 血细胞计数池的所有 9 个网格进行计数 ( 见 节 ), 或者使用带有荧光显示的一次性大容量积计数池进行计数 ( 见 节 ) 通过向血细胞计数板上吹气, 使其表面达到轻微湿润状态 将盖玻片紧压向计数池的支柱, 确保盖玻片紧贴计数池 以两层玻璃表面之间 的彩虹 (multiple Newton s rings) 证实盖玻片的正确位置 观察到的线条越多, 则盖玻片盖得越好 ; 如果仅有 1 或 2 条线条, 则提示计数池深度可能存在问题 使用正向置换式移液器将适量的固定液 ( 表 2-3) 加入两个稀释小瓶 充分混匀精液标本 ( 方框 2-3) 混匀后立即吸出适量的精液标本, 使精子没有在悬浮液里沉降的时间 ( 表 2-3) 擦去移液器吸头外残留的精液, 注意不要接触移液器吸头的开口处 将精液移到固定液里, 并通过抽吸 吹打固定液, 冲洗移液器吸头 再次充分混匀精液, 并按照以上步骤制备第 2 个重复稀释样本 以最快速度涡旋混匀第 1 个精液稀释样本 10 秒钟 并立即取出约 10µl 固定 混悬液, 以避免精子沉降 将移液器吸头小心地接触其中一个计数池 V 形槽的下缘 缓慢按下移液器的活塞, 利用毛细作用使精液填满计数池 在填充过程中, 不应使盖玻片移动, 计数池不能填充得太满 ( 太满时, 可见盖玻片移动 ), 也不 能使计数池填充不足 ( 填充不足时, 空气占据计数池的一部分区域 ) 如上所述, 充分混匀第 2 个精液稀释液, 并立即再取 10µl 样本 按上述步骤, 再填充血细胞计数板的第 2 个计数池 室温下, 将血细胞计数板水平放在湿盒内至少 4 分钟, 以防止干片 ( 例如放在 有盖的培养皿内的浸透水的滤纸上 ) 在此时间内, 已制动的精子会沉降到 网格上 1 一些计数池具有磨砂玻璃柱, 在这种情况下, 就见不到 Newton 环 在每个磨砂玻璃柱上加上 1.5µl 水, 可使盖玻片保持在位置上 (Brazil et al., 2004a), 小心不要使水进入计数区域 2 使用血细胞计数板夹子可以使盖玻片处于合适位置, 从而确保计数池 深度一致 (Christensen et al.,2005) 3 对于非常黏稠的精液标本, 如果混匀步骤拖后延迟了 5~10 秒, 则稀释 液内精液可能会凝集 在这种情况下, 把精液加入稀释液后立即涡旋混匀稀释 样本 10 秒钟
55 32 第一部分精液分析 应该评估血细胞计数板的两个计数池内的精子数目 如果两个计数池得出 的数值十分一致, 可以认为取出的样本可以代表精液标本 ( 见 节 ) 在 200 倍或 400 倍的相差显微镜下, 检测血细胞计数板 每个重复标本至少计数 200 个精子, 以达到可接受的低取样误差 ( 方框 2-7 和 表 2-2) 首先评估改良 Neubauer 血细胞计数板一侧计数池的中央网格 ( 图 2-7, 第 5 号网格 ), 逐排计数精子 继续计数, 直到至少数到 200 个精子, 并且数完完整的一排 (5 个格 ) 必须 计数完整一排 ; 不要在一排的中间停住 如果在中央网格的 5 排中计数不到 200 个精子, 继续计数两个相邻网格中每排内的精子 (4 个大方格 )( 图 2-7 中 的第 4 和 6 号网格 ) 计数到至少 200 个精子时, 记下所评估的排数, 并在血细胞计数板的另一个 计数池中计数相同的排数 借助实验室的计数器记录, 计数精子数目和记录排数 转到血细胞计数板第 2 个计数池, 并计数与第 1 个重复样本的相同排数 ( 相 同体积 ), 即使这样计数不到 200 个精子 计算两个数值的总数和差异 根据表 2-4 图 A7-1 和附录 7 确定可接受的差异 ( 每个值显示两次计数之间 的最大差异, 此差异为预期在 95% 样本中仅由取样误差所造成 ) 如果这种差异在可以接受范围内, 计算精子浓度 ( 见 节 ) 如果这种差异 太高, 如上所述, 制备两个新的稀释样本 ( 见 节 ), 并重新计数 ( 方框 2-10) 以两位有效数字, 报告平均精子浓度 计算每次射精的精子总数 ( 见 节 ) 2-4 对于一定总数的两个重复计数可接受的差异 总数 * 可接受差异 总数 * 可接受差异 144~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ * 基于四舍五入取整数的 95% 可信区间
56 第 2 章标准程序 33 1 即使在第 4 5 和 6 号网格中计数不到 200 个精子, 也不能继续计数第 或 9 号网格中的精子, 因为这些网格的每排容积与第 4 5 和 6 号网格是不一样的 ( 见 节 ) 在这种情况下, 制备和评估两个新的更低稀释比例倍数的样本 如果需要按 1 2(1 + 1) 倍数进行稀释, 可参考 2.11 节 2 计数同一计数池两次, 或者使用同一稀释样本填充两个计数池都不是 真正的重复检测, 因为这样就无法评估取样 混匀和稀释过程中所产生的误差 2-10 期望两次独立计数之间的差异是 0, 这种情况下标准误等于两次计数总和的平方根 因此, 在 95% 可信区间内,(N1 N2)/ [ (N1 + N2)] 的随机误差应该 < 1.96 对于指定数目, 如果两次计数之间的差异小于或等于表 2-4 或表 2-5 中所对应的可接受差异, 计数是可以接受的, 取两次计数的平均值计算出精子浓度 如果两次计数之间的差异大, 则提示计数错误, 或加样误差, 或精子没有充分混匀, 从而导致在计数池内或玻片上非随机分布 如果两次计数之间的差异大于可接受程度, 则放弃这两次计数的结果, 重新制备和评估两个新的精液稀释样本 ( 不能评估第 3 个样本取三者平均值, 也不能取 3 个数据中的两个最接近值来计算平均值 ) 以上的情况同样适用于计数精子和过氧化物酶阳性细胞 ( 见 2.18 节 ) 对于 CD45 阳性细胞 ( 见 3.2 节 ) 和未成熟生精细胞 ( 见 2.19 节 ), 需要重新评估染色玻片 在 95% 可信区间临界值内, 仅有大约 5% 的重复样本由于随机误差超出此区间范围 罕见情况下, 因为样本的不均一性, 致使第 3 批重复样本也不能提供可接 受的差异 在这种情况下, 需要取所有重复值的平均值, 并将其记录在报告中 建议计算并报告精液中精子浓度 尽管精液中精子浓度不是衡量睾丸功能的一个特异性指标, 但是它与受精和妊娠率有关 精液中精子浓度是精子数目 (N) 除以相对应的体积, 即每个重复样本所计数总排数 (n) 的体积 ( 第 4 5 和 6 号网格各为 20nl) 乘以稀释倍数 即 C =(N/n) (1/20) 稀释倍数 如果稀释倍数是 1 5(1 + 4), 计数第 4 5 和 6 号网格, 精子浓度 C =(N/n) (1/20) 5 精子 /nl( 或 10 6 /ml 精液 ) 如果稀释倍数是 1 20(1 + 19), 计数第 4 5 和 6 号网格, 精子浓度 C =(N/n) (1/20) 20 精子 /nl =(N/n) 精子 /nl( 或 10 6 /ml 精液 ) 如果稀释倍数是 1 50(1 + 49), 计数第 4 5 和 6 号网格, 精子浓度 C =(N/n) (1/20) 50 精子 /nl =(N/n) 2.5 精子 /nl( 或 10 6 /ml 精液 ) 稀释倍数是 1 20(1 + 19), 重复样本 1 中, 在 7 排内观察到 201 个精子, 而重复样本 2 中, 在 7 排内观察到 245 个精子 14 排中精子总数为 = 446,
57 34 第一部分精液分析两者之差为 = 44 根据表 2-4 可以看到超出预期随机误差 (41), 所以需要制备新的稀释样本片计数 2 稀释倍数是 1 20(1 + 19), 重复样本 1 中, 在 4 排内观察到 220 个精子, 而重复样本 2 中, 在 4 排内观察到 218 个精子 8 排中精子总数为 = 438, 两者之差为 = 2 根据表 2-4 可以看到差异小于预期随机误差 (41), 所以得出的数值是可以接受的 稀释倍数 1 20(1 + 19) 的精子浓度是 C =(N/n) 1.0 精子 /nl, 即 (438/8) 1.0 = 精子 /nl, 或者 精子 /ml 精液 ( 保留两位有效数字 ) 稀释倍数是 1 20(1 + 19), 并计数第 4 5 和 6 号网格, 容易计算精子浓度, 计数的精子总数 / 计数的总排数 = 精子浓度 (10 6 /ml) 上述例子的计算是 ( )/(4 + 4)= 438/8 = 精子 /ml 精液 3 稀释倍数是 1 20(1 + 19), 重复样本 1 中, 在 15 排内观察到 98 个精子 ( 第 5 4 和 6 号网格 ), 而重复样本 2 中, 在 15 排内观察到 114 个精子 ( 第 5 4 和 6 号网格 ) 30 排中精子总数为 = 212, 两者之差为 = 16 根据表 2-4 可以看到差异小于预期随机误差 (29), 所以得出的数值是可以接受的 稀释倍数 1 20(1 + 19) 的精子浓度是 C =(N/n) 1.0 精子 /nl, 即 (212/30) 1.0 = 7.07 精子 /nl, 或者 精子 /ml 精液 由于计数精子少于 400 个, 报告表 2-2 给出的 212 个精子相对应的取样误差 ( 约为 7%) 在该例中, 因为在第 5 4 和 6 号网格观察到的精子总数少于 200 个, 所以样本被过度稀释 ; 如果稀释倍数为 1 5(1 + 4), 得出的数据可能更准确的 4 稀释倍数是 1 5(1 + 4), 重复样本 1 中,4 排内观察到 224 个精子, 而重复样本 2 中, 在 4 排内观察到 268 个精子 两者 8 排中精子总数为 = 492, 两者之差为 = 44 根据表 2-4 可以看出超出预期随机误差 (43), 所以需要制备新的稀释样本 5 稀释倍数是 1 5(1 + 4), 重复样本 1 中,8 排内观察到 224 个精子, 而重复样本 2 中,8 排内观察到 213 个精子 两者 16 排中精子总数为 = 437, 两者之差为 = 11 根据表 2-4 可以看出差异小于预期随机误差 (41), 所以得出的数值是可以接受的 稀释倍数 1 5(1 + 4) 的精子浓度是 C =(N/n) (1/4) 精子 /nl, 即 (437/16) 精子 /4 = 精子 /nl, 或者 精子 /ml 精液 ( 保留两位有效数字 ) 稀释倍数 1 5(1 + 4) 的精子浓度也可以简单地计算出来, 但是精子总数除以总排数后, 还要再除以 4 在上述例子中,[( )/(8 + 8)]/4 =(437/16)/4 = 27.3/4 = 精子 /ml 精液 精子浓度的参考值下限为 /ml( 第 5 个百分位数,95% 可信区间为 12~ )
58 第 2 章标准程序 推荐计算和报告每次射出精液的精子总数, 因为这一参数可以评价睾丸产生精子的能力和男性输精管道的通畅性 精子浓度乘以整份精液体积可以得出精子总数 精子总数的参考值下限为 / 每次射精 ( 第 5 个百分位数,95% 可信区间为 33~ ) 2.9 如果在两张重复湿片中没有观察到精子, 疑为无精子症 虽然应该修改无精 症的定义 (Sharif,2000;Ezeh & Moore,2001), 但是无精子症仍然是指射出的精 液里没有精子, 而不是指睾丸没有生成精子或作为诊断和治疗的依据 目前普遍 接受的是无精子症这一术语仅可使用于离心后精液标本沉淀物中没有发现精子 (Eliasson,1981) 然而, 应该注意以下几点 : 离心后沉淀物内能否发现精子取决于离心时间和速度 (Lindsay et al.,1995; Jaffe et al.,1998) 以及所检查的沉淀物的量 以 3000g 离心 15 分钟不能把标本内所有精子离心形成沉淀团 (Corea et al., 2005) 离心后精子可能丧失活力 (Mortimer,1994a), 并且精子浓度会被低估 (Cooper et al.,2006) 这些标本的处理方法主要取决于精子存在和精子活力的主观数据是否足够 ( 见 2.10 节 ), 或是否要求获得准确精子的数目 ( 见 2.11 节 ) 2.10 如果最初湿片每高倍显微视野的精子数目少 ( 每 400 倍视野下精子数目为 0~ 4 个, 或者每 200 倍视野下精子数目为 0~16 个 ), 则有几种建议的处理方法 如果每 400 倍视野中精子数目 < 4 个 ( 即精子浓度 < 约 /ml), 考虑到精子数目少时, 取样误差大, 对于绝大多数临床检查的目的, 报告精子浓度 < /ml 就足够了 需同时注明是否观察到前向运动精子 当任一湿片中都没有观察到精子时, 应该离心精液标本, 以确定是否在更大标本量中可发现精子
59 36 第一部分精液分析 充分混匀精液标本 ( 方框 2-3) 如果精液标本较黏稠, 按 节描述的方 法降低精液黏稠度 取出 1 毫升精液, 以 3000g 离心 15 分钟 弃去大部分上清液, 并在剩下的大约 50µl 精浆里重新混匀精子沉淀物 在两张玻片上, 各加入 10µl 沉淀团悬液, 覆盖 22mm 22mm 盖玻片 制成 两张 20µm 深的湿片 ( 方框 2-4) 在 200 倍或 250 倍的相差显微镜下, 检查两张玻片 顺序地逐个视野观察整个盖玻片区域 观察时, 从盖玻片的一角开始, 沿 x 轴观察到盖玻片的对侧 ; 然后沿 y 轴下移一个视野, 并在沿 x 轴观察同样 宽度返回 继续以这种 Z 字形方式, 对整个样本进行完全和系统的检查 ( 图 2-9) 在移动视野过程中, 保持观察玻片 使用 20 倍物镜, 目镜孔径为 20mm 的 10 倍目镜, 在这种情况下, 显微镜视 野的直径约为 1000µm( 方框 2-9) 所以, 每个 22mm 22mm 盖玻片下, 约有 484 个视野 (22 22) 需作检查 在任一重复样本中观察到精子, 则提示隐匿精子症 如果两张重复玻片中均未观察到精子, 则提示无精子症 1 很多配 15ml 离心管的台式离心机达不到 3000g: 可使用配有 1.5~2.0ml 离心管的速度更高的离心机 取样之前, 确保精液标本充分混匀 2 对于具有高背景的样本, 仔细观察玻片可能需要约 10 分钟 3 当精液标本离心是用于辅助生育时, 需要仔细观察整份精液标本和绝 大部分离心后的沉淀物 ( 例如,4 份 10µl 标本的沉淀物 ), 以期发现活精子 1 在检查的样本中找不到精子, 并不意味在剩余标本里没有精子 2 由于离心并不能将所有精子沉淀下来, 所以不能用这种方法评估精子 总数 定量方法见 节或 节 当寻找活动精子时 ( 如一个输精管切除术后精液标本 ), 必须避免用固定液稀 释精液样本或对标本进行高速离心 在这种情况下, 仅取出少量未稀释精液样本 进行评估 充分混匀精液标本 ( 方框 2-3) 取出 40µl 精液标本, 覆盖上 24mm 50mm 盖玻片 这样就制好 33µm 深的 湿片 ( 方框 2-4) 用相差显微镜, 以 200 倍或 250 倍检查玻片 顺序地逐个视野观察整个盖玻片区域 观察时, 从盖玻片的一角开始, 沿 x 轴观察到盖玻片的对侧 ; 然后沿 y 轴下移一个视野, 并在沿 x 轴观察同样
60 第 2 章标准程序 37 宽度返回 继续以这种 Z 字形方式, 对整个样本进行完全和系统的检查 ( 图 2-9) 在移动视野过程中, 保持观察玻片 使用 20 倍物镜 目镜孔径为 20mm 的 10 倍目镜, 在这种情况下, 显微镜视野的直径约为 1000µm( 方框 2-9) 所以, 每个 24mm 50mm 盖玻片下, 约有 1200 个视野 (24 50) 需作检查 当样本有较高背景时, 观察玻片过程需要 10 分钟 2-9 观察整个盖玻片区域寻找活动精子在放大 200 倍时, 对于 24mm 50mm 的盖玻片, 大约需要评估 1200 个高倍镜视野 ; 对于 22mm 22mm 的盖玻片, 大约需要评估 484 个高倍镜视野 在检查的样本中找不到精子, 并不意味在剩余标本里没有精子 2.11 本节叙述的是不离心而确定低精子浓度的方法 另一种离心沉淀精子的方法是应用于检测低稀释倍数的精液标本, 并且检查的样本体积较大 当涉及定量下限 (LLQ) 时,20% 的精确度是可以接受的 (Shah et al.,2000) 对改良 Neubauer 血细胞计数池的整个中央网格 ( 图 2-7 中的第 5 号网格 ) 进行检查, 当充满稀释倍数 1 2(1 + 1) 的精液样本时, 理论上可以检测出 精子 /ml 的精子浓度, 取样误差为 20% 如果计数所有 9 个网格, 可以估计出低至 精子 /ml 的精子浓度 使用大容量 (25nl) 的一次性计数板, 检测出 1000 精子 /ml 的精子浓度, 取样误差同样为 20%(Cooper et al.,2006) 对于稀释倍数是 1 2(1 + 1), 如这里建议的, 这些值分别相当于 精子 /ml 精子 /ml 和 2000 精子 /ml 的未稀释精液的精子浓度 然而, 精液稀释倍数这么低会使背景较重 仔细检查大计数池需要 10~20 分钟, 但如果借助荧光染色技术, 可以快速检测精子 ( 见 节 )
61 38 第一部分精液分析 Neubauer 为减少取样误差, 必须计数足够数量的精子 ( 最好计数至少 400 个精子, 每个 重复样本计数大约 200 个精子 )( 方框 2-7 和表 2-2) 充分混匀精液标本 ( 方框 2-3) 取出少量精液, 并用固定液按 1 2(1 + 1) 稀释 ( 见 节 ), 该过程注意事项 见 节 对于最初湿片中每高倍镜视野精子数目少于 2 个的精液标本来说 ( 表 2-3), 稀 释倍数 1 2(1 + 1) 对一定范围精子浓度的精液标本来说是合适的, 这样在血 细胞计数板上可以观察到 200 个精子 ( 方框 2-11) 需要评估第 1~9 号网格 2-11 Neubauer 如果在最初湿片每 4nl 高倍镜视野中有 2 个精子, 那么从理论上而言, 精子浓度为 0.5 精子 /nl(500 精子 /µl 或 精子 /ml) 改良 Neubauer 计数池的全部 9 个网格容积为 900nl, 将会有 450 个精子 按建议 1 2 (1 + 1) 进行稀释, 将会降低背景, 并且每个计数池有 225 个精子, 足以达到可接受的低取样误差 因为计数精子数目很少, 而且标本体积可能也不准确, 所以, 这个数值只 是一个粗略的估计值 步骤 1. 按照上述步骤, 用固定液, 以 1 2(1 + 1) 稀释倍数, 稀释出两份精液样本 2. 将两份重复稀释样本分别加入血细胞计数板上的两个计数池内, 每 1 份重复样本加入 1 个计数池 3. 室温下, 将血细胞计数板水平放在湿盒内至少 4 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免干燥 在这段时间内, 已制动的精子会沉降到网格上 4. 在相差显微镜的 200 或 400 倍镜下, 检查血细胞计数板 5. 每份重复样本至少计数 200 个精子, 以达到可接受的低取样误差 ( 方框 2-7 和表 2-2) 6. 在计数池中逐格评估, 直到至少计数到 200 个精子, 而且评估了一个完整的网格 必须计数至完整的网格, 不要在一个网格的中间停止计数 7. 记录计数达到至少 200 个精子时, 所评估的网格数 血细胞计数板的另一个计数池也需要计数相同数目的网格 8. 借助实验室的计数器, 计数精子和记录网格数目 9. 接着计数血细胞计数板的第二个计数池, 如同第一个重复样本一样, 在相同的网格数 ( 即相同体积 ) 中进行重复计数, 即使这样计数未达到 200 个精子 10. 计算两个数值的总数和差异
62 第 2 章标准程序 根据表 2-5( 它是将表 2-4 延伸于精子数目少的情况 ) 或图 A7-1 附录 7, 确定差异的可接受性 ( 每个值显示, 预期发生在 95% 的标本中, 仅由于取样误差所致的两次计数之间的最大差异 ) 12. 如果这种差异可以接受, 计算精子浓度 ( 见 节 ) 如果这种差异太大, 按上述方法重新制备两张新的湿片, 并重新计数 ( 方框 2-10) 13. 以两位有效数字报告平均精子浓度 14. 计算每次射精的精子总数 ( 见 节 ) 2-5 对于一定总数的两次计数之间可接受的差异 : 低精子浓度 总数 * 可接受差异 总数 * 可接受差异 总数 * 可接受差异 35~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ * 基于四舍五入取整数的 95% 可信区间 精液中低精子浓度的计算精液中精子浓度为精子总数目 (N) 除以计数这一数目的体积, 即每个重复样本所评估的网格总数 (n) 的容积 ( 一个网格的容积是 100nl) 乘以稀释倍数 即 C = (N/n) (1/100) 稀释倍数 如果稀释倍数是 1 2(1 + 1), 精子浓度 C =(N/n) (1/100) 2 精子 /nl =(N/n) (1/50) 精子 /nl 当检测血细胞计数板每个计数池全部 9 个网格时, 观察到的精子总数除以两个计数池的总容积 (1.8µl), 再乘以稀释倍数 (2), 从而计算出每 µl 的精子浓度 ( 几千个精子 /ml 精液 ) 方法的灵敏度如果每个计数池观察到的精子数目少于 200 个, 取样误差将超过 5% 如果两个计数池计数到精子总数小于 400 个, 按计数到的精子数报告取样误差 ( 表 2-2) 如果每个计数池观察到的精子少于 25 个, 精子浓度就 < 精子 /ml; 当检测改良 Neubauer 计数池全部 9 个网格, 并且稀释倍数是 1 2(1 + 1) 时, 这个浓
63 40 第一部分精液分析度值是 20% 取样误差的定量下限 (Cooper et al.,2006) 报告观察到的精子数目, 并注明 计数的精子数太少, 而不能准确测定精子浓度 (< /ml) 在检查的样本中找不到精子, 并不意味在剩余标本里没有精子 样例 1 稀释倍数是 1 2(1 + 1), 重复样本 1 中在 2 个网格内观察到 200 个精子, 而重复样本 2 中在 2 个网格内观察到 250 个精子 4 个网格中精子总数为 = 450, 两者之差为 = 50 根据表 2-5 可以看出超出预期随机误差 (42), 所以摒弃结果, 并且制备两个新的稀释样本 2 稀释倍数是 1 2(1 + 1), 重复样本 1 在 3 个网格内观察到 210 个精子, 而重复样本 2 中 3 个网格内观察到 200 个精子 6 个网格中精子总数为 = 410, 两者之差为 = 10 根据表 2-5 可以看出小于预期随机误差 (40), 所以, 得出的数值是可以接受的 稀释倍数 1 2(1 + 1) 的样本中的精子浓度是 C =(N/n) (1/50) 精子 /nl, 或者 (410/6) 1.37 精子 /nl, 或者 精子 /ml 精液 ( 保留两位有效数字 ) 3 稀释倍数是 1 2(1 + 1), 重复样本 1 中在所有 9 个网格内观察到 120 个精子, 而重复样本 2 中全部 9 个网格内观察到 140 个精子 18 个网格中两次精子计数的精子总数为 = 260, 两者之差为 = 20 根据表 2-5 可以看出小于预期随机误差 (32), 所以, 得出的数值是可以接受的 如果每个计数池评估全部 9 个网格 ( 总量 1.8µl) 时, 稀释倍数是 1 2(1 + 1) 的样本中的精子浓度是 C =(N/1.8) 2 精子 /µl =(260/1.8) 2 = 精子 /µl, 或者 = 精子 /ml 精液 ( 保留两位有效数字 ) 由于观察到的精子总数少于 400 个, 报告根据表 2-2 得出 260 个精子相应的取样误差约为 6% 4 稀释倍数是 1 2(1 + 1), 重复样本 1 在全部 9 个网格内观察到 10 个精子, 而重复样本 2 在全部 9 个网格内观察到 8 个精子 由于观察到的精子总数少于 25 个, 精子浓度低于 精子 /ml 报告 两个重复样本中共观察到 18 个精子, 精子数太少, 不能准确测定精子浓度 (< /ml) 5 稀释倍数是 1 2(1 + 1), 两个计数池都没有观察到精子 所观察到的精子总数少于 25 个, 精子浓度低于 精子 /ml 报告 两个重复样本中未观察到精子, 精子数太少, 不能准确测定精子浓度 (< /ml) 每次射精的精子总数的计算推荐计算和报告每次射精的精子总数, 因为这一参数可以评价睾丸产生精子的能力和男性输精管道的通畅性 精子浓度乘以整份精液体积可以得出精子总数 利用大容量 100µm 深的计数池可以提高评估精子浓度的灵敏度 (Cooper et al.,2006) 大容量计数板有两个 100µm 深的计数池, 每个计数池容积为 25nl 为
64 第 2 章标准程序 41 了减少取样误差, 必须至少计数一定的精子数目 ( 最好每个重复样本计数大约 200 个, 两个计数池总共至少 400 个 )( 方框 2-7 和表 2-2) 充分混匀精液标本 ( 方框 2-3) 取出少量精液样本, 并按照稀释倍数 1 2(1 + 1)( 见 节 ) 加入含有赫斯特 双苯酰亚胺荧光染料 33342[Hoechst bisbenzimide fluorochrome(1mg/l)] 的固定液, 注意事项见 节 如果初始评估精子数少于 2 个 ( 表 2-3), 稀释倍数 1 2(1 + 1) 对于一定范围内 的精子浓度是合适的, 在整个计数池中可以观察到约 200 个精子 ( 方框 2-12) µm 200 如果在最初湿片的每高倍显微镜视野 4nl 样本中仅发现 1 个精子, 那么从理论上讲, 精子浓度为 0.25 精子 /nl(250 精子 /µl 或 精子 /ml) 因为大容量计数池的容积为 25nl, 所以在其中会有 6250 个精子 按建议的稀释倍数 1 2 (1 + 1), 可以降低背景, 并且每个重复样本可以观察到 3125 个精子, 足以获得达到可接受的低取样误差 因为计数精子数目很少, 而且标本体积可能也不准确, 所以, 这个数值只 是一个粗略的估计值 步骤 1. 按照上述步骤, 用固定液, 以 1 2(1 + 1) 稀释倍数, 稀释出两份精液样本 2. 将两份重复稀释样本分别加入血细胞计数板上的两个计数池内, 每 1 份重复样本加入 1 个计数池 3. 室温下, 将血细胞计数板水平放在湿盒内至少 10~15 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免干燥 在这段时间内, 荧光染料会结合到精子头部, 并且已制动的精子会沉降到计数池底面上 4. 在配置了相应二色性镜片和阻挡滤片, 放大 250 倍的荧光显微镜下, 观察计数板 5. 每份重复样本至少计数 200 个精子, 以达到可接受的低取样误差 ( 方框 2-7 和表 2-2) 6. 顺序地逐个视野观察整个盖玻片区域 观察时, 从盖玻片的一角开始, 沿 x 轴观察到盖玻片的对侧 ; 然后沿 y 轴下移一个视野, 并在沿 x 轴观察同样宽度返回 继续以这种 Z 字形方式进行的检查 ( 图 2-9) 在移动视野过程中, 保持观察玻片 至少计数 200 个精子 7. 记录计数达到至少 200 个精子时所评估的视野数 血细胞计数板的另一个计数池也需要计数相同数目的视野 8. 借助实验室的计数器, 计数精子和记录视野数 9. 接着计数血细胞计数板的第二个计数池, 如同第一个重复样本一样, 在相同的视野数 ( 即相同体积 ) 中进行重复计数, 即使这样计数未达到 200 个精子 10. 计算两个数值的总数和差异
65 42 第一部分精液分析 11. 根据表 2-5( 它是将表 2-4 延伸于精子数目少的情况 ) 或图 A7-1 附录 7, 确定差异的可接受性 ( 每个值显示, 预期发生在 95% 的标本中, 仅由于取样误差所致的两次计数之间的最大差异 ) 12. 如果这种差异可以接受, 计算精子浓度 ( 见 节 ) 如果这种差异太大, 按上述方法重新制备两份稀释标本, 并计数 ( 方框 2-10) 13. 以两位有效数字报告平均精子浓度 14. 计算每次射精的精子总数 ( 见 节 ) 1 精子核是浓缩的, 所以精子呈现明亮荧光点, 而不像白细胞和非精子细胞的核较大, 呈现较分散荧光 (Zinaman et al.,1996) 2 如果对于荧光信号的细胞来源不确定, 则转而使用相差显微镜, 这样可 以看到精子尾 精液中低精子浓度的计算 精液中精子浓度是精子数目 (N) 除以所评估显微视野总数 (n) 的精液体积 [ 视 野体积 (v) 的计算方法见方框 2-13], 再乘以稀释倍数 即 C =(N/n) (1/v) 稀释 倍数 放大 250 倍时, 视野体积是 80nl( 方框 2-13), 并且稀释倍数是 1 2(1 + 1), 那 么精子浓度是 C =(N/n) (1/80) 2 精子 /nl =(N/n) (1/40) 精子 /nl(10 6 精子 /ml 精液 ) 放大 400 倍时, 视野体积是 20nl( 方框 2-13), 并且稀释倍数是 1 2(1 + 1), 那 么精子浓度是 C =(N/n) (1/20) 2 精子 /nl =(N/n) (1/10) 精子 /nl(10 6 精子 /ml 精液 ) 当两个计数池的全部区域评估完, 精子总数除以两个计数池的总体积 (50µl), 再乘以稀释倍数 (2), 从而可以计算出每 µl 的精子浓度 ( 几千个精子 /ml 精液 ) µm 每个显微视野的体积取决于视野面积 (πr 2,π 约为 3.142,r 是视野的半径 ) 和计数池的深度 ( 这里为 100µm) 显微视野的直径可以用镜台测微尺测量, 或用目镜孔径除以物镜放大倍数估算出来 如果显微镜物镜是 40 倍 10 倍目镜的孔径为 20mm, 每个视野直径约为 500µm (20mm/40) 在这种情况下,r = 250µm,r 2 = µm 2,πr 2 = µm 2, 体积约为 µm 3 或大约 20nl 如果显微镜物镜是 25 倍 10 倍目镜的孔径为 25mm, 每个视野直径约为 1000µm (25mm/25) 在这种情况下,r = 500µm,r 2 = µm 2,πr 2 = µm 2, 体积约为 µm 3 或约 80nl 方法的灵敏度 如果每个计数池观察到的精子数目少于 200 个, 取样误差将超过 5% 如果 两个计数池计数到精子总数 < 400 个, 按计数到的精子数报告取样误差 ( 表 2-2)
66 第 2 章标准程序 43 如果每个计数池观察到的精子 < 25 个, 精子浓度就 < 2000/ml[ 当检测整个计数池 (25µl)], 并且稀释倍数是 1 2(1 + 1) 时, 这个浓度值是 20% 取样误差的定量下限 (Cooper et al.,2006) 报告观察到的精子数目, 并注明 计数的精子太少, 而不能准确测定精子浓度 (< 2000/ml) 在检查的样本中找不到精子, 并不意味在剩余标本里没有精子 样例 1 稀释倍数是 1 2(1 + 1), 重复样本 1 在 300 个视野内观察到 210 个精子, 而重复样本 2 在 300 个视野内观察到 300 个精子 600 个视野内计数的精子总数为 = 510, 两者之差为 = 90 根据表 2-5 可以看出超出预期的随机误差 (44), 所以, 摒弃结果, 并制备两个新的稀释样本 2 稀释倍数是 1 2(1 + 1), 重复样本 1 在 400 个视野内观察到 200 个精子, 而重复样本 2 在 400 个视野内观察到 230 个精子 800 个视野内计数的精子总数为 = 430, 两者之差为 = 30 根据表 2-5 可以看出小于预期随机误差 (41), 所以, 得出的数值是可以接受的 稀释比例 1 2(1 + 1) 的样本中的精子浓度是 C =(N/n) (2/v)/nl 如果 v = 20nl ( 放大倍数是 400 倍时, 见方框 2-13),C =(430/800) (2/20)= 精子 /nl, 或者 = 精子 /ml 精液 ( 保留两位有效数字 ) 3 稀释倍数是 1 2(1 + 1), 重复样本 1 的整个计数池内观察到 50 个精子, 而重复样本 2 中的整个计数池内观察到 70 个精子 两个重复样本中计数的精子总数为 = 120, 两者之差为 = 20 根据表 2-5 可以看出小于预期随机误差 (21), 所以, 得出的数值是可以接受的 如果稀释倍数是 1 2(1 + 1), 并且检测了两个计数池的整个区域 ( 总容积 50µl),C =(N/50) 2 精子 /µl =(120/50) 2 = 4.8 精子 /µl, 或者 = 4800 精子 /ml 精液 ( 保留两位有效数字 ) 由于计数到的精子总数少于 400 个, 根据表 2-2 报告相应 120 个精子的取样误差约为 10% 4 稀释倍数是 1 2(1 + 1), 重复样本 1 在整个计数池内观察到 20 个精子, 而重复样本 2 在整个计数池内观察到 18 个精子 由于所计数到的精子总数少于 25 个, 精子浓度则 < 2000 精子 /ml 报告 在两份重复样本中观察到 38 个精子, 精子数太少, 不能准确测定精子浓度 (< 2000/ml) 5 稀释倍数是 1 2(1 + 1), 每个重复样本都没有观察到精子 所观察到的精子总数少于 25 个, 精子浓度低于 2000/ml 报告 两个重复样本中未观察到精子, 精子数太少, 不能准确测定精子浓度 (< 2000/ml) 每次射精精子总数的计算推荐计算和报告每次射精的精子总数, 因为这一参数可以评价睾丸产生精子的能力和男性输精管道的通畅性 精子浓度乘以整份射出精液体积可以得出精子总数
67 44 第一部分精液分析 2.12 精液里非精子细胞的存在可能提示睾丸受损 ( 不成熟生精细胞 ) 输出小管的病理状态 ( 纤毛丛 ) 或者附属性腺的炎症 ( 白细胞 ) 精液中非精子细胞的数目 [ 上皮细胞 圆细胞 ( 生精细胞和白细胞 ) 以及分离的精子头或尾 ] 可以用检测精子数目的同样方法, 通过使用血细胞计数板制备固定湿片来进行评估 ( 见 节 ) 然而, 为计数精子, 精液被充分稀释了, 在正常情况下, 精液的稀释倍数对于精确评估非精子细胞则太高了, 除非精液里存在大量非精子细胞 圆细胞相对精子的发生率可以通过玻片进行评估 ( 见 节 ) 另一种方法, 可以通过检测过氧化物酶阳性细胞计算出圆细胞浓度 ( 见 节 ) 通过用未稀释精液制备涂片, 涂片经固定和染色后作评估, 可以计算出相对于精子浓度的圆细胞浓度 ( 见 节 ) 如果 N 是计数到 400 个精子的相同视野内观察到的圆细胞数目,S 代表精子浓度 (10 6 /ml), 圆细胞浓度 (10 6 /ml) 可以用公式计算,C = S (N/400) 如果评估的精子少于 400 个, 计数圆细胞的取样误差将超过 5% 在这种情况下, 按计数到的相应圆细胞数目报告取样误差 ( 表 2-2) 如果计数到的圆细胞数目少于 25 个, 报告观察到的圆细胞数, 并注明 细胞数太少, 不能够准确测定浓度 重复样本 1 中在每 200 个精子观察到 21 个圆细胞, 而重复样本 2 在每计数 200 个精子观察到 39 个圆细胞 两份样本圆细胞数目之和为 = 60, 两者之差为 = 18 根据表 2-5 可以看出超出预期的随机误差 (15), 所以, 摒弃结果, 并重新评估 2 重复样本 1 中每 200 个精子观察到 24 个圆细胞, 而重复样本 2 在每 200 个精子有 36 个圆细胞 两份样本圆细胞数目之和为 = 60, 两者之差为 = 12 根据表 2-5 可以看出小于预期随机误差 (15), 所以, 得出的数值是可以接受的 如果每 400 个精子观察到 60 个圆细胞, 精子浓度是 精子 /ml, 那么圆细胞浓度是 C = S (N/400) 细胞 /ml = (60/400)= 细胞 /ml, 或 细胞 /ml( 保留两位有效数字 ) 由于计数的圆细胞数目少于 400 个, 根据表 2-2, 报告相应 60 个圆细胞的取样误差约为 13% 1 如果估计的圆细胞浓度超过 10 6 /ml, 则需要用过氧化物酶活性 ( 见 2.18 节 ) 或白细胞标志物 ( 见 3.2 节 ) 检测它们的种类, 并且准确测定它们的浓度 在染色良好的制片中, 可以鉴别出未成熟的生精细胞 ( 见 2.19 节 )
68 第 2 章标准程序 45 2 精液中圆细胞总数可以反映出炎症的严重性或精子发生状态 圆细胞 总数等于圆细胞浓度乘以整份精液体积 2.13 精子形态学的评估包括以下步骤 ( 详见以下章节 ) 精液涂片的制备 ( 见 节 ) 涂片的空气干燥 固定和染色 ( 见 2.14 节 ) 如果准备长期保存涂片, 用盖玻片封片 ( 见 节和 节 ) 用 1000 倍油镜亮视野下检查玻片 ( 见 2.15 节和 2.16 节 ) 每张重复涂片应检查约 200 个精子, 以确定正常形态精子百分率 ( 见 节 ) 或者正常与异常形态精子百分率 ( 见 节 ) 比较重复涂片两个数值的差异是否在可接受范围内, 如果是, 进行计算 ; 否 则, 重新读片 由于人精子形态的多样性, 造成精子形态评估困难 但是, 通过观察从女性生 殖道, 特别是性交后宫颈黏液回收的精子 (Fredricsson & Björk,1977;Menkveld et al.,1990), 或者从卵子透明带表面回收的精子 (Menkveld et al.,1991;liu &Baker, 1992a)( 图 2-10), 有助于定义具备潜在受精能力精子的外观 ( 形态学正常 ) 在严 2-10 正常 形态精子 (a) (b) 从体外卵透明带上回收的, 经过 Shorr 染色的精子 ;(c) 从性交后宫颈黏液中回收的, 经过巴氏染色的精子 可以观察到这些精子几乎没有头部 中段或主段的缺陷 尾部可能有弯曲但没有呈锐利折角 [(a,b)reproduced from Liu et al.(2003)by permission of the European Society of Human Reproduction and Embryology.(c)Reproduced from Menkveld & Kruger(1990)by permission.]
69 46 第一部分精液分析 格使用精子形态学某些标准的情况下, 已经证实正常形态精子百分率与不同的生 育力评价的终点指标 [ 妊娠等待时间 (time-to-pregnancy,ttp), 体内与体外妊娠率 (pregnancy rates in vivo and in vitro)] 存在联系 (Eggert-Kruse et al.,1996;jouannet et al.,1988;toner et al.,1995;coetzee et al.,1998;menkveld et al.,2001;van Waart et al.,2001;garrett et al.,2003;liu et al.,2003), 这可能对判断生育力的预 后有意义 这里所描述分类方法的基本依据, 是通过鉴定源自宫颈黏液具有潜在受精能 力的亚群精子来定义正常形态精子, 这是有局限性的 应用这些标准, 有生育力 和不育的正常形态精子百分率的范围大致为 0~30%, 很少有精液标本的正常形 态精子百分率超过 25%(Menkveld et al.,2001) 这个低值不可避免产生一个低的 临界值 试管婴儿 (Coetzee et al.,1998) 宫腔内人工授精 (Van Waart et al.,2001) 及自然受孕 (Van der Merwe et al.,2005) 的研究中确实发现, 正常形态精子的参考 限或临界值仅为 3%~5% 人类卵子透明带也能筛选出一类形态相似的精子亚群, 但这种 卵透明带优 选 的精子也有较大的形态范围 展示 卵透明带优选 形态的父亲精液中的活 动精子百分率也是低的, 约 8%~25%(Liu et al.,2003) 固定剂快速加入到精液中会引起精浆蛋白变性, 使精子变得模糊, 不易观察 精子形态学分析的传统作法是涂片在固定和染色前, 采用空气干燥 然而, 空气 干燥过程也会导致精子形态的假象 精液涂片干燥可能伴有以下问题 : 精子的大小会改变, 干燥 固定和染色后的精子比精液中所见的活精子会变 小一些 (Katz et al.,1986) 未成熟精子的头会膨胀 (Soler et al.,2000) 尽管保留了大量的过多残留胞浆, 但对渗透压敏感的胞浆小滴会丢失 (Abraham- Peskir et al.,2002;cooper et al.,2004) 每份新鲜的精液标本应制备两张或更多的涂片, 以防染色发生问题或载玻片 破碎 由于涂片之间可能存在形态学上的显著性差异, 最好对两张重复涂片的每 一张玻片都进行形态学评估 充分混匀精液标本 ( 方框 2-3) 快速取样, 使精子没有时间从混悬的精液样本中沉降下来 重复取样前, 再次混匀精液标本 根据精液标本不同情况, 采用不同的涂片方式 ( 图 2-11) 正常精液标本 在此过程中, 使用拉薄技术, 将一滴精液涂在载玻片的整个表面上 ( 图 2-11a, 2.12 节 ) 用不掉屑的纸巾, 用力擦干净磨砂载玻片的两面 用中硬度铅笔 (HB 或 2 号 ), 在载玻片的磨砂处标记上鉴别信息 ( 例如编号 日期 )
70 第 2 章标准程序 用于精子形态学分析的精液涂片方法 (a) 对于未稀释的精液, 采用拉薄技术, 将一滴精液 (S) 沿成角度的载玻片后缘展开, 载玻片向前拖拉, 制成涂片 ;(b) 对于已洗涤的精液, 采用移液管法, 水平持移液管 (P) 向前推进动, 将一滴精子悬液 (SS) 沿载玻片的表面展开 根据精子浓度, 取 5~10µl 的精液滴在载玻片的一端 用第二张载玻片沿第一张载玻片的表面拖拉精液滴 ( 图 2-11a,2.12 节 ) 如果用来拖拉的载玻片是非磨砂的, 用它的两端可以拖拉制成 4 张涂片 如 2.14 节所描述, 涂片经空气干燥后, 染色 1 在磨砂片上, 铅笔标识虽经固定与染色仍保持稳定, 而用墨水或永久性 记号笔则会脱色 2 精液滴在载玻片上, 立即涂片, 不要放置数秒钟后再涂片 3 需注意, 使用一张载玻片在精液滴的前面 拖 制涂片, 而不要用玻片在 精液滴的后面 推 制涂片 涂片的质量 ( 最小程度的精子相互重叠 ) 取决于 : 精液量和精子浓度 : 精子数量越少, 它们相互重叠的可能越小 拉片的角度 (Hotchkiss 1945): 角度越小, 涂片越薄 拖拉涂片的速度 (Eliasson 1971): 速度越快, 涂片越厚 开始时, 可以用 10µl 的精液,45 角度, 约一秒钟涂一张玻片 如果必要, 可 以改变上述参数, 以减少涂片上精子间的相互重叠 (Menkveld et al.,1990) 精液 的黏稠度越低, 拉薄效果越好, 拉薄技术常常不适用于高度黏稠的精液 ( 图 2-12, 节 ) 2-12 制备一张正常精液的涂片体验涂片动作的感觉, 以 45 角放置拉片, 移动并接触精液滴 ( 左图 ); 沿着载玻片的边缘移动 ( 中图 ); 沿着载玻片的长轴, 缓慢拖回拉片 ( 约 1 秒钟 ), 制成一张涂片 ( 右图 )(Photographs courtesy of C Brazil.)
71 48 第一部分精液分析对于精子浓度低 (< /ml) 黏稠或碎片多的标本, 或者使用计算机辅助精子形态学评估的标本 ( 见 节 ), 可能需要不同的涂片制备方法 精子浓度低的标本 如果精子浓度低 ( 例如,< /ml), 浓缩标本 : 将标本 600g 离心 10 分钟 除去大部分上清液 通过用移液器轻轻吹打, 使精子团重新混悬于剩余的上清液中 尽可能获得最高的精子浓度, 但不要超过约 /ml 按正常精液标本制备涂片 ( 见 节 ) 离心可能影响精子形态, 如果离心了必须记录下来 黏稠的精液标本有时因为精浆高度黏稠, 很难制备好的精液涂片, 导致涂片厚而不均 黏稠的标本可以按液化不良精液标本相同的方法 ( 见 节 ) 或者使用洗涤的方法 ( 见 节 ) 来处理 这些方法可能影响精子形态, 如果使用了这些方法必须记录下来 对于碎片多或黏稠的精液标本, 以及为计算机辅助评估精子形态学而减少背景, 可以洗涤精液 精液中存在碎片和大量颗粒物质 ( 例如在黏稠标本中 ), 可使精子头枕在其边 缘上, 导致很难对它们进行分类 此类标本可以按下列步骤洗涤 在室温下, 将少量精液 (0.2~0.5ml, 取决于精子浓度 ), 加入到 10ml 生理盐水 ( 每 100ml 纯水中加入 0.9g 氯化钠 ) 中稀释 以 800g, 离心 10 分钟 吸出大部分上清液 通过用移液器轻轻吹打, 使精子团重新混悬于剩余的上清液中 (20~40μl) 用巴斯德吸管, 将 5~10μl 的精子混悬液均匀地涂在载玻片上 ( 图 2-11b) 用相差显微镜, 在 400 倍镜下检查涂片, 确认涂片上精子均匀分布 每 400 倍视野下, 至少检查 40 个精子, 没有精子聚集成团或相互重叠 按照 2.14 节所描述的方法, 涂片空气干燥, 染色 1 如果玻片上很多精子相互重叠, 减少取样量, 制备另一张涂片 2 如果玻片上的精子过于稀少, 增加取样量, 再制一张涂片 3 洗涤标本可能影响精子形态, 必须记录洗涤程序 制备涂片前, 让精液液化时间超过 30 分钟, 可以减少背景着色
72 第 2 章标准程序 一旦精液涂片空气干燥后, 应立即固定并染色, 以突出精子细节 推荐使用的染色方法有巴氏染色法 Shorr 染色法或 Diff-Quik 染色法 用上述三种染色方法, 在光学显微镜亮视野下观察, 精子头部的顶体区染成淡蓝色, 顶体后区染成深蓝色, 中段可能染成略呈红色, 尾部染成蓝色或淡红色 通常位于头部下部或围绕中段的过量残留胞浆染成粉红色 红色 ( 巴氏染色 ) 或者橘红色 (Shorr 染色 ) 快速染色方法是将一滴精液加在带有固定剂和染色剂的载玻片上, 这类玻片已有商品化产品 但是, 因为这种涂片技术会导致精子的分布不均匀, 无法观察到所描述的形态学分类所需细节, 所以不建议使用 包括以下步骤 : 乙醇固定细胞 ; 并且使细胞脱水 ; 浓度递减的乙醇使固定的涂片逐渐复水, 有利于水溶性苏木精染色 ; 纯水使干燥的涂片复水, 有利于水溶性苏木精染色 ; 苏木精使细胞核染成蓝色 ; 自来水除去未与细胞核结合的苏木精 ; 酸性乙醇除去胞浆中非特异结合的染料 ( 脱色 ); 自来水降低酸性, 使细胞核恢复蓝色 ; Scott s 液使细胞核恢复蓝色 ( 如果自来水处理效果不佳 ); 乙醇使细胞脱水, 从而使溶于乙醇的橙黄 G / EA-50 染色 ; 橙黄 G 使胞浆染成粉红色 ; EA-50 使胞浆染成粉红色 ; 浓度递增的乙醇使已经染色的涂片逐渐脱水, 以便使用溶于乙醇的封片剂 ; 二甲苯便于使用不溶于乙醇的封片剂 ( 方框 2-14) 2-14 精子涂片封片或不封片 ( 用或不用盖玻片 ) 均可观察 已封片的涂片可以长期保存, 以便必要时再次评估, 而且可以用于内质量控制 已封片的涂片干燥后的折射率 (RI)(1.50~ 1.55) 与玻璃的折射率 (1.50~1.58) 相似, 使用相近折射率 (1.52) 的油镜观察效果最好 对于精子和其他细胞染色来说, 巴氏染色法是一种好的染色方法 这种染色技术能够使精子头部的顶体区和顶体后区 过量残留胞浆 中段和主段染上颜色 已证明这种改良染色技术适用于分析精子形态学和检查未成熟生精细胞和非精子细胞 ( 附彩图 1~14) 常规的染色程序已进行了修改, 不再使用乙醚 ( 作为固定
73 50 第一部分精液分析剂 ) 和二甲苯 ( 以利于封片 )(ESHRE/NAFA,2002)( 见 节 ) 使用巴氏程序染色的涂片可以永久保存, 以备将来用于内质量控制 如果储存在阴暗处, 涂片可以稳定保存数月甚至数年 本手册附彩图中的精子是用以下染色方法制备的, 使用了不溶于酒精的封片剂进行封片 试剂 巴氏染剂 : 有商品化产品, 或者见附录 4,A4.10 节的方法配制 酸性乙醇 :1.0ml 浓盐酸加到 200ml 70%(v/v) 乙醇中 二甲苯 乙醇,1 + 1(1 2): 将 100% 乙醇与二甲苯等量混合 1 二甲苯对人体健康有危害, 应在通风柜中使用 2 涂片在固定及染色之前, 应空气干燥至少 4 小时, 但不超过 1 周 空气干燥精液涂片的固定 将涂片浸入 95% 的乙醇中至少 15 分钟 已固定涂片的染色 涂片固定后, 按步骤浸入以下溶液中 : 1. 80% 乙醇 (v/v) 30 秒 2. 50% 乙醇 (v/v) 30 秒 3. 纯水 30 秒 4. Harris s 苏木精 4 分钟 5. 纯水 30 秒 6. 酸性乙醇 * 浸 4~8 次 7. 冷流水冲洗 5 分钟 8. 50% 乙醇 (v/v) 30 秒 9. 80% 乙醇 (v/v) 30 秒 % 乙醇 (v/v) 至少 15 分钟 11. 橙黄 G6 1 分钟 % 乙醇 (v/v) 30 秒 % 乙醇 (v/v) 30 秒 % 乙醇 (v/v) 30 秒 15. EA-50 绿染 1 分钟 % 乙醇 (v/v) 30 秒 % 乙醇 (v/v) 30 秒 % 乙醇 15 秒 % 乙醇 15 秒 * 浸 1 次约 1 秒钟
74 第 2 章标准程序 51 1 乙醇固定可造成细胞脱水, 因此, 将涂片从 95% 乙醇固定液中取出后 直接染色时, 仅需要浸入 80% 乙醇液中 10 秒钟, 而固定后已空气干燥的涂片 放入 50% 乙醇溶液中则需停留更长时间 (2~3 分钟 ) 2 在上述第 6 步, 从浸 4 次开始, 可以逐渐增加次数, 直到效果满意为止 这一步很重要, 因为脱色时间的长短将显著改变最终的染色强度 如果省去这 一步, 精子和背景将会变得黑暗 增加浸入的次数将会使精子和背景变淡 3 精子涂片封片或不封片均可观察 封片前对已染色精液涂片的处理 有两类液体用于封片 : 溶于乙醇和不溶于乙醇的封片剂 在涂片上的乙醇未干时, 直接使用溶于乙醇的封片剂 使用不溶于乙醇的封片剂, 将涂片从上述染色程序的第 19 步直接进入到以 下步骤 ( 在通风柜中操作 ) 二甲苯 乙醇,1 + 1(1 2) 1 分钟 100% 二甲苯 1 分钟 从二甲苯染色缸中每次取出 1 张涂片, 让其滴干 1~2 秒钟, 当封片时, 涂片 应该十分湿润 已染色精液涂片的封片 滴加 2~3 小滴封片剂在载玻片上 将盖玻片 (24mm 50mm 或 24mm 60mm 最合适 ) 直接放置在载玻片上 盖玻片接触封片剂, 从载玻片的一长边开始放置, 以防止产生气泡 如有必要, 轻轻地按压盖玻片的顶端, 以使气泡移到载玻片的边缘 抹去载玻片底下多余的二甲苯 ( 如果使用二甲苯 ) 在通风柜内, 把已封片的涂片水平地放在载玻片干燥架上晾干, 或者放在吸水纸上干燥 24 小时 Shorr Shorr 染色可以得到与巴氏染色相近的正常形态精子百分率 (Meschede et al., 1993) 试剂 Harris s 苏木精 : 巴氏染色 1 号 Shorr 溶液 : 购买现成的或者按以下步骤配制 将 4g Shorr 粉剂溶解于 220ml 温的 50%(v/v) 乙醇中, 冷却后, 加入 2.0ml 冰醋酸 ( 在通风柜中操作 ), 并过滤 酸性乙醇 : 加 25ml 冰醋酸到 75ml 95%(v/v) 乙醇中 乙醇胺 : 加 5ml 25% 氢氧化铵到 95ml 75%(v/v) 乙醇中
75 52 第一部分精液分析 已空气干燥精液涂片的固定 将涂片浸入酸性乙醇或 75%(v/v) 乙醇中 1 小时 已固定精液涂片的染色 精液涂片固定后, 按步骤浸入以下溶液中 : 1. 流动自来水 * 浸 12~15 次 2. 苏木精 1~2 分钟 3. 流动自来水 * 浸 12~15 次 4. 乙醇胺 * 浸 10 次 5. 流水 * 浸 12~15 次 6. 50% 乙醇 (v/v) 5 分钟 7. Shorr 溶液 3~5 分钟 8. 50% 乙醇 (v/v) 5 分钟 9. 75% 乙醇 (v/v) 5 分钟 % 乙醇 (v/v) 5 分钟 * 浸 1 次约 1 秒钟 精子涂片封片或不封片均可观察 已染色精液涂片的封片见 节和 节 快速染色方法对于需要当天提供分析结果的临床实验室尤为适用 有几种不同的染色方法 (Kruger et al.,1987) 一些用快速染色法染的涂片有很深背景, 染色质量可能会比巴氏染色的差 试剂 Diff-Quik 快速染色试剂盒包括 : a) 固定剂 [ 三芳基甲烷 (triarylmethane) 染料溶解于甲醇中 ]; b) 染液 1( 嗜酸性氧杂蒽 )(eosinophilic xanthene); c) 染液 2( 嗜碱性硫氮杂苯 )(basophilic thiazine) 固定液 : 将 1.8mg 三芳基甲烷溶解于 1000ml 95%(v/v) 甲醇, 备用 固定液 :95%(v/v) 甲醇, 备用 已空气干燥精液涂片的固定将涂片浸入到三芳基甲烷 (triarylmethane) 固定液 ( 如 Diff-Quik 试剂盒中提供的, 或者按上述方法配制 )15 秒, 或者浸入到 95% 甲醇溶液 1 小时 把涂片垂直竖立在吸水纸上, 以除去多余的溶液
76 第 2 章标准程序 已固定精液涂片的染色 随后将涂片浸入以下溶液中 : 快速染液 1 10 秒快速染液 2 5 秒流水浸 10~15 次, 以去除多余的染剂上述每一步骤之间均将载玻片垂直竖立放在吸水纸上, 以去除多余的溶液 1 精子涂片封片或不封片均可观察 2 如果涂片的背景染色很深, 应取一定量的该精液标本进行洗涤 ( 见 节 ), 制备新涂片并染色 洗涤标本可能影响精子形态, 必须记录下洗 涤程序 已染色精液涂片的封片 见 节和 节 2.15 应该使用 100 倍油镜和至少 10 倍目镜, 检查已染色的涂片 当将 1 滴折射 率 (RI) 与细胞 ( 约 1.5) 和玻璃 (1.50~1.58) 折射率相近的液体, 加在镜头与未封 片的载玻片或盖玻片之间时, 可以获得更清晰的图像 这种液体通常是一种浸油 ( 折射率 1.52) 封片剂的折射率与浸油相似 (1.50~1.55: 方框 2-14) 精子形态学评估存在几个困难, 如缺乏客观性, 判读差异或执行外质量控制 差 ( 见 节 ) 这里推荐一种简单的区别精子形态正常或异常的分类方法, 记 录异常形态精子的异常部位 在评估精子正常形态时, 应采用以下的严格标准 (Kruger et al.,1986;menkveld et al.,1990;coetzee et al.,1998) 只有使用了以下 标准 ( 见 节 ), 所给出的参考限才有意义 精子包括头 颈 中段 主段和末段 由于通过光学显微镜很难观察到精子末 段, 因此可以认为精子是由头 ( 和颈 ) 和尾 ( 中段和主段 ) 组成 只有头和尾都正常 的精子才认为是正常的 所有处于临界形态的精子应该认为是异常 精子头外形上应该是光滑 轮廓规则, 大体上呈椭圆形 顶体区可清晰分辨, 占头部的 40%~70%(Menkveld et al.,2001) 顶体区没有大空泡, 并且不超 过 2 个小空泡, 空泡大小不超过头部的 20% 顶体后区不含任何空泡 中段应该细长 规则, 大约与头部长度相等 中段主轴应与头部长轴成一条 直线 残留胞浆只有在过量时才被认为是异常的, 即胞浆超过了精子头大小 的 1/3 时被认为过量残留胞浆 (Mortimer & Menkveld,2001) 主段应该比中段细, 均一, 其长约 45μm( 约为头部长度的 10 倍 ) 尾部应没
77 54 第一部分精液分析 有显示鞭毛折断的锐利折角 主段可以自身卷曲成环状 ( 图 2-10c) 1 使用此标准, 精子头部形状比大小更为重要, 除非存在严重缺陷 2 可借助目镜测微尺来区分精子头部大小正常或异常 3 使用计算机系统测量 77 个经巴氏染色的精子 ( 按 节所描述的方 法染色, 按本手册给出的标准分类 ) 的头部尺寸 ( 重复测量的差异变异系数为 2%~7%), 得到以下数据 : 长度的中位数为 4.1μm,95% 可信限区间为 3.7~ 4.7; 宽度的中位数为 2.8μm,95% 可信限区间为 2.5~3.2; 长宽比的中位数为 1.5,95% 可信限区间为 1.3~1.8 4 使用同样的计算机系统测量 74 个经巴氏染色的精子 ( 按 节所描 述的方法染色, 按本手册标准判断为正常的精子 ) 的中段尺寸, 得到以下数据 : 长度的中位数为 4.0μm,95% 可信限区间为 3.3~5.2; 宽度的中位数为 0.6μm, 95% 可信限区间为 0.5~0.7 5 卷尾 (> 360 ; 图 2-13m) 可能提示附睾功能障碍 (Pelfrey et al.,1982) 通过学习识别整个精子形状的细微变化 ( 正常或临界形态的精子的头和尾 ; 见 2.16 节和附彩图 1~12 以及它们的注释 ), 才能很好地对正常精子形态学进行 评估 人类精液标本中含有各种各样畸形的精子 精子异常发生和一些附睾的病 理改变常常与畸形精子百分率升高有关联 精子的形态缺陷通常是多重的 畸形 精子一般都会导致较低的受精潜能, 这取决于畸形的类型, 也可能有异常的 DNA 形态缺陷常伴有 DNA 碎片的增加 (Gandini et al.,2000) 染色体结构异常 (Lee et al.,1996) 不成熟染色质 (Dadoune et al.,1988) 和非整倍体 (Devillard et al.,2002; Martin et al.,2003) 虽然也考虑精子尾 ( 中段和主段 ), 但是头部的形状更为重要 应注意下列精子缺陷的类型 ( 图 2-13) 头部缺陷 : 大头 小头 锥形头 梨形头 圆头 不定形头 有空泡的头 ( 超过 2 个空泡, 或者未染色的空泡区域占头部的 20% 以上 ) 顶体后区有空泡 顶体 区过小或过大 ( 小于头部的 40%, 或大于头部的 70%) 双头, 或上述缺陷的任 何组合 颈部和中段的缺陷 : 中段非对称地接在头部 粗的或不规则 锐角弯曲 异常 细的中段, 或上述缺陷的任何组合 主段缺陷 : 短尾 多尾 断尾 发卡形平滑弯曲 锐角弯曲 宽度不规则 卷曲, 或上述缺陷的任何组合 过量残留胞浆 (ERC): 这是精子异常发生过程产生的异常精子所伴有的 这 类异常精子的特征是含有大量不规则已染色的细胞浆, 胞浆的大小超过精子 头部的三分之一, 通常同时有中段缺陷 (Mortimer & Menkveld,2001) 这种
78 第 2 章标准程序 55 异常的过量胞浆不应该被认为是胞浆小滴 (Cooper,2005) 1 胞浆小滴 ( 位于头 - 颈连接中段的膜相囊泡 ) 是人类精子有生理功能的正常成分 用相差显微镜 微分干涉差显微镜和 X 线显微镜, 对精液 宫颈黏液及培养液中的活精子进行观察, 如果胞浆小滴膨胀, 其胞浆小滴可能会沿着中段长轴延伸 (Abraham-Peskir et al.,2002;fetic et al.,2006) 2 胞浆小滴对渗透压很敏感, 并且在常规的空气干燥过程中不能很好地保留 (Chantler & Abraham-Peskir,2004;Cooper et al.,2004) 胞浆小滴在已染色的涂片中不明显, 它们看上去像是中段的延伸 在已固定并染色的涂片中, 胞浆小滴小于头部 1/3 大小, 则应该被认为是正常的 (Mortimer & Menkveld,2001) 2-13 人精子一些异常形态的示意图 (Adapted from Kruger et al.,1993 and reproduced by permission of MQ Medical.) 2.16 彩图 1~14 中的所有显微照片, 使用了上述严格的形态学分析标准进行评估 由于是依据精子的头部和尾部的诸多特征, 人为设定临界标准来判断正常和异常精子, 因此, 精子形态学分析具有主观性, 难以标准化 以下附彩图仅由一位专家 Dr Thinus Kruger 进行分析, 分析结果附有补充注释, 以确保异常精子标志的一致性 每张彩图对应一张表格, 表格中描述了每个精子形态学评估的结果 在表格中, 指明了头部形状正常或者异常, 以及除了形状外的其他头部异常情况 ; 颈部以
79 56 第一部分精液分析 及主段的形状是否正常 ; 全面考虑该精子是否正常 在表格 注释 中列出其他相 关评议 注释的进一步解释见表 精子形态学彩图中注释的解释 顶体 < 40% 顶体区小于精子头部的 40% 顶体 > 70% 顶体区大于精子头部的 70% > 1/3 异常的胞浆 ( 大于头部的 1/3)(ERC) < 1/3 正常的胞浆 ( 小于头部的 1/3)(CD) 异常 显而易见的异常 不定型 头部形状 ( 图 2-13d) 杆菌 细菌 (bacteria) 弯曲 不自然的折角 卷曲 显而易见的异常 CD 胞浆小滴 细胞浆 过量残留胞浆或者胞浆小滴, 取决于胞浆大小 退化的白细胞 显而易见的异常 退化的精子细胞 显而易见的异常 缺陷 显而易见的异常 双 显而易见的异常 上皮细胞 来自男性泌尿生殖管道 ERC 过多残留胞浆 扁平底 (flat) 精子头底部不是椭圆的 聚焦 焦距不准 ( 未评估 ) if PP OK 在显微视野中不能完全看见主段 ( 如果主段是正常的, 那么认为该精子是正常的 ) 插入 尾部插入头部长轴的一侧的位置 不规则 外形轮廓不规则 环状 尾部弯曲成环状 巨噬细胞 噬菌性白细胞 单核细胞 嗜碱性白细胞 精子细胞 未成熟的生精细胞 无顶体 顶体缺失 正常 类似在宫颈黏液中观察到的精子 未评估的 由于精子重叠或者聚焦不好 重叠 头部被尾部遮挡 PA vac 顶体后区有空泡 大头针状 不认为是精子, 无染色质 多形核白细胞 核分叶的白细胞 梨形 头部形状 ( 图 2-13b) 圆形 头部形状 ( 图 2-13c) 侧位 (side view) 精子呈现侧位像 小头 头部大小 精子细胞 未成熟的生精细胞 精母细胞 未成熟的生精细胞 锥形 头部形状 ( 图 2-13a) 粗 不言自明 太长 不言自明 vac 空泡 > 2vac 多于 2 个空泡
80 1 (Micrographs courtesy of C Brazil) 第 2 章标准程序 57
81 58 第一部分精液分析 1 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 正常 正常 正常 if PP OK 2 正常 正常 正常 if PP OK 3 正常 正常 正常 if PP OK 4 正常 正常 正常 if PP OK 5 正常 正常 正常 if PP OK 6 正常 正常 正常 if PP OK 7 正常 正常 正常 if PP OK 8 正常 正常 正常 if PP OK 9 正常 正常 正常 if PP OK 10 正常 正常 正常 if PP OK 11 正常 正常 正常 if PP OK 12 正常 正常 正常 if PP OK 13 正常 正常 正常 if PP OK 14 正常 正常 正常 if PP OK 15 正常 正常 正常 if PP OK 16 正常 正常 正常 if PP OK 17 正常 正常 正常 if PP OK 18 正常 正常 正常 if PP OK 19 正常 正常 正常 if PP OK 20 正常 正常 正常 if PP OK
82 2 (Micrographs courtesy of C Brazil) 第 2 章标准程序 59
83 60 第一部分精液分析 2 精子头部形状其他头部评估中段评估主段评估精子整体分类注释 1 异常粗双尾异常 2 异常不规则异常侧面观 3 异常 梨形 弯曲, 不规则, ERC 4 异常异常 5 异常梨形异常 6 异常异常 7 异常异常 8 异常粗异常 9 异常插入异常 10 异常异常 11 异常异常 12 异常梨形弯曲异常 13 异常 > 2vac,PA vac 异常 14 异常粗异常 异常 > 1/3 15 异常梨形粗,ERC 异常 > 1/3 16 异常梨形 ERC 异常 > 1/3 17 正常 PA vac 异常 18 异常粗, 插入异常 19 异常异常异常 20 异常粗异常 21 异常粗异常 22 异常异常 23 异常异常 24 正常 > 2vac 粗异常 25 异常粗, 弯曲异常 26 异常粗异常 27 异常顶体区 > 70% 粗异常 28 异常粗异常 29 异常粗异常 30 异常粗异常 31 异常梨形粗异常 32 异常小头粗异常 33 异常小头粗异常 34 异常 ERC 异常 > 1/3 35 异常粗异常 36 异常粗异常
84 3 (Micrographs courtesy of C Brazil) 第 2 章标准程序 61
85 62 第一部分精液分析 3 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 异常 锥形 粗 异常 2 异常 异常 3 异常 不规则 异常 4 异常 圆形 异常 5 异常 圆形 异常 6 异常 锥形 异常 7 异常 锥形 异常 8 异常 不定形 粗 异常 9 异常 圆形 粗 异常 10 异常 锥形 不规则, 粗 异常 11 两个精子 12 异常 > 2vac,PA vac 异常 13 异常 异常 14 正常 PA vac 异常 15 大头针状 16 异常 小头 异常 17 异常 大头 异常 18 正常 粗 异常 19 异常 粗 异常 20 异常 > 2vac 插入 异常 21 正常 顶体区 > 70% 异常 22 异常 顶体区 > 70% 异常 23 异常 顶体区 < 40%, 小头 异常 24 异常 顶体区 < 40%, 小头 异常 25 异常 顶体区 < 40%, 小头 异常 26 异常 顶体区 > 70% 异常 27 异常 顶体区 < 40%,> 2vac 不规则 异常 28 正常 > 2vac 异常 29 异常 锥形 异常 30 异常 锥形 异常 31 异常 锥形 异常 32 正常 粗 异常 33 正常 粗 异常 34 异常 顶体区 < 40% 粗 异常 35 异常 粗, 弯曲 异常 36 大头针状
86 4 (Micrographs courtesy of C Brazil) 第 2 章标准程序 63
87 64 第一部分精液分析 4 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 异常 扁平底 粗 异常 2 正常 粗, 弯曲 异常 3 正常 粗 异常 4 正常 粗, 弯曲 异常 5 正常 粗 异常 6 正常 粗 异常 7 异常 不规则 异常 8 正常 粗 异常 9 正常 插入, 弯曲 异常 10 正常 粗, 弯曲 异常 11 异常 PA vac 异常 12 异常 异常 13 异常 顶体区 < 40%,> 2vac 粗 异常 14 正常 不规则 异常 15 正常 插入 异常 16 正常 粗 异常 17 正常 插入, 粗 异常 18 正常 粗, 太长 异常 19 正常 顶体区 < 40% 插入 异常 20 正常 顶体区 < 40% 不规则 异常
88 5 (Micrographs courtesy of C Brazil) 第 2 章标准程序 65
89 66 第一部分精液分析 5 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 异常 ERC 异常 > 1/3 2 正常 弯曲 正常 异常 3 异常 顶体区 > 70% 环状 异常 4 正常 弯曲 正常 异常 5 正常 粗 环状 异常 6 异常 PA vac 卷曲 异常 7 正常 正常 8 正常 双尾 异常 9 异常 卷曲 异常 10 异常 弯曲, 插入 卷曲 异常 11 正常 粗 弯曲 异常 12 正常 弯曲 正常 异常
90 6 (Micrographs courtesy of C Brazil) 第 2 章标准程序 67
91 68 第一部分精液分析 6 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 正常 顶体区 < 40% 粗 正常 异常 2 正常 粗 异常 3 正常 正常 4 异常 粗 异常 5 异常 锥形 异常 6 未分类 异常精子 7 异常 粗 卷曲 异常 8 上皮细胞 9 正常 粗, 插入 异常 10 异常 顶体区 < 40% 粗 异常 11 正常 粗 异常 12 退化巨噬细胞? 13 多形核白细胞 14 异常 梨形 异常 15 正常 正常 16 异常 顶体区 < 40% 异常 17 异常 圆形 未见 异常 仅有头? 18 异常 粗 异常 19 正常 正常 20 正常 正常 if PP OK 21 异常 扁平底 异常 22 杆菌 23 正常 粗 异常 24 正常 粗 卷曲 异常 25 异常 不定型 异常 26 精子细胞 27 多形核白细胞
92 7 (Micrographs courtesy of C Brazil) 第 2 章标准程序 69
93 70 第一部分精液分析 7 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 正常 2 vac 正常 2 正常 正常 3 正常 粗 异常 4 正常 正常 5 正常 正常 if PP OK 6 正常 粗 异常 7 正常 表面有空泡 正常 8 正常 CD 正常 < 1/3 9 异常 粗,ERC 异常 > 1/3 10 正常 正常 11 正常 PA vac 环状 异常 12 正常 正常 if PP OK 13 正常 PA vac 异常 14 正常 PA vac 异常 15 异常 顶体区 < 40% 粗 异常 16 异常 顶体区 < 40% 异常 17 正常 正常 18 正常 正常 if PP OK 19 正常 粗 短 异常 20 异常 粗 异常 21 正常 > 2vac 异常 22 异常 圆形 异常 23 异常 圆形 异常 24 正常 正常 25 在细胞浆中有精子头? 26 正常 正常 27 正常 无顶体 卷曲 异常 28 正常 正常 29 异常 圆形 异常 30 正常 PA vac 异常 31 异常 锥形,PA vac 异常 32 正常 正常 if PP OK 33 正常 正常 34 正常 正常 if PP OK 35 异常 粗 弯曲 异常 36 正常 正常 if PP OK 37 正常 正常 if PP OK 38 异常 圆形 异常 39 正常 正常 40 正常 正常 41 正常 正常 42 正常 粗 异常 43 正常 顶体区 < 40% 异常 44 聚焦不好 未评估 45 异常 圆形 异常 46 异常 圆形 异常 47 正常 正常 48 正常 正常 if PP OK
94 8 (Micrographs courtesy of C Brazil) 第 2 章标准程序 71
95 72 第一部分精液分析 8 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 正常 正常 正常 2 正常 > 2vac 正常 异常 3 异常 锥形 异常 4 正常 正常 正常 5 正常 正常 6 正常 正常 if PP OK 7 正常 正常 if PP OK 8 正常 粗 异常 9 正常 正常 10 正常 正常 11 正常 PA vac 异常 12 正常 正常 13 异常 异常 14 正常 正常 if PP OK 15 异常 不定型 缺陷 异常 16 正常 正常 if PP OK 17 异常 顶体区 > 70% 粗,ERC 异常 > 1/3 18 正常 正常 19 大头针状 20 正常 正常 21 正常 PA vac 异常 22 异常 锥形 粗,ERC 异常 > 1/3 23 异常 扁平底 粗 异常 24 正常 > 2vac 异常 25 异常 圆形 异常 26 正常 粗 异常 27 正常 粗 异常 28 正常 > 2vac, 顶体区 > 70% 异常 29 异常 异常 30 正常 顶体区 > 70% 异常 31 异常 梨形 异常
96 9 (Micrographs courtesy of C Brazil) 第 2 章标准程序 73
97 74 第一部分精液分析 9 精子头部形状其他头部评估中段评估主段评估精子整体分类注释 1 异常卷曲异常 2 重叠未评估 3 异常顶体区 < 40% 异常 4 正常正常 if PP OK 5 正常正常 if PP OK 6 正常顶体区 > 70% 插入异常 7 正常插入异常 8 正常顶体区 > 70% 插入异常 9 异常 PA vac 异常 10 正常 > 2vac 粗异常 11 异常粗,ERC 异常 > 1/3 12 异常 粗, 插入, ERC 异常 > 1/3 13 正常正常 if PP OK 14 异常粗异常 15 正常正常正常 16 异常异常 17 异常锥形,3vac,PA vac 异常 18 正常正常 19 异常空泡 > 20% 异常 20 异常锥形异常 21 正常 PA vac 异常 22 异常不定型弯曲异常 23 异常锥形双尾异常 24 异常 PA vac 异常 25 正常 > 2vac 异常 26 正常正常 if PP OK 27 正常正常 28 正常正常 if PP OK 29 重叠未评估 30 重叠未评估 31 正常正常 if PP OK 32 正常正常 if PP OK 33 正常正常 if PP OK 34 正常粗粗, 卷曲异常 35 异常一侧非椭圆形异常 36 正常顶体区 < 40% 异常 37 重叠未评估
98 10 (Micrographs courtesy of C Brazil) 第 2 章标准程序 75
99 76 第一部分精液分析 10 精子头部形状其他头部评估中段评估主段评估精子整体分类注释 1 正常 插入 异常 2 正常 正常 if PP OK 3 异常 梨形 异常 4 正常 正常 5 正常 粗 异常 6 异常 梨形 ERC 弯曲 异常 > 1/3 7 正常 正常 8 正常 正常 9 正常 3vac 异常 10 异常 锥形 粗,ERC 异常 > 1/3 11 异常 锥形, 顶体区 < 40% 弯曲 异常 12 单核细胞 13 多形核白细胞 14 多形核白细胞 15 单核细胞 16 异常 锥形 异常 17 正常 正常 if PP OK 18 正常 正常 19 正常 正常 20 正常 正常 if PP OK 21 异常 不定形 异常 22 正常 正常 if PP OK 23 异常 锥形 粗 弯曲 异常 24 重叠 未评估 25 异常 锥形 异常 26 异常 不定形 粗,ERC 异常 > 1/3 27 正常 粗 异常 28 异常 不定形 粗 异常 29 异常 PA vac 异常 30 异常 粗 异常 31 异常 粗 卷曲 异常 32 正常 粗 异常 33 重叠 未评估 34 重叠 未评估 35 异常 不定形, 无顶体 粗 异常 36 正常 顶体区 < 40% 异常 37 异常 梨形 粗 双尾 异常 38 正常 正常 if PP OK 39 正常 粗 异常 40 异常 顶体区 < 40% 异常 41 异常 粗 弯曲 异常 42 正常 正常 if PP OK 43 正常 2vac, 顶体区 < 40% 异常 44 正常 正常 45 异常 粗,ERC 异常 > 1/3 46 异常 粗 异常
100 11 (Micrographs courtesy of C Brazil) 第 2 章标准程序 77
101 78 第一部分精液分析 11 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 异常 插入 异常 2 异常 插入 异常 3 正常 粗 环状 异常 4 正常 正常 5 异常 > 2vac, 顶体区 < 40% 粗 异常 6 正常 环状 异常 7 异常 插入 异常 8 正常 环状 异常 9 异常 顶体区 > 70%, 锥形 异常 10 异常 锥形 异常 11 正常 粗 异常 12 异常 锥形 异常 13 正常 顶体区 < 40% 粗 异常 14 异常 锥形 粗,ERC 异常 > 1/3 15 异常 锥形 粗 异常 16 异常 锥形 异常 17 异常 不定形 粗 异常 18 正常 正常 19 正常 异常 20 异常 异常 21 异常 异常 22 正常 顶体区 > 70% 环状 异常 23 正常 正常 24 正常 正常 25 多形核白细胞 26 正常 正常 27 正常 正常 28 正常 顶体区 > 70% 异常 29 单核细胞 30 多形核白细胞 31 单核细胞 32 多形核白细胞 33 单核细胞
102 12 (Micrographs courtesy of C Brazil) 第 2 章标准程序 79
103 80 第一部分精液分析 12 精子 头部形状 其他头部评估 中段评估 主段评估 精子整体分类 注释 1 正常 顶体区 > 70% 异常 2 异常 异常 3 异常 顶体区 > 70% 异常 4 正常 正常 if PP OK 5 异常 粗 异常 6 异常 锥形 异常 7 聚焦不好 粗 未评估 8 异常 粗, 弯曲 异常 9 退化的白细胞 10 异常 粗 异常 11 异常 圆形 卷曲 异常 12 正常 正常 13 异常 锥形 弯曲 异常 14 异常 插入 异常 15 多形核白细胞 16 异常 不定形 异常 17 异常 卷曲 异常 18 异常 粗 卷曲 异常 19 正常 双尾 异常 20 异常 粗 异常 21 重叠 未评估 22 异常 梨形 异常 23 正常 正常 24 异常 异常 大头针状 25 异常 不定型 弯曲 异常 26 异常 不定型 粗, 弯曲 异常 27 正常 粗 异常 28 正常 正常 if PP OK 29 异常 锥形 异常 30 异常 圆形 异常 31 正常 弯曲 重叠 未评估 32 正常 粗, 弯曲 异常 33 异常 异常 34 异常 异常 35 正常 弯曲 异常 36 多形核白细胞 37 多形核白细胞 38 多形核白细胞
104 13 (Micrographs courtesy of C Brazil) 第 2 章标准程序 81
105 82 第一部分精液分析 13 细胞 细胞类型 1 巨噬细胞 2 异常精子 3 细胞浆 4 异常精子 5 精母细胞 6 异常精子 7 异常精子? 在胞浆中有松散的精子头? 8 细胞浆 9 分裂中的精子细胞 10 精母细胞 11 退化的精子细胞 12 精子细胞 13 退化的精子细胞 14 分裂中的精母细胞 15 细胞浆 16 退化的精子细胞 17 分裂中的精母细胞 18 异常精子 19 细胞浆 20 异常精子 21 精子细胞 22 正在吞噬的巨噬细胞 23 精母细胞 24 细胞浆
106 14 (Micrographs courtesy of C Brazil) 第 2 章标准程序 83
107 84 第一部分精液分析 14 细胞 细胞类型 1 巨噬细胞 2 异常精子 3 ( 分裂中的 ) 精子细胞 4 ( 分裂中的 ) 精子细胞 5 细胞浆 6 未分类 7 退化的精子细胞 8 退化的精子细胞? 9 退化的精子细胞 10 退化的精子细胞 11 巨噬细胞 12 退化的精子细胞 13 退化的精子细胞 14 退化的精子细胞 15 退化的精子细胞 16 巨噬细胞 确定正常精子的比例可能已足够了 应用精子形态评估的示范图片来考虑 每个精子的功能区域 不需要区分出所有的精子头部大小 形状, 以及中段和主 段的变异 有顺序地选择涂片的几个区域, 对每个可评估的精子进行形态分析 以防止 有偏差地选择特殊的精子 用亮视野, 在 1000 倍油镜下观察涂片 从一个视野移到另一个视野, 评估每个视野中所有的精子 在每张重复涂片至少评估 200 个精子, 以达到可接受的低抽样误差 ( 方框 2-5) 借助实验室计数器, 记录正常和异常精子的数目 最好在另一张重复涂片上, 但是也可选择同一张涂片, 重复评估至少 200 个 精子
108 第 2 章标准程序 85 由两份独立的重复评估获得的数值, 比较正常形态精子的百分率 从重复评估获得两个正常形态精子百分率, 计算平均值及差异值 根据表 2-1 或图 A7-2 附录 7 来确定差异的可接受性 ( 每个数值显示, 预期发 生在 95% 的标本中, 仅由于取样误差所致的两个百分率之间的最大差异 ) 如果差异值是可接受的, 报告正常形态精子百分率的平均值 ; 如果差异值太 大, 则重复评估相同的涂片 ( 方框 2-6) 以最接近的整数报告平均正常形态精子百分率 1 仅评估具有头部和尾部的完整精子 ( 见 节 ), 因为在精子浓度计数 时只计数完整的精子 不计数未成熟的生殖细胞 ( 圆细胞 ) 2 不应评估重叠的精子和头部枕在其他颗粒边缘的精子, 这些精子不能很好地被评估 在一张好的涂片中不应该存在这些精子 ( 见 节 ), 但是可能发生在碎片和颗粒物较多的标本涂片中 ( 如黏稠精液, 见 节 ) 这样的标本应进行洗涤 ( 见 节 ), 并且在染色前检查涂片 重复计数 200 个精子, 正常形态精子百分率分别为 18% 和 9% 它们的平均值为 14%, 差异值为 9% 从表 2-1 可见, 当平均值为 14% 时, 预期的随机误差为 7% 由于所评估的差异值超过此值, 摒弃结果并重新评估重复涂片 2 重复计数 200 个精子, 正常形态精子百分率分别为 10% 和 14% 它们的平均值为 12%, 差异值为 4% 从表 2-1 可以看出, 当平均值为 12% 时, 预期的随机误差为 7% 因为所评估的差异值小于此值, 结果可以接受, 报告平均值, 即正常形态精子百分率为 12% 正常形态精子的参考值下限为 4%( 第 5 个百分位数,95% 可信区间 3.0~4.0) 精液中, 形态正常精子的总数更具有生物学意义 精液中精子总数乘以正常形态精子百分率 ( 见 节 ) 得出正常形态精子的总数 对所有异常形态精子进行分类, 可能对诊断或研究工作是有益的 如果需要, 注明缺陷的种类, 并且计算包括精子头部 (%H) 中段 (%M) 或主段 (%P) 缺陷, 以及过量残留胞浆 (%C) 的精子百分率 可以使用多键计数器, 分别用一个键代表正常 异常以及 4 种异常类型 (H M P C) 的一种 这样的计数器对每个精子只计数一次, 并且每种缺陷被单独记录 通过对 400 个精子的分析, 可以得到正常和异常精子百分率 ( 两者相加应等于 100%), 也可以得到每种缺陷的百分率, 例如精子头部 (%H) 中段 (%M) 尾部 (%P), 以及过量残留胞浆 (%C)( 这些数值相加不等于 100%)
109 86 第一部分精液分析 精子各类缺陷的百分率可以由某种缺陷的精子总数除以所评估的正常和异常精子总数 100 获得 这些数据也可以用来评估多重缺陷指数 ( 见 3.1 节 ) 使用 6 键的分类计数器记录 200 个精子, 第一次计数, 评估出 42 个正常精子和 158 个异常精子 在这 158 个异常精子中,140 个头部异常,102 个中段异常,30 个主段异常,44 个过多残留胞浆 第二次重复计数, 评估出 36 个正常精子和 164 个异常精子 在这 164 个异常精子中,122 个头部异常,108 个中段异常, 22 个主段异常,36 个过多残留胞浆 对精子正常形态结果的两次重复计数的可接受性进行比较, 第一次正常精子是 21%, 第二次是 18%, 平均值为 19.5%( 四舍五入至 20%), 差异值为 3% 从表 2-1 可见, 当平均值为 20% 时, 预期的随机误差最多相差 8% 因为分析结果的差异值小于此值, 结果可以接受, 报告平均值 : 正常形态 ( )/400 = 20%, 头部异常 ( )/400 = 66%, 中段异常 ( )/400 = 53%, 主段异常 ( )/400 = 13%, 过多残留胞浆 ( )/400 = 20% 由于每种缺陷是被单独计数, 并且有些精子具有多种类型缺陷, 所以这些种类的缺陷相加不等于 100% 有一种更详细的异常精子的分析方法, 综合了每个异常精子的每个区域 中的异常数目的各种指数, 在 节进行描述 有时, 很多精子呈现一种特定的结构性缺陷, 例如顶体发育异常, 导致 小圆头缺陷 或者 圆头精子症 在精子排放阶段, 如果基底板不能与顶体对侧极的核附着时, 头部被吸收, 在精液中仅见到精子尾部 ( 大头针状缺陷 ) 1 大头针状头 ( 游离尾部 ) 不能作为头部缺陷计数, 因为它基底板前没有染色质或头部结构 2 游离尾部 ( 大头针状 ) 或者仅有头部不能作为精子 ( 定义有头和尾, 见 节 ) 计数, 因此也不能认为是异常精子 当一男性所有精子都显示为这些缺陷中的一种时, 通常是不育的 虽然这样的病例很少见, 但是重要的是鉴别它们并正确报告这种情况 报告存在的特定精子缺陷, 例如 : 无尾精子头, 大头针状精子 ( 游离尾部 ), 头部无顶体 如果有很多这样的特定缺陷, 可以计算出它们相对于精子的发生率 假设在评估 400 个精子的相同数目视野中, 所观察到特定缺陷精子为 N 个,S 为精子浓度 (10 6 /ml), 特定缺陷的精子浓度 (C)(10 6 /ml) 可以通过公式 C = S (N/400) 计算得出
110 第 2 章标准程序 大多数人精液中存在白细胞, 主要是多形核白细胞 (PMN, 中性粒细胞 ) (Tomlinson et al.,1993;johanisson et al.,2000) 有时可以通过巴氏染色方法, 将 白细胞与精液涂片的精子细胞和精母细胞区分开来 ( 见 节 ) 分辨白细胞 主要基于着色 核的大小及形态的不同 (Johanisson et al.,2000)( 附彩图 和 14) 多形核白细胞在形态学上容易与多核精子细胞混淆, 但是多 形核白细胞染色呈浅蓝色, 而精子细胞呈浅红色 (Johanisson et al.,2000) 核的 大小也有助于鉴别 : 单核白细胞核大小的波动范围较大, 从大约 7μm 的淋巴细 胞, 到大于 15μm 的巨噬细胞 这些大小仅作为参考, 因为退化和分裂会影响核 的大小 还有几种技术可以定量测出精液中白细胞的数目 由于过氧化物酶阳性的 粒细胞是精液中主要类型的白细胞, 因此过氧化物酶活性的常规分析法有助于白 细胞初筛 (Wolff,1995;Johanisson et al.,2000)( 见 节 ) 另外, 可通过更耗时和更耗资的针对普通白细胞抗原和精子抗原的免疫细 胞化学测定技术来鉴别白细胞 (Homyk et al.,1990;eggert-kruse et al.,1992)( 见 3.2 节 ) 原理 该方法快速 价廉, 是一种实用的粒细胞初筛方法 计数人精液中白细胞的传统方法是用组织化学方法鉴定粒细胞特有的过 氧化物酶 ( 图 2-14) 虽然这种技术有相对易于操作的优点, 但它不能检测以下 情况 : 已经激活并释放其颗粒的多形核白细胞 ; 其他不含过氧化物酶的白细胞类型, 如淋巴细胞 巨噬细胞和单核细胞 这项试验可用于鉴别多形核白细胞与不含过氧化物酶的多核精子细胞 (Johanisson et al.,2000) 以下测定均以 Nahoum & Cardozo(1980) 建立的方法为 基础 此试验已有商品化的试剂盒 试剂 mmol/L,pH6.0 的磷酸盐缓冲液 : 将 9.47g 磷酸氢二钠 (Na 2HPO 4) 溶于 1000ml 纯水中, 将 9.08g 磷酸二氢钾 (KH 2PO 4) 溶于另一 1000ml 纯水中 然后将一种溶液加入到另一种溶液中直至 ph 值为 6.0( 约 12ml 的 Na 2HPO 溶液加入到 88ml 的 KH 2PO 4 溶液中 ) 饱和氯化铵 (NH 4Cl) 溶液 : 将 250g NH 4Cl 加入到 1000ml 的纯水中 148mmol/L 的乙二胺四乙酸二钠 (Na 2EDTA) 溶液 : 将 50g/L Na 2EDTA 溶入步骤 1 准备好的磷酸盐缓冲液 (ph6.0) 中
111 88 第一部分精液分析 2-14 人精液中过氧化物酶阳性与阴性细胞 P: 过氧化物酶阳性的粒细胞 ( 棕褐色 );N: 过氧化物酶阴性的圆细胞 ( 比例尺 :10μm)(Micrograph courtesy of TG Cooper) 底物 : 将 2.5mg 邻甲苯胺溶于 10ml 的 0.9%(9g/L) 生理盐水中 30%(v/v) 过氧化氢 (H 2O 2) 溶液 : 购买成品 工作液 : 往 9ml 邻甲苯胺底物中加入 1ml 饱和 NH 4Cl 溶液 1ml 148mmol/L Na 2EDTA 溶液及 10μl 30%(v/v)H 2O 2 溶液, 充分混匀 该溶液配制后可使用 24 小时 国际癌症研究机构 (IARC,1982) 已声明, 邻甲苯胺在实际操作过程中应 将其视为对人类有致癌的危险 应采取适当的防护措施 ( 见附录 2) 步骤 充分混匀精液样本 ( 方框 2-3) 取 0.1ml 精液并与 0.9ml 工作液混合 [1 + 9(1 10) 稀释 ] 涡旋振荡精子悬液 10 秒钟, 并在室温下放置 20~30 分钟 或者使用试管摇动装置持续摇动 重复样本与工作液混匀 取样前, 再次混匀精液标本 在血细胞计数板上检测过氧化物酶阳性细胞的数目 ~30 分钟后, 再次混匀精子悬液, 并将双份重复样本分别充填计数板两侧的计数池 室温下将血细胞计数板水平置于湿盒内至少 4 分钟 ( 例如放在有盖的培养皿内的浸透水的滤纸上 ), 这样可以防止干燥, 使细胞沉降 用放大 200 或 400 倍的相差显微镜检查计数池 每份重复样本至少计数 200 个过氧化物酶阳性细胞, 以达到可以接受的低取样误差 ( 方框 2-7 和表 2-2) 过氧化物酶阳性细胞被染成棕褐色, 而过氧化物
112 第 2 章标准程序 89 酶阴性细胞不着色 ( 见 2.14 节 ) 5. 检查计数池时, 逐网格地持续至少计数 200 个过氧化物酶阳性细胞, 必须计数完整的网格不要在格的中间停止计数 6. 记录评估达到至少 200 个过氧化物酶阳性细胞的网格数 在血细胞计数板的另一个计数池中也要计数相同的网格数 7. 用实验室计数器记录过氧化物酶阳性细胞数和网格数 8. 转换至血细胞计数板的第二个计数池, 计数与第一个计数池相同的网格数, 即使这些网格的过氧化物酶阳性细胞少于 200 个 9. 计算两次过氧化物酶阳性细胞数的总数及差异 10. 根据表 2-5 或图 A7-1 附录 7 来确定差异的可接受性 ( 每个数值显示, 预期发生在 95% 的标本中, 仅由于取样误差所致的两次计数之间的最大差异 ) 11. 如果差异是可接受的, 则可计算浓度 ( 见 节 ) 如果差异太大, 则准备两份新的稀释样本, 重新对重复样本评估 ( 方框 2-10) 12. 以保留两位有效数字报告过氧化物酶阳性细胞的平均浓度 13. 计算每份精液标本的过氧化物酶阳性细胞总数 ( 见 节后面的评述 ) 精液中过氧化物酶阳性细胞浓度的计算精液中过氧化物酶阳性细胞浓度等于检测到的细胞数目 (N) 除以计数重复样本的全部网格数目 (n) 的容积 ( 这里 1 个网格的容积为 100nl), 再乘以稀释因子 如果以 1 + 9(1 10) 稀释, 则浓度计算为 C =(N/n) (1/100) 10 细胞 /nl = (N/n) (1/10) 细胞 /nl 这样过氧化物阳性细胞浓度(10 6 细胞 /ml) 为 (N/n) (1/10) 细胞 /nl 当血细胞计数板的每个计数池的所有 9 个网格全部被评估时, 过氧化物酶阳性细胞总数除以两个计数池的容积 (1.8μl), 再乘以稀释因子 (10), 即可得到每 μl 的细胞数 (10 3 细胞 /ml) 这种方法可以用于计算圆细胞浓度, 计算时所计数的圆细胞 ( 过氧化物酶阳性和阴性 ) 总数为 N 方法的灵敏度如果计数池中的过氧化物酶阳性细胞数少于 200 个, 取样误差将超过 5% 当两个计数池所有网格中少于 400 个过氧化物酶阳性细胞时, 应报告所计数的细胞数目的取样误差 ( 表 2-2) 如果每个计数池中所计数的过氧化物酶阳性细胞数少于 25 个, 浓度将 < /ml; 当评估改良 Neubauer 计数板的全部 9 个网格, 并且采用 1 + 9(1 10) 稀释时, 取样误差的量化下限为 20%(Cooper et al.,2006) 报告评估的过氧化物酶阳性细胞数目, 并注明 : 细胞数太少, 不能准确测定浓度 (< /ml) 检测样本中未观察到过氧化物酶阳性细胞, 并不代表着其余标本中也不含该种细胞
113 90 第一部分精液分析 样例 1 用 1 + 9(1 10) 稀释, 计数池 1 的 9 个网格中观察到 60 个过氧化物酶阳性细胞, 而计数池 2 的 9 个网格中有 90 个过氧化物酶阳性细胞 在 18 个网格中, 这两个数值之和 ( ) 为 150 个, 这两个数值之差 (90 60) 为 30 从表 2-5 可见, 已超出预期的随机误差 (24), 应摒弃结果, 重新检测重复样本 2 用 1 + 9(1 10) 稀释, 计数池 1 的 5 个网格中观察到 204 个过氧化物酶阳性细胞, 而计数池 2 的 5 个网格中有 198 个过氧化物酶阳性细胞 在 10 个网格中, 这两个数值之和 ( ) 为 402 个, 这两个数值之差 ( ) 为 6 从表 2-5 可见, 小于预期的随机误差 (39), 因此这组数据可以接受 1 + 9(1 10) 稀释, 此样本过氧化物酶阳性细胞的浓度为 C =(N/n) (1/10) 细胞 /nl =(402/10)/10 = 4.02 细胞 /nl, 或 细胞 /ml( 保留两位有效数字 ) 3 用 1 + 9(1 10) 稀释, 计数池 1 的 9 个网格中观察到 144 个过氧化物酶阳性细胞, 而计数池 2 的 9 个网格中有 162 个过氧化物酶阳性细胞 在 18 个网格中, 这两个数值之和 ( ) 为 306 个, 这两个数值之差 ( ) 为 18 从表 2-5 可见, 小于预期的随机误差 (34), 因此这组数据可以接受 当评估每个计数池的全部 9 个网格时, 以 1 + 9(1 10) 稀释, 标本的浓度为 C =(N/1.8) 10/μl =(306/1.8) 10 = 1700 细胞 /μl, 或 细胞 /ml( 保留两位有效数字 ) 由于计数少于 400 个细胞, 应报告表 2-2 中 306 个细胞所对应的取样误差 ( 约 6%) 4 用 1 + 9(1 10) 稀释, 两个计数池中均未观察到过氧化物酶阳性细胞 由于在全部 9 个网格中计数少于 25 个过氧化物酶阳性细胞, 所以浓度为 < /ml; 应报告为 样本中未见过氧化物酶阳性细胞 细胞数过少, 不能准确测定浓度 (< /ml) 参考值目前还没有来自有生育力男性精液中过氧化物酶阳性细胞的参考范围 在有更多的证据之前, 本手册仍保留多数人意见, 将过氧化物酶阳性细胞浓度的临界值定为 /ml 1 精液中过氧化物酶阳性细胞总数可以反映炎症情况的严重性 (Wolff, 1995) 过氧化物酶阳性细胞总数可以通过过氧化物酶阳性细胞浓度乘以精液的体积得出 2 已报道有生育力男性过氧化物酶阳性细胞临界值的变化范围为 :PMN 白细胞浓度 到 /ml 或总的白细胞浓度从 到 /ml (Wolff,1995) 本手册以前版本取 /ml 作为白细胞精子症的临界值 取决于所检测的终点 (endpoint) 检测结果 ( 精液质量 IVF 体外受精的结局 有细菌存在 精子对活性氧的反应 ), 有些作者认为这个数值太低 (Wolff,1995), 而其他作者认为这个数值太高 (Sharma et al.,2001;punab et al.,2003)
114 第 2 章标准程序 91 3 精液中白细胞数目过高 ( 白细胞精子症 脓精子症 ) 可能伴有感染和精 子质量差 4 由白细胞导致的精子损伤取决于精液中的白细胞总数和相对于精子数 的白细胞数 5 白细胞可能通过氧化应激影响精子活力和 DNA 完整性 ( 见 4.1 节 ) 然而, 已观察到白细胞浸润的程度是否引起损伤取决于很多因素, 仅从一份精液标本难以推测, 例如浸润发生的原因 时间 解剖部位, 涉及的白细胞类型, 以及它们是否处于激活状态 (Tomlinson et al.,1993;aitken & Baker,1995;Rossi & Aitken,1997) 2.19 生精细胞包括圆形的精子细胞和精母细胞, 但很少有精原细胞 可以在染色的精液涂片中检测这些细胞, 但细胞退化时, 很难将其与炎性细胞区分开来 用巴氏染色的精液涂片, 通常可以将精子细胞 精母细胞与白细胞区分开来 (Johanisson et al.,2000)( 见 节 ) 鉴别主要基于着色 核的大小和形态 ( 附彩图 和 14) 细胞内缺乏过氧化物酶 ( 见 2.18 节 ) 以及缺乏白细胞特异性抗原 ( 见 3.2 节 ) 多核精子细胞在形态学上容易与多形核白细胞混淆, 但其染色呈浅红色, 而多形核白细胞略带蓝色 (Johanisson et al.,2000) 圆形精子细胞可以通过对发育中顶体进行特异性染色 (Couture et al.,1976), 或用凝集素 ( 见 节 ) 特异性抗体 (Homyk et al.,1990;ezeh et al.,1998) 来鉴别 细胞核的大小也有助于鉴别 : 精原细胞 ( 精液中很少见 ) 的核约为 8μm, 精母细胞的核约为 10μm, 而精子细胞的核约为 5μm 由于退化和分裂会影响核的大小, 故上述核的大小仅供参考 2.20 如果精子显示出凝集 ( 例如, 活动精子以头 - 头 尾 - 尾或混合的形式相互黏附 )( 见 节 ), 精子抗体的存在可能是其原因 1 没有出现精子凝集, 也可能存在精子抗体 ; 同样地, 精子凝集可以由其他非精子抗体因素引起 2 仅凭存在精子抗体, 对诊断精子自身免疫是不够的 有必要证明抗体严重干扰精子功能 ; 通常可以应用精子 - 宫颈黏液穿透试验来检测 ( 见 3.3 节 ) 抗体也能够干扰透明带结合和顶体反应 精液中的抗精子抗体 (ASAs) 几乎都是属于两类免疫球蛋白 :IgA 和 IgG
115 92 第一部分精液分析 IgM 抗体由于其分子量较大, 在精液中极少发现 IgA 抗体可能比 IgG 抗体更具有重要的临床意义 (Kremer & Jager,1980) 应用相关的筛查试验, 可以在精子表面或体液中检测出这两类抗体 精子表面抗体的试验 ( 直接试验 ) 以下介绍两种直接试验: 混合抗球蛋白反应 (MAR) 试验 ( 见综述,Bronson et al.,1984) 和免疫珠 (IB) 试验 (Bronson et al.,1982;clarke et al.,1982,1985) MAR 试验采用新鲜精液标本, 而 IB 试验采用洗涤过的精子 这两种试验的结果并不总是一致 (MacMillan & Baker,1987; Scarselli et al.,1987;meinertz & Bronson,1988;Hellstrom et al.,1989), 但 IB 试验的结果与检测血清抗体的制动试验的结果相关性很好 IB 试验和 MAR 试验的实验方案有些不同, 但这两种试验的精子 / 微珠制备均在显微镜下检查 微珠黏附于带有表面结合抗体的活动和不活动精子上 ; 记录黏附有微珠活动精子的百分率 检测没有精子的体液 ( 例如, 精浆 血清 溶解的宫颈黏液 ) 中抗精子抗体的试验 ( 间接 试验 ) 在这些试验中, 怀疑含有抗精子抗体的灭活和稀释的体液, 与没有抗体 洗涤去除了精浆的供者精子相孵育 在可疑体液中的任何抗精子抗体会特异地结合到供者精子上, 然后采用上述介绍的直接试验来检测精子 因为需要 10 分钟时间可以观察到混合凝集, 为了获得可靠结果, 让精子 - 抗体相互作用充足时间是重要的 但是, 应该注意精子活力随时间而下降, 而这些试验取决于有活动精子存在 1 这里介绍的两种抗精子抗体试验有商品化试剂 这两种试验取决于有活动精子存在 如果没有足够的活动精子, 应该使用检测精浆或血清的间接试验 2 不能使用这些试验来检测可以杀死全部精子或抑制精子活力的细胞毒 性抗体 混合抗球蛋白反应 (MAR) 试验是一项廉价的 快速和敏感的筛查试验 (Rajah et al.,1992), 但它提供的信息少于直接免疫珠试验 ( 见 节 ) 在 MAR 试验, 桥连 抗体 ( 抗 IgG 或抗 IgA) 将包被了抗体的微珠带去与精液中未洗涤精子表面露出的 IgG 或 IgA 相接触 直接 IgG 和 IgA 的 MAR 试验, 是用未经处理的新鲜精液, 与包被人 IgG 或 IgA 的乳胶颗粒 ( 微珠 ) 或处理过的红细胞相混合 向悬浮液中加入特异性的抗人 IgG 或抗人 IgA 颗粒与活动精子之间形成混合凝集, 提示精子表面存在 IgG 或 IgA 抗体 ( 微珠之间的凝集作为抗体 - 抗原识别的阳性对照 ) 步骤 充分混匀精液标本 ( 方框 2-3) 吸取 3.5µl 精液 2 份, 分别滴在 2 张载玻片上 每次直接试验, 包括 1 张滴上 3.5µl 抗精子抗体阳性精液玻片和 1 张滴上抗
116 第 2 章标准程序 精子抗体阴性精液玻片作为对照 对照精液应该分别从先前直接 MAR 试验显示带有和不带有抗精子抗体的男性中获取 另一种方法是通过与已知含有抗体的血清相孵育来产生阳性精子 ( 见 节 ) 加 3.5µl 包被了 IgG 的乳胶颗粒 ( 微珠 ) 至每滴待测精液和对照精液中, 并用移液器吸头搅匀 加 3.5µl 抗人 IgG 抗血清至每滴精液 - 微珠混合液中, 并用移液器头搅匀 在混合液上放置盖玻片 (22mm 22mm), 以使液层深度约为 20µm( 方框 2-4) 室温下在湿盒内水平放置玻片 3 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免干燥 3 分钟后, 用相差显微镜, 在 200 或 400 倍镜下检查湿片 10 分钟后再检查 1 次 用包被 IgA 的微珠替代包被 IgG 的微珠, 用抗 IgA 抗体替代抗 IgG 抗体, 重复上述步骤 评分如果精子表面有抗体, 乳胶微珠会黏附到精子上 开始时会看到, 活动精子附着几个或一团颗粒在泳动 后来凝集团变得很大, 以致严重抑制精子运动 而没有包被抗体的精子在颗粒之间自由地泳动 这项试验的目的是测定黏附有微珠的活动精子的百分率 出现的一个普遍问题是非前向运动精子靠近微珠, 但是没有黏附上去 这些微珠是否能够黏附到精子上, 通常用小的移液器头轻轻地叩击盖玻片来检验 : 微珠移动与精子的活动一致提示有阳性结合 1. 仅评定活动精子和测定黏附有 2 个或 2 个以上乳胶颗粒的活动精子的百分率 忽略精子尾尖的结合 2. 为了获得可接受的低取样误差 ( 方框 2-5), 每次重复测试至少评价 200 个活动精子 3. 计算黏附有颗粒的活动精子的百分率 4. 记录免疫球蛋白的类型 (IgG 或 IgA), 以及乳胶颗粒结合到精子的部位 ( 头 中段 主段 ) 忽略精子尾尖的结合 1 如果 3 分钟 100% 的活动精子结合上微珠, 将此数值作为试验的结果 ; 不需 10 分钟后再次计数 2 如果 3 分钟 < 100% 的活动精子结合上微珠,10 分钟后再次对玻片计数 3 如果精子在 10 分钟不再活动, 取 3 分钟时的数值作为试验结果 参考值 目前尚没有来自有生育力男性精液 MAR 实验的结合抗体精子的参考值 在 新证据出现之前, 本手册仍保留将 50% 活动精子黏附颗粒作为临界值的一致观点
117 94 第一部分精液分析 当 50% 或更多的活动精子有抗体结合上去, 精子穿透宫颈黏液和体内受 精有显著抑制的倾向 (Abshagen et al.,1988) 颗粒仅黏附在尾尖, 与生育力降 低无关, 有生育力男性中也存在这种情况 (Chiu & Chamley,2004) 这项试验比混合抗球蛋白反应 (MAR) 试验耗费更多的时间, 但它提供了去除精浆可能遮蔽成分的精子表面抗体的信息 在直接免疫珠 (IB) 试验中, 将包被共价键结合的抗 IgG 或 IgA 的兔抗人免疫球蛋白的微珠直接与洗涤过的精子相混合 带有抗人 IgG 或 IgA 的微珠结合到活动精子上提示, 该精子表面有 IgG 或 IgA 抗体 试剂 Dulbecco s 葡萄糖 - 磷酸缓冲液 (PBS)- 牛血清白蛋白 (BSA), 或 Tyrode s-bsa 液 : 见附录 4,A4.2 和 A4.9 节 缓冲液 : 加 0.3g BSA Cohn 片段 V 至 100ml Dulbecco s PBS 液或 Tyrode s 液中 缓冲液 : 加 5g BSA Cohn 片段 V 至 100ml Dulbecco s PBS 液或 Tyrode s 液中 所有溶液经 0.45µm 微孔滤器过滤, 使用前温热至 25~ 制备免疫珠 对于每种类型免疫珠 (IgG,IgA), 在离心管中分别将 0.2ml 免疫珠储备悬液加至 10ml 缓冲液 中 以 500 或 600g 离心 5~10 分钟 从已洗涤的免疫珠上, 倾倒弃去上清液 用 0.2ml 缓冲液 轻轻地重新悬浮免疫珠 制备精子 这些试验所需的精液量由精子浓度和精子活力来决定, 见表 用于免疫珠试验的精液量 精子浓度 10 6 /ml 精子活力 PR % 所需精液体积 ml > ~50 > ~50 < 40 > ~20 > ~20 < 40 > < 10 > 5 > 10 > 充分混匀精液标本 ( 方框 2-3) 吸取所需的精液量至离心管, 并加缓冲液 至 10ml
118 第 2 章标准程序 以 500g 离心 5~10 分钟 从已洗涤的精子上, 倾倒弃去上清液 在 10ml 新鲜缓冲液 中轻轻地重新悬浮精子 再次以 500g 离心 5~10 分钟 倾倒弃去上清液 用 0.2ml 缓冲液 轻轻地重新悬浮精子液团 1 精液量 > 1.0ml 需要洗涤 3 次 2 低精子活力的标本 ( 例如,< 10% 或更少 ) 也许不能提供明确的结果 这种情况下, 可以考虑做间接免疫珠试验 ( 见 节 ) 步骤每次试验应该包括抗精子抗体阳性精子和抗精子抗体阴性精子作为对照 精液应该分别取自于带有和不带有抗精子抗体的男性, 先前用直接免疫珠试验检测过这些精液 1. 取 5µl 已洗涤的待测定精子悬液滴在载玻片上 2. 准备 2 张载玻片, 分别滴上 5µl 抗精子抗体阳性精子悬液和 5µl 抗精子抗体阴性精子悬液 3. 在每个精子悬液滴的旁边, 加 5µl 抗 IgG 免疫珠悬液 4. 用移液器吸头, 将每份抗 IgG 免疫珠悬液与精子悬液滴充分搅和 混匀 5. 在混合液上放置盖玻片 (22mm 22mm), 以使液层深度约为 20µm( 方框 2-4) 6. 室温下在湿盒内水平放置玻片 3~10 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ) 检测玻片前的等待时间不要超过 10 分钟, 因为孵育期间免疫珠的结合会显著减少 (Gould et al.,1994) 7. 用相差显微镜 200 或 400 放大倍数检查玻片 8. 评定黏附有 1 个或多个免疫珠的活动精子, 如 节中的描述 忽略精子尾尖的结合 9. 如 节中的描述, 对实验进行解释 10. 用抗 IgA 免疫珠悬液重复上述步骤 为了保证在 10 分钟内检测全部的结合, 最好摇晃制备好的玻片 参考值目前尚没有来自有生育力男性精液的 IB 试验结合抗体精子的参考值 在等待新证据出现之前, 本手册仍保留将 50% 活动精子黏附免疫珠作为临界值的一致观点 当 50% 或更多的活动精子 ( 前向或非前向 ) 黏附有免疫珠, 免疫不育的诊断成立 (Barratt et al.,1988) 免疫珠仅黏附在尾尖, 与生育力降低无关, 有生育力男性中也存在这种情况 (Chiu & Chamley,2004)
119 96 第一部分精液分析 间接免疫珠试验用于检测已热灭活 不含精子的体液 ( 例如, 血清 睾网液 精浆或菠萝蛋白酶促溶的宫颈黏液 ) 中的抗精子抗体 无抗体的供者精子吸附了待测定液中的抗精子抗体, 然后用直接免疫珠实验来检测 试剂见 节 ( 直接免疫珠试验的试剂 ) 如果检测宫颈黏液, 要制备 10IU/ml 菠萝蛋白酶, 它是一种广谱的蛋白水解酶 (EC )( 方框 2-2) 制备免疫珠见 节 制备供者精子见 节 制备待测定的体液 如果测试宫颈黏液, 用 10IU/ml 菠萝蛋白酶液以 1 + 1(1 2) 稀释 用移液器吸头搅匀, 在 37 孵育 10 分钟 当宫颈黏液完全液化, 以 2000g 离心 10 分钟 立即取上清液测定, 或者置于 70 冻储 促溶的宫颈黏液 血清 精浆 睾网液, 置 56 热处理 30~45 分钟, 灭活体液中的补体 用缓冲液 以 1 + 4(1 5) 稀释已热灭活的标本 ( 例如, 用 40µl 缓冲液 稀释 10µl 待测体液 ) 在每次间接试验中, 包括已知阳性和阴性的标本用作每次间接试验的对照 例如, 从带有和不带有抗精子抗体的男性中分别取得的血清, 先前用间接免疫珠实验检测过这些血清 已经结扎输精管的男性, 血清如果阳性可以作为阳性对照血清的来源 (> 50% 的活动精子结合了免疫珠, 不包括尾尖的结合 ) 孵育待测定标本与供者精子 将 50µl 已洗涤的供者精子悬液与按 1 + 4(1 5) 稀释的待测定体液相混合 37 孵育 1 小时 以 500g 离心 5~10 分钟 倾倒弃去上清液 在 10ml 新鲜缓冲液 中轻轻地重新悬浮精子 再次以 500g 离心 5~10 分钟 倾倒弃去上清液 重复上述第 洗涤步骤
120 第 2 章标准程序 用 0.2ml 缓冲液 轻轻地重新悬浮精子团 免疫珠试验 用经体液孵育过的供者精子, 按照 节的描述进行免疫珠试验 按照 和 节的描述, 评定和解释试验结果
121 98 本章所介绍的试验不必作为精液常规分析的方法, 但对于诊断或研究的某些 情况可能是有用的 3.1 形态学异常的精子通常有多种缺陷 ( 头部缺陷 中段或主段缺陷, 或这些缺陷 的组合 ) 各种形态学异常发生率的详细检测可能比单一评估正常形态精子百分 率更有用, 尤其在研究人类精子发生损伤程度方面 (Jouannet et al.,1988;auger et al.,2001) 记录形态学正常的精子, 以及有头部 中段和主段缺陷的精子, 用多重 异常记录系统 (mutiple-entry system) 给出所检测的每个精子的缺陷平均数 指数 : 用多重异常记录系统记录精子头部 中段和主段的每种缺陷, 可以得出 3 个 多重异常指数 (multiple anomalies index,mai)(jouannet et al.,1988); 畸形精子指数 (teratozoospermia index,tzi)(menkveld & Kruger,1996;Menkveld et al.,2001); 精子畸形指数 (sperm deformity index,sdi)(aziz et al.,1996,2004) MAI 和 TZI 与体内生育力相关 (Jouannet et al.,1988;menkveld et al.,2001; Slama et al,2002),sdi 与体外受精相关 (Aziz et al,1996) 这些指数对评估某些 暴露或病理状况也是有用的 (Auger et al.,2001;aziz et al.,2004) 记录精子头部 中段和主段的缺陷, 以及过量残留胞浆 ( 胞浆量大于精子头部 面积的 1/3) 可以使用实验室细胞计数器, 并将所检测的指数类型对应各个输入 键的数码 如果没有计数器, 可以用一个简单的记录表 MAI 是每个异常精子的缺陷的平均数 所有头部 中段和主段的缺陷都计算 在内 这项分析所采用的形态学标准源自 David 等 (1975),Auger 和 Eustache (2000) 进行了修改, 与本手册所呈现的标准有所不同 ( 见 和 节 ) TZI 与 MAI 类似, 但计数每个异常精子缺陷的最大值是 4: 头部 中段和主段 缺陷各计数为 1, 过量残留胞浆也计数为 1, 而不管每个异常精子的缺陷真正 数值 采用本手册所给出的形态学标准 SDI 是缺陷总数除以精子总数 ( 不只是异常精子 ) SDI 将几种头部缺陷合并 计数为 1, 但仅是把中段和主段缺陷各计数为 1 采用本手册所给出的形态 学标准 在重复样本 1, 用 6 键计数器记录 200 个精子 :42 个精子为正常,158 个
122 第 3 章可供选择的方案 多重精子缺陷指数的计算 MAI TZI * SDI 最大值 类别 异常精子 异常精子 所有精子 (A) 计数的精子数 正常精子 (N) 正常精子 (%) (B) 缺陷精子数 (200 46) (1) 头部缺陷数 (MAI,SDI) 或头部缺陷 1 的精子数 (TZI) (2) 中段缺陷数 (MAI) 或中段缺陷 1 的精子数 (TZI,SDI) (3) 主段缺陷数 (MAI) 或主段缺陷 1 的精子数 (TZI,SDI) (4) 过量残留胞浆的精子数 (C) 总缺陷 MAI:(1)+(2)+(3)=(C) 392 (D) 总缺陷 TZI,SDI:(1)+(2)+(3)+(4)=(D) 指数计算 C/B D/B D/A 指数值 * 对 TZI 的这种描述与原著 (Menkveld et al.,2001) 和欧洲人类生殖和胚胎学学会 (ESHRE) 以及北欧男科学 协会 (NAFA) 手册 (ESHRE /NAFA,2002) 中介绍的一致, 给出的数值范围是 1~4 这种描述不同于本手册旧版本 (WHO,1999), 旧版本将过多残留胞浆考虑为中段缺陷, 给出 TZI 的数值范围是 1~3 精子为异常 158 个异常精子中,140 个有头部缺陷,102 个有中段缺陷,30 个有主段缺陷,44 个有过多残留胞浆 重复样本 2 的结果是 :36 个精子为正常,164 个精子为异常 164 个异常精子中,122 个有头部缺陷,108 个有中段缺陷,22 个有主段缺陷,36 个有过多残留胞浆 为了得出 TZI, 将所检出的缺陷总数 ( = 604 项缺陷 ) 除以异常精子数 ( = 322), 即 TZI = 604/322 = 1.88 表 3-2 显示就诊临床不育门诊的男性以及近 3 年内生育 1 个孩子的男性的 MAI 和 TZI 值 3-2 生育和不育夫妇中男性的精子缺陷指数 不育夫妇 生育夫妇 MAI 1 TZI 2 MAI 3 TZI 2 均数 标准差 最小值 最大值 百分位数
123 100 第一部分精液分析 不育夫妇 生育夫妇 续表 MAI 1 TZI 2 MAI 3 TZI N 采用 David 形态学分类, 引自 Auger 未发表数据, 巴黎 (David et al.,1975;auger & Eustache 修改,2000) 2 Menkveld et al., Jørgensen et al.,2001, 采用 David 形态学分类 (David et al.,1975;auger & Eustache 修改,2000) 3.2 CD45 释放颗粒的多形核白细胞, 以及不含过氧化物酶的其他种类白细胞如淋巴细胞 巨噬细胞或单核细胞, 不能应用检测细胞过氧化物酶的邻甲苯胺实验来评估 ( 见 节 ), 但是可以使用免疫细胞化学方法来检测 免疫细胞化学染色比检测过氧化物酶活性耗时和费钱, 但是对区分白细胞和生精细胞是有用的 所有类型的人白细胞都有特异性抗原 (CD45) 的表达, 可以使用一种适当的单克隆抗体来检测 CD45 如果对它们感兴趣的话, 可以通过改变第一抗体的种类, 使用这种常规方法检测不同类型白细胞如巨噬细胞 单核细胞 中性粒白细胞 B 细胞或 T 细胞 Dulbecco s 磷酸盐缓冲液 (DPBS): 见附录 4,A4.2 节 Tris 盐缓冲液 (TBS),pH 8.2: 见附录 4,A4.8 节 盐酸四咪唑 ( 左旋咪唑 )1.0mol/L: 用 10ml 蒸馏水溶解 2.4g 左旋咪唑 底物 : 在 9.7ml TBS(pH 8.2) 中加入 2mg 萘酚 AS-MX 磷酸盐 0.2ml 二甲基甲酰胺和 0.1ml 的 1.0mol/L 左旋咪唑 即将使用前, 加入 10mg 快速红 TR(Fast Red TR) 盐, 并过滤 (0.45µm 微孔滤器 ) 固定液 : 丙酮或丙酮 / 甲醇 / 甲醛的混合液 : 在 95ml 丙酮中加入 95ml 纯甲醇和 10ml 37%(v/v) 甲醛 第一抗体 : 抗编码为 CD45 的白细胞共同抗原的小鼠单克隆抗体 第二抗体 : 兔抗小鼠免疫球蛋白 所用的稀释度取决于抗体的滴度和来源 碱性磷酸酶 - 抗碱性磷酸酶混合物 (APAAP) Harris s 苏木精染色混合液 ( 作为复染剂 ): 见附录 4,A4.10 节
124 第 3 章可供选择的方案 制备精液 充分混匀精液标本 ( 方框 2-3) 1 份约 0.5ml 的液化精液与 5 倍体积的 DPBS 混合 以 500g 离心 5 分钟, 除去上清液, 并用 5 倍体积的 DPBS 悬浮精子团 以 500g 离心 5 分钟 再重复此步骤一次, 并用 DPBS 重新悬浮精子团至约 个精子 /ml 制备精子涂片 取 2 份 5µl 精子悬液滴在干净载玻片上 ( 见 节 ), 制备涂片, 空气干燥 空气干燥的细胞在纯丙酮中固定 10 分钟, 或者在丙酮 / 甲醇 / 甲醛混合液中固定 90 秒 用 TBS 洗涤 2 次, 并将玻片的液体排尽 立即染色玻片, 或包裏在铝箔纸内, 并储存于 70, 待后分析 与抗体孵育 在每张玻片上, 用油性笔 ( 划线笔 ) 标出已固定细胞的一个区域 ( 直径约 1cm 的圆圈 ), 用 10µl 单克隆一抗覆盖这个区域 室温下在湿盒内水平放置玻片 30 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免干燥 用 TBS 洗涤 2 次, 并将玻片的液体排尽 用 10µl 二抗覆盖涂片的同一区域, 室温下在湿盒内孵育 30 分钟 用 TBS 洗涤 2 次, 并将玻片的液体排去 加 10µl APAAP 在同一区域 室温下在湿盒内孵育 1 小时 用 TBS 洗涤 2 次, 并将玻片的液体排尽 室温下在湿盒内与 10µl 萘酚磷酸底物孵育 20 分钟 为了强化反应产物, 可以重复使用二抗和 APAAP, 每种试剂孵育 15 分钟 复染和封片 一旦玻片出现微红色, 用 TBS 洗涤 用苏木精复染几秒钟 ; 自来水沖洗, 并用水性封固液封片 ( 见 和 节 ) 检测 CD45 阳性细胞数量 1. 用亮视野以 200 或 400 放大倍数检查整个已染色区域 CD45 阳性细胞 ( 白 细胞 ) 染成红色 ( 图 3-1)
125 102 第一部分精液分析 在每张重复涂片中, 分别计数 CD45 阳性细胞和精子, 直到至少观察 200 个精子, 以获得可接受的低取样误差 ( 方框 2-7 和表 2-2) 借助实验室计数器记录 CD45 阳性细胞和精子的数目 用同样方式检查第 2 张涂片 ( 直到计数 200 个精子 ) 计算 2 张涂片 CD45 阳性细胞数的总数和差异 从表 2-5 或图 A7-1 附录 7 中确定差异的接受性 ( 每个数值显示, 预期发生在 95% 的标本中, 仅由于取样误差所致的两次计数之间的最大差异 ) 如果差异可以接受, 计算出细胞浓度 ( 见 节 ) 如果差异太大, 需重复检测双份玻片 ( 方框 2-10) 以 2 位有效数字报告 CD45 阳性细胞的平均浓度 计算每次射精的 CD45 阳性细胞总数 ( 见 节后面的评述 ) 3-1 精液中的白细胞携带 CD45 的细胞 ( 白细胞 ) 染成红色 (Micrograph courtesy of RJ Aitken) 精液中 CD45 阳性细胞浓度的计算计算 CD45 阳性细胞的浓度与玻片上的精子浓度相关 如果 N 表示在同样观察视野数中精子数为 400 时的 CD45 阳性细胞数目,S 是精子浓度 (10 6 /ml), 那么 CD45 阳性细胞 (10 6 /ml) 的浓度 (C) 可以通过公式 C = S (N/400) 进行计算 方法的灵敏度如果标本中 CD45 阳性细胞数目比精子少 ( 例如,< 400), 取样误差会超出 5% 在这种情况下, 报告相应所计数的细胞数的取样误差 ( 表 2-2) 如果计数的 CD45 阳性细胞小于 25 个, 报告所观察到 CD45 阳性细胞的数目, 并注释 细胞数太少, 不能精确测定浓度
126 第 3 章可供选择的方案 样例 1 在重复涂片 1, 每 200 个精子有 20 个 CD45 阳性细胞, 而在重复涂片 2, 每 200 个精子有 40 个 CD45 阳性细胞 这两个数值的总和 ( ) 是 60, 两个数值之差 (40 20) 是 20 从表 2-5 可见, 这个数值超出了预期的随机误差 (15), 因此摒弃此结果, 重新检测 2 在重复涂片 1, 每 200 个精子有 25 个 CD45 阳性细胞, 而在重复涂片 2, 每 200 个精子有 35 个 CD45 阳性细胞 这两个数值的总和 ( ) 是 60, 两个数值之差 (35 25) 是 10 从表 2-5 可见, 这个数值小于预期随机误差 (15), 因此接受此结果 每 400 个精子中有 60 个 CD45 阳性细胞, 精子浓度为 /ml, 因此,CD45 阳性细胞的浓度为 C = S (N/400) 细胞 /ml = (60/400)= 细胞 /ml, 或者为 个细胞 /ml( 保留两位有效数字 ) 如果计数细胞少于 400, 报告从表 2-2 给出的 60 个细胞的取样误差 ( 约 13%) 参考值目前没有源自生育力男性精液的 CD45 阳性细胞的参考值 一致观点是过氧化物酶阳性细胞的临界值为 个细胞 /ml( 见 节 ), 它提示总白细胞的浓度较高, 因为并非所有白细胞都是过氧化物酶阳性的粒性细胞 白细胞总数 ( 精液中白细胞总数 ) 可以反映感染状态的严重性 (Wolff,1995) 精液中 CD45 阳性细胞总数可以通过射精液总体积乘以 CD45 阳性细胞浓度得出 月经周期的有限时间里 ( 月经中期 ) 宫颈黏液适宜接纳精子, 此时受雌激素影响的宫颈黏液有利于精子穿透 在不同妇女之间, 精子能够穿透宫颈黏液的时间长短变化很大, 即使同一个体, 不同的月经周期也不尽相同 宫颈黏液的采集 贮存, 以及宫颈黏液性状的评价详见附录 5 当一位男性不能提供精液标本, 性交后试验 ( 见 节 ) 也可以提供一些 有关其精子的信息 目的性交后试验的目的是测定宫颈黏液中的活动精子数目, 以及评估性交几小时后 ( 宫颈黏液的储池作用 ) 精子的存活 (Sobrero & MacLeod,1962) 和精子状态 (Moghissi,1976) 这项试验的结果也可以用于评估男性或女性配偶抗精子抗体
127 104 第一部分精液分析试验阳性的意义 时间选择应尽可能在临近排卵时, 但是要在排卵前, 进行性交后试验 临近排卵时间可根据临床指标来确定, 例如, 通常的周期长度 基础体温 宫颈黏液变化 阴道细胞学检查 测定血清或尿液中促黄体激素或雌激素, 以及超声检查卵巢 在实验室评价宫颈黏液的标准时间是性交后 9~14 小时, 这点是重要的 对夫妇的指导 准备进行性交后试验, 这对夫妇应被告知进行实验的最适宜日期及注意事项 : 试验前两天禁欲, 男方也避免手淫 ; 试验日期前的夜间进行阴道内性交 ; 性交过程不能使用任何阴道润滑剂, 女方不能在性交后冲洗阴道 ( 可以淋浴, 但不能全身浸浴 ); 女方应在次日早上请门诊医生检查 步骤 将未涂润滑剂的阴道内窥器置入阴道 用结核菌素注射器 ( 不带针头 ) 移液管或聚乙烯管, 尽可能多地吸取阴道后穹隆精液池中的液体 用另一个注射器或导管尽可能多地吸取宫颈管内的黏液 将黏液标本置于载玻片上, 并用盖玻片 (22mm 22mm) 压平黏液 压黏液的厚度可以标准化 : 用含有直径 100µm 玻璃珠的硅脂或蜡 - 凡士林混合物 ( 方框 3-1) 支撑盖玻片 (Drobnis et al.,1988) 用相差显微镜以 400 倍检查制备的玻片 质量好的黏液标本并且没有血污染是取得可靠实验结果的关键 提前制备蜡 - 凡士林混合物 使用前可以置于室温储存 在烧杯中融化蜡 ( 熔点为 48~ 66 ), 用玻璃棒将蜡与凡士林混匀 ( 约 1 份蜡配 2 份凡士林 ) 一旦混合物完全均匀, 稍微冷却 在混合物依然温热时, 吸进一支 3ml 或 5ml 注射器 ( 不带针头 ) 内 一旦混合物凝固, 注射器套上一个 18 号钝针头 阴道池的精液标本精子在阴道内通常存活不到 2 小时 对阴道池标本 ( 见 节 ) 的湿片进行检查是为了证实精液已储积在阴道内 宫颈黏液标本宫颈管下部的精子数目取决于性交后的时间长度 性交后约 2~3 小时, 宫
128 第 3 章可供选择的方案 105 颈管下部会有大量精子聚积 传统上, 评估宫颈黏液中精子数目是基于每高倍显微视野所计数的数目 ( 方 框 3-2) 宫颈黏液中的精子浓度应表述为每 µl 的精子数 µm 每个显微视野中的黏液体积取决于视野的面积 (πr 2,π 约为 3.142,r 是显微镜视野的半径 ) 和计数池的深度 ( 本例为 100µm) 显微镜视野的直径可以用镜台测微尺测出, 或者用目镜孔直径除以物镜放大倍数来估算 例如,40 倍物镜 10 倍目镜的孔直径是 20mm, 那么显微镜视野的直径约为 500µm(20mm/40) 在这个例子,r = 250µm,r 2 = µm 2, πr 2 = µm 2, 体积是 µm 3 或约为 20nl 因此,100µm 厚度的黏液玻制片中, 每 400 倍高倍视野有 10 个精子, 大概相 当于每 20nl 黏液中有 10 个精子, 或是每 µl 黏液中有 500 个精子 但是, 由于所 计数细胞的总数少, 取样误差会高 报告从表 2-2 给出的 10 个精子的取样误差 ( 约 32%) 宫颈黏液中精子活力分级如下 : PR = 前向运动精子 ; NP = 非前向运动精子 ; IM = 不活动精子 解释 正常子宫颈功能的最重要指征是黏液中存在前向运动精子 如果黏液中没有观察到精子, 实验结果为阴性 性交后 9~14 小时子宫颈内黏液中存在任何快速前向运动精子, 可以排除 宫颈因素 以及男方或女方的精子自身免疫因素导致不育的可能 (Oei et al., 1995) 当观察到非前向运动精子显示颤动现象, 提示宫颈黏液中或者精子表面可能 存在抗精子抗体 如果初试结果是阴性或异常, 应重复性交后试验 1 如果阴道池标本没有观察到精子, 应询问这对夫妻, 以确认有过阴道内 射精 2 试验阴性可以由选择实验时间不正确所致 对有生育力的妇女来说, 在月经周期内过早或过迟进行试验也会出现阴性结果 有些妇女可能在整个月经周期中仅有 1 或 2 天有阳性结果 如果不能合理精确预期排卵, 则需在月经周期中重复几次性交后试验, 或者重复进行体外试验 3 选择月经周期中最佳时间重复进行性交后试验的结果均为阴性, 才能 确定宫颈因素为不育的可能病因
129 106 第一部分精液分析 可以应用几项体外穿透试验来详细评估精子 - 宫颈黏液相互作用 这些体外 穿透试验通常在性交后试验为阴性结果后才进行, 并且使用供者精液和供者宫颈 黏液作为对照, 进行交叉试验可以提供更多的信息 这些试验也可以用于评估男 性或女性配偶抗精子抗体试验阳性的意义 如果精子 - 宫颈黏液相互作用的试验目的是为了比较不同宫颈黏液标本的质 量, 应使用同一份精子参数正常的精液标本 如果试验目的是评价几份精液标本的质量, 应使用同一份质量好的月经中期 宫颈黏液标本 宫颈黏液的采集 贮存, 以及宫颈黏液性状的评估详见附录 5 1 可以从预约进行人工授精或辅助生育取卵的月经中期妇女获得供者 宫颈黏液 应在自然周期或使用促性腺激素诱发排卵周期的授精前采集宫颈 黏液 2 妇女可以给予炔雌醇 7~10 天, 以产生用于测试的雌激素化的宫颈黏 液 ( 见附录 5,A5.2.1 节 ) 3 由于氯米芬的抗雌激素作用可能对宫颈有影响, 因此使用了氯米芬诱 发排卵的妇女不应作为宫颈黏液的供者 应使用人的月经中期宫颈黏液 体外实验应在采集精液后 1 小时内进行, 以防止脱水或温度变化影响精液 质量 宫颈管内或采集的宫颈黏液, 立即用范围为 6.0~10.0 的 ph 试纸测试 ph 值 如果在宫颈管内测试 ph 值, 应注意方法正确, 因为宫颈管外的宫颈黏液 ph 值通常低于宫颈管内 还须注意避免阴道分泌物的污染, 因为它的 ph 值低 精子对宫颈黏液 ph 值的变化甚为敏感 酸性宫颈黏液可使精子制动, 而 碱性宫颈黏液可提高精子活力 宫颈黏液碱性过强 (ph > 8.5) 对精子存活 有不利的影响 在宫颈黏液中精子移动和存活的最适 ph 值是 7.0~8.5, 这 也是月经中期正常宫颈黏液的 ph 值范围 虽然 ph 值为 6.0~7.0 的宫颈 黏液可容许精子穿透, 但 ph 值低于 6.5 常抑制精子活力 如果宫颈黏液的 ph < 7.0, 通常不进行精子 - 宫颈黏液试验 在精子 - 宫颈黏液相互作用体外实验中, 使用代用凝胶, 如牛宫颈黏液或 合成凝胶, 不能认为等同于人宫颈黏液 但是, 应用这些材料可以提供精子在 黏性介质中运动的信息 (Neuwinger et al.,1991;ivic et al.,2002)
130 第 3 章可供选择的方案 步骤 将 1 滴宫颈黏液置于载玻片上, 用盖玻片 (22mm 22mm) 压平黏液 压黏液的厚度可以标准化 : 用含有直径 100µm 玻璃珠的硅脂或蜡 - 凡士林混合物 ( 方框 3-1) 支撑盖玻片 (Drobnis et al.,1988) 在盖玻片两侧各滴 1 滴精液, 使其与盖玻片边缘接触, 精液借助毛细作用在盖玻片下面移动 以这样的方式, 宫颈黏液与精液之间形成清晰的界面 室温下在湿盒内水平放置玻片 30 分钟 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免玻片干燥 用相差显微镜 400 倍检查界面 观察 观察是否存在以下的特征 : 在几分钟内, 精液形成一些指状突起 ( 多指状 ) 侵入宫颈黏液 这是液体的物理性质, 即使在无精子症标本中也会出现这种情形 (Perloff & Steinberger, 1963;Moghissi et al.,1964) 大多数精子在进入宫颈黏液前, 先穿过指状突起通道 在很多情况下, 似乎是一个精子引导一纵列精子进入黏液 精子一旦进入了宫颈黏液, 精子就会形成扇面, 并随意泳动 有些精子返回精浆, 但大多数精子向宫颈黏液纵深移动, 直至遇到细胞碎片或白细胞的阻止 从界面起, 精子泳动深入黏液约 500µm( 例如, 约 10 个精子的长度 ) 或更远 精子是运动的 ( 记录活动精子的大约百分率, 以及精子是否前向运动 ) 解释简化玻片试验结果的解释具有主观性, 这是因为制备平面玻片, 不可能使精液 - 宫颈黏液接触界面的大小与形状标准化 因此, 这项实验只是一个精液 - 宫颈黏液相互作用的定性实验 不过, 这项试验可以进行一些有用的观察 1. 正常结果 : 精子穿透入宫颈黏液相, 并且 > 90% 精子具有明确的前向运动 这说明精子 - 宫颈黏液相互作用没有问题 2. 不良结果 : 虽然精子穿透入宫颈黏液相, 但大多数精子向前泳动不超过精液 - 宫颈黏液接触界面 500µm( 约 10 个精子的长度 ) 这提示精子 - 宫颈黏液相互作用存在问题 3. 异常结果 :1 虽然精子穿透入宫颈黏液相, 但很快变得不活动或显示 颤动 2 精子没有穿透入精液 - 宫颈黏液的分界面 指状突起可能形成或尚未形成, 但精子聚集在界面的精液侧 这提示宫颈黏液中或者精子表面存在抗精子抗体
131 108 第一部分精液分析 当使用夫妇的精液和宫颈黏液得出异常结果时, 使用供者精液和供者宫 颈黏液进行交叉实验, 这样能够鉴别出是精液, 还是宫颈黏液造成的异常结果 毛细管试验最初是由 Kremer(1965) 设计的, 后来进行了各种改良 这项试验是测试毛细管内精子穿透宫颈黏液柱的能力 这里推荐的方案基于初始试验 设备已使用各种类型的毛细管, 但推荐使用长 5cm 带有内口直径为 0.3mm 观察路径的扁平毛细管 在实验室,Kremer 精子穿透计 ( 图 3-2) 的制作如下 1. 将从小塑料试管 ( 半径为 3.5mm) 剪下的 3 个精液储池 (R), 粘在一张载玻片上 2. 将第 2 张载玻片粘在第 1 张载玻片上 第 2 张玻片应比第 1 张玻片短 1.5cm, 并且距离精液储池 5mm 这种构造防止精液渗入毛细管与玻片之间的缝隙 3. 在载玻片上贴上厘米刻度尺 3-2 Kremer 精子穿透计 步骤 在每个精液储池置入 100µl 射精后不超过 1 小时的液化精液 将宫颈黏液吸入每个毛细管, 并确保没有吸入气泡 每个管的一端用毛细管密封剂 橡皮泥或类似物封闭 封管时应该用足量的封闭剂, 以使宫颈黏液柱稍微突出于毛细管的开口端 放置毛细管的开口端在玻片上, 使它深入含有精液标本的储池内 0.5cm 将穿透计水平放置在 37 湿盒内 2 小时 ( 例如, 放在带盖培养皿内浸透水的滤纸上 ), 以避免精液和宫颈黏液干燥 如 节的概述, 用相差显微镜 100 倍检查毛细管
132 第 3 章可供选择的方案 将穿透计放回 37 孵箱,24 小时后再次检查毛细管内前向运动精子的存在 情况 观察 情况 小时后, 检测精子的移动距离 穿透密度 移动减少和前向运动精子的存在 移动距离 : 记录从浸入精液储池的毛细管端到管中最远精子的距离 穿透密度 : 在距离浸入精液储池的毛细管端 1cm 和 4.5cm 处测量 在每个测 量点, 记录每个低倍视野 ( 100LPF) 的精子平均数 估计 5 个相邻低倍视野的精子数, 算出平均数, 并且如表 3-3 所示, 表示为一 个穿透密度等级 记录无论是在 1cm 处, 还是在 4.5cm 处的最高精子穿透密度, 作为本项试验的分级 3-3 精子穿透密度的等级顺序 3. 精子平均数 /LPF 等级顺序 0 1 0~5 2 6~ ~ ~ ~100 6 > 移动减少 : 将 4.5cm 处的精子穿透密度与 1cm 处的相对比, 计算出移动密度 的减少 它是以等级顺序的差別来表示 1 在 1cm 处的穿透密度是 51~100/LPF, 在 4.5cm 处的穿透密度是 6~ 10/LPF 移动减少值是 3( 等级 6 到等级 3)( 表 3-3) 2 在 1cm 处的穿透密度是 21~50/LPF, 在 4.5cm 处的穿透密度是 51~ 100/LPF 移动减少值是 0 因为实际上穿透密度增加了 ( 从等级 5 到等级 6)( 表 3-3) 解释 前向运动精子 : 在 2 小时和 24 小时, 检测宫颈黏液中前向运动精子的存在情况 根据表 3-4, 试验结果分为阴性 差或好 3 个等级 3-4 毛细管试验结果的分级 移动距离 cm 最高穿透密度 1cm 或 4.5cm 处每低倍视野的精子数 从 1cm 到 4.5cm 的移动减少 等级顺序数的减少 在宫颈黏液中前向运动的时间 h 1 0 阴性 < 3 或 < 10 或 > 3 或 2 差 4.5 和 > 50 和 < 3 和 > 24 好 试验结果的所有其他组合 分级 一般
133 110 第一部分精液分析 3.4 质量差的精液可以由于睾丸生成异常精子, 或在附睾的睾丸后精子损伤, 或 异常附性腺分泌物排放所致 附性腺的分泌物可以用来检验腺体功能, 例如, 柠 檬酸 锌 γ- 谷氨酰转移酶和酸性磷酸酶反映前列腺功能 ; 果糖和前列腺素反映 精囊腺功能 ; 游离左旋肉毒碱 甘油磷酸胆碱 (GPC) 中性 α- 葡糖苷酶反映附睾 功能 虽然有时感染能引起这些标志物的分泌减少, 但标志物的总量仍可以在正 常值范围内 感染也能造成分泌上皮不可逆的损伤, 以致治疗后分泌能力仍然低 (Cooper et al.,1990a;von der Kammer et al.,1991) 前列腺的分泌能力 精液中锌 柠檬酸 (Möllering & Gruber,1966) 或酸性 磷酸酶含量 (Heite & Wetterauer,1979) 是检测前列腺分泌功能的可靠指标, 而且这些标志物之间存在很好的相关性 节叙述了锌的分光光度检 测法 精囊腺的分泌能力 精液中果糖反映精囊腺功能 节介绍了检测果糖 含量的分光光度法 附睾的分泌能力 游离左旋肉毒碱 甘油磷酸胆碱和中性 α- 葡糖苷酶是临床 使用的附睾标志物 在反映附睾病变方面, 中性 α- 葡糖苷酶显示比游离左旋 肉毒碱 甘油磷酸胆碱更具特异性和敏感性 (Cooper et al.,1990a) α- 葡糖苷 酶在精浆中有两种异构体 : 主要的是中性 α- 葡糖苷酶, 仅源自附睾 ; 少量的 是酸性 α- 葡糖苷酶, 主要源自前列腺 节叙述了检测中性 α- 葡糖苷酶 的简易分光光度法 精液中任何附性腺分泌物的总量反映出该腺体的整体分泌功能 (Eliasson, 1975) 它可以用精液总体积乘以附属性腺标志分泌物浓度得到 背景用分光光度法检测血清锌含量有商品化试剂盒, 也适合于检测精液锌 以下介绍的方法是基于 Johnsen 和 Eliasson(1987) 的方法, 为使用 96 孔板测定仪而进行了改良, 其灵敏度为 4µmol/L(Cooper et al.,1991) 当使用分光光度仪的 3ml 或 1ml 比色杯时, 可以按比例地调整精液和试剂的体积 在计算结果时需作适当的校正 原理化合物 2-(5- 溴 -2- 吡啶 )-5-(N- 丙基 -N- 硫代丙氨基 )- 酚 (5- 溴 -PAPS)[2- (5-bromo-2-pyridylazo)-5-(N-propyl-N-sulfopropylamino)-phe-nol(5-Br-PAPS)] 与锌结合, 产生颜色变化
134 第 3 章可供选择的方案 试剂 5-Br-PAPS + Zn 2+ 5-Br-PAPS-Zn 复合物, 其吸收光波长为 560nm 检测血清锌含量有商品化试剂盒 仅使用显色剂 A(60ml,2 瓶 ) 和显色剂 B (30ml,1 瓶 ) Zn 标准液 (100µmol/L): 溶解 0.144g ZnSO 4 7H 2O 于 50ml 纯水, 将 1ml 上述溶液加入 99ml 纯水中稀释 100 倍 置 20 储存 标准曲线 : 将步骤 2 制备的 100µmol/L 锌标准液加纯水稀释, 得到另外 5 个标准液 : 和 10µmol/L 显色剂 : 将显色剂 A 与显色剂 B 按 4 1 比例混合 ( 一块 96 孔板约需 25ml) 此显色液在室温下 2 天或 4 下 1 周可保持稳定 用冻存的混合精浆作内质控 ( 见 节, 步骤 1) 步骤 精液分析后, 余下的精液标本以 1000g 离心 10 分钟, 倾倒并储存去精子的精浆于 20 待分析 去精子的精浆标本可与其他精浆标本混合在一起, 为将来的测试提供一个内质控标准样品 解冻去除精子的精浆, 在涡旋器上充分混匀 同时解冻和混匀 1 份用于内质控的混合精浆 每例的精浆标本重复稀释 2 份 : 在 2 个 1.5ml 试管中各加入 300µl 纯水, 再各加入 5µl 精浆 ( 使用正向置换式移液器 ), 并用涡旋器混匀 5 秒钟 重复取双份 40µl 按步骤 3 所稀释的精浆样本, 加入 96 孔板中 包括 2 份空白 (40µl 纯水 ),2 份 40µl 的每种标准液 加 200µl 显色液到每 1 孔, 在 96 孔板振荡器上混匀 5 分钟 在 560nm 波长处读取结果, 用水空白调零 计算 通过比较吸光度值, 从标准曲线 (mmol/l) 上读取标本中锌的浓度 剔除超出标准浓度上限的结果, 这些标本以更大的倍数稀释 ( 用纯水稀释 ), 重新进行测定 结果乘以稀释因子 61( 用 300µl 水稀释 5µl 精浆 ) 得到未经稀释精浆中锌的浓度 (mmol/l) 重复样本测定结果的一致性应在 10% 之内 即,( 两个估计值之差除以估值的平均值 ) % 如果不符合, 新取 2 份重复精液样本, 重新检测 精液中锌的总量 (µmol)= 锌的浓度 精液总体积 (ml) 参考下限值 锌的参考下限值是每次射精 2.4µmol(Cooper et al.,1991 and unpublished data from TG Cooper)
135 112 第一部分精液分析 背景以下所介绍的方法是基于 Karvonen 和 Malm(1955) 的方法, 为使用的 96 孔板测定仪而进行了改良, 其灵敏度为 74µmol/L(Cooper et al.,1990a) 当使用分光光度仪的 3ml 或 1ml 比色杯时, 可以按比例地调整精液和试剂的体积 在计算结果时需作适当的校正 原理在热和低 ph 的影响下, 果糖与吲哚形成了有颜色的复合物 果糖 + 吲哚 热 + 酸 吸收光波长为 470nm 的复合物 试剂 可使用检测精浆果糖含量的商品化试剂盒 否则, 配制下列试剂 脱蛋白剂 1(63µmol/L ZnSO 4): 溶解 1.8g ZnSO 4 7H 2O 于 100ml 纯水 脱蛋白剂 2(1mol/L NaOH): 溶解 0.4g NaOH 于 100ml 纯水 显色剂 (16µmol/L 苯甲酸固定液含 2µmol/L 吲哚 ): 溶解 200mg 苯甲酸于 90ml 纯水,60 水浴振荡 将 25mg 吲哚溶解于其中, 加纯水至 100ml, 过滤 (0.45µm 孔径滤器 ),4 储存 果糖标准液 (2.24mmol/L): 溶解 40mg D- 果糖于 100ml 纯水 4 储存, 或分装冻存 标准曲线 : 将 2.24mmol/L 果糖标准液加纯水稀释, 得到另外 4 个标准液 : 和 0.14mmol/L 用冻存的混合精浆作内质控 ( 见 节, 步骤 1) 步骤 精液分析后, 余下的精液标本以 1000g 离心 10 分钟, 倾倒并储存去精子的精浆于 20 待分析 去精子的精浆标本可与其他精浆标本混合在一起, 为将来测试提供一个内质控的标准样品 解冻去精子的精浆, 在涡旋器上充分混匀 同时解冻和混匀 1 份用于内质控的混合精浆 每例精浆标本重复稀释 2 份 : 在 2 个 1.5ml 试管中各加入 50µl 纯水, 再各加入 5µl 精浆 ( 使用正向置换式移液器 ), 混匀 脱蛋白 : 向 55µl 已稀释的标本加入 12.5µl 63µmol/L ZnSO 4 和 12.5µl 0.1mol/L NaOH, 混匀 室温下放置 15 分钟, 然后以 8000g 离心 5 分钟 取每例标本 50µl 上清液移入检测管 包括 2 份空白 (50µl 纯水 ) 和 2 份 50µl 每种标准液 向每支检测管加入 50µl 吲哚液, 混匀
136 第 3 章可供选择的方案 向每支检测管加入 0.5ml 浓盐酸 (HCl,32% v/v), 用实验室模压封膜封管口, 在通风橱内小心地混匀 在 50 热水浴中放置 20 分钟 混匀, 在冰水中冷却 15 分钟 在通风橱内用正向置换式移液器将 250µl 检测管液体小心地移入 96 孔板中 用实验室透明贴膜将 96 孔板封闭, 以避免分光光度仪受酸液的影响 在 470nm 波长处读取结果, 用水空白调零 计算 通过比较吸光度值, 从标准曲线 (mmol/l) 上读取标本中果糖的浓度 剔除超出标准浓度上限的结果, 这些标本以更大的倍数稀释 ( 用纯水稀释 ), 重新进行测定 每例标本的结果乘以稀释因子 16( 用 75µl 水和脱蛋白剂稀释 5µl 精浆 ) 得到未经稀释精浆中果糖的浓度 (mmol/l) 重复样本测定结果的一致性应在 10% 之内 即,( 两个估计均值之差除以估值的平均值 ) % 如果不符合, 新取 2 份重复精液标本, 重新检测 精液中果糖的总量 (µmol)= 果糖的浓度 精液总体积 (ml) 参考下限值果糖的参考下限值是每次射精 13µmol(Cooper et al.,1991 and unpublished data from TG Cooper) 精液中低果糖浓度是射精管阻塞 双侧输精管先天性缺如 (de la Taille et al.,1998;daudin et al.,2000;von Eckardstein et al.,2000) 不完全逆行射精和雄激素缺乏的特征 α 背景精浆中既含有源自附睾的中性 α- 葡糖苷酶同工酶, 也含有源自前列腺的酸性 α- 葡糖苷酶同工酶 后者可以被十二烷基硫酸钠 (SDS) 选择性抑制 (Paquin et al., 1984), 从而可以测定反映附睾功能的中性 α- 葡糖苷酶 用 castanospermine( 澳洲栗精胺 ) 抑制剂阻断非葡糖苷酶的相关底物, 可使测试更敏感 以下所介绍的是使用 96 孔板测定仪的方法, 其灵敏度为 74µmol/L(Cooper et al.,1990b) 当使用分光光度仪 3ml 或 1ml 比色杯时, 可以按比例地调整精液和试剂的体积 在计算结果时需作适当的校正 原理葡糖苷酶将合成的吡喃葡糖苷底物转化为对硝基苯酚, 加入碳酸钠后变为黄色 p- 硝基苯酚 -α- 吡喃 α- 葡糖苷酶 Na2CO3 吸收光波长 p- 硝基苯酚葡糖苷为 405nm
137 114 第一部分精液分析 试剂检测精液中附睾中性 α- 葡糖苷酶含量有商品化试剂盒 建议使用含 SDS 和 castanospermine 的试剂盒测定精液中附睾中性 α- 葡糖苷酶 替代的方法是准备以下试剂 : 1. 缓冲液 1(0.2mol/L 磷酸缓冲液,pH 6.8): 溶解 4.56g K 2HPO 4 于 100ml 纯水 另溶解 2.72g KH 2PO 4 于 100ml 纯水 将两者大约等体积混合, 至 ph 为 缓冲液 2: 溶解 1g SDS 于 100ml 缓冲液 1 SDS 于 4 储存会发生沉淀, 但稍微加温会重新溶解 3. 显色剂 1( 用于终止反应,0.1mol/L Na 2CO 3): 溶解 6.20g Na 2CO 3 H 2O 于 500ml 纯水 4. 显色剂 2: 溶解 0.1g SDS 于 100ml 显色剂 1 5. 底物 p- 硝基苯酚吡喃葡糖苷 (PNPG)(5mg/ml): 溶解 0.1g PNPG 于 20ml 缓冲液 2, 放在 50 的加热板上搅拌, 并振荡约 10 分钟 有些结晶可能仍然不溶解 使用过程需将溶液保持在 37 每次测试需配制新鲜试剂 6. 用于精液空白的葡糖苷酶抑制剂 (castanospermine,10mmol/l): 溶解 18.9mg castanospermine( 澳洲栗精胺 ) 于 10ml 纯水 用纯水稀释 10 倍为 1mmol/L 的工作液 约 1ml 分装, 20 冻存 7. 产物 p- 硝基苯酚 (PNP) 的标准曲线 (5mmol/L): 溶解 69.5mg PNP 于 100ml 纯水, 必要时加温溶液 用铝箔包裏或装在棕色玻璃瓶里,4 避光储存 每 3 个月配制新鲜的标准液 8. 制备标准曲线 ( 在孵育的最后 1 小时内完成 ): 加 400µl 5mmol/L PNP 储存液于 10ml 容量瓶中, 加显色剂 2 定容至 10ml(200µmol/L) 将 200µmol/L 标准液加显色剂 2 稀释, 得到另外 4 个标准液 : 和 40µmol/L PNP 9. 用冻存的混合精浆作内质量控制 ( 见 节, 步骤 1) 步骤 精液分析后, 余下的精液标本以 1000g 离心 10 分钟, 倾倒并储存去精子的精浆于 20, 待分析 去精子的精浆标本可与其他精浆标本混合在一起, 为将来测试提供一个内质控的标准样品 解冻去精子的精浆, 在涡旋器上充分混匀 同时解冻和混匀 1 份用于内质控的混合精浆 用正向置换式移液器重复取 15µl 精浆标本分别加入 2 个 1.5ml 试管中 包括 2 份空白 (15µl 纯水 ) 取一式 4 份 15µl 作为内质量控制的混合的精浆样本 向 2 个内质量控制样本各加入 8µl 1mmol/L castanospermine, 以提供精浆空白值 向每管分别加入约 37 的 100µl PNPG 底物液 旋转混匀每个试管,37 孵育 2 小时 ( 准确的温度和时间控制至关重要 ) 2 小时后, 向每个试管中加 1ml 显色剂 1 以终止孵育, 并混匀 移取 250µl 标本和 250µl 标准液至 96 孔板
138 第 3 章可供选择的方案 分钟内, 在 405nm 波长处读取结果, 用水空白调零 计算 通过比较吸光度值, 从标准曲线 (µmol/l) 上读取标本产生的 PNP 浓度 剔除超出标准浓度上限的结果, 这些标本稀释 ( 用缓冲液 1 稀释 ) 后, 重新进 行测定 乘以校正因子 (0.6194; 见注释所述 ), 得到未稀释精浆中性葡糖苷酶的活性 (IU/L) 从每个标本活性减去精浆 castanospermine 活性, 得到校正的 ( 相关的葡糖苷 酶 ) 活性 2 份重复测定结果的一致性应在 10% 之内 例如,( 或两个估计值之差除以 估值的平均值 ) % 如果不符合, 取 2 份新的精液标本样品, 重新 检测 精液的葡糖苷酶活性 (mu)= 校正的葡糖苷酶活性 精液总体积 (ml) 1 个国际单位 (IU) 的葡萄糖苷酶活性定义为 : 在 37, 每分钟生成 1µmol 产物 (PNP) 在这项测试, 经过 120 分钟反应, 在 1.115ml 总体积中, 从 15µl 精 浆得出的活性 因此, 校正因子 =(1115/15)/120 = 参考值 中性 α- 葡糖苷酶的参考下限值是每次射精 20mU(Cooper et al.,1991 and unpublished data from TG Cooper) 直到最近, 计算机辅助精子分析 (computer-aided sperm analysis,casa) 才可用于精子浓度的测定, 难点在于将精子与颗粒碎片区分开来 (ESHRE,1998) 随着技术的进步, 特别是 DNA 荧光染色和尾部检测算法 (tail-detection algorithms) 的应用, 使得精子浓度以及前向活动精子浓度的测定成为可能 (Zinaman et al., 1996;Garrett et al.,2003) 如果在样本准备和仪器使用时足够细心,CASA 在目前可用于一些临床常规诊断检测 要建立并维持高标准的仪器操作, 质量控制程序必不可少 ( 见第 7 章 ) 有几个商家生产 CASA 系统 这些分析仪可以测量精子活力和动力学状态, 一些还能够检测精子的浓度 有几种产品还有半自动化的形态学分析模块 用 CASA 分析精子活力 浓度和形态学, 较人工方法具有两个优势 : 高精确性和提供精子动力学参数的量化数据 ( 前向运动和超活化运动, 及获能精子特征参数 ) 一些研究表明,CASA 所检测的前向运动精子浓度和运动特征的结果与体内 体外受精率及受孕所需时间有显著相关性 (Liu et al.,1991a;barratt et al.,1993;
139 116 第一部分精液分析 Irvine et al.,1994;krause,1995;donnelly et al.,1998;larsen et al.,2000;garrett et al.,2003;shibahara et al.,2004) 应用 CASA 测量精子活力和浓度分别在 和 节中描述,3.5.4 节则评述了计算机辅助形态学分析的应用 CASA CASA 分析仪能够识别活动精子, 最适宜应用于精子动力学的分析, 但评估活动精子百分率可能是不可靠的, 因为后者还需要测定不活动精子的数目, 而细胞碎片有可能和不活动精子相混淆 很多因素都会影响到 CASA 分析仪的性能, 如标本的制备 帧频率 精子浓度和计数池的深度等 (Davis & Katz,1992;Mortimer,1994a,b;Kraemer et al.,1998) 然而, 如果操作程序得当还是可以获得可靠和可重复的结果 (Davis & Katz,1992) 可参考 CASA 分析仪的使用指南 (Mortimer et al.,1995;eshre,1998) 在使用 CASA 分析仪检测精子运动参数时, 每份标本至少要分析 200 个活动精子的运动轨迹, 这意味着需要检测更多的精子 如果要把精子按运动方式分类, 或打算在一份标本中对结果变异性做其他分析时, 至少需要 200 个, 最好是 400 个活动精子的运动轨迹 每个标本中分析的精子数目应标准化 CASA 分析仪应当链接到那些能进行数据整合和统计学分析的计算机软件 很多运动参数的分布并不是正态的, 因此中位数比平均数更适合各变量的集中趋势的描述, 对于单个精子的测量值, 在做统计分析之前可能需要进行数学转换 步骤使用前, 应先对 CASA 分析仪进行正确设置和调试, 以保证设备良好的工作状态 制造商提供了适宜的参数, 但使用者必须检查分析仪运行是否达到了其所要求的重复性和可靠性程度 必须使用适当的质量控制措施, 如录像带等 ( 见附录 7,A7.5 部分 ) 一些作者已经对一般情况下的 CASA 设置进行了讨论 (Davis & Katz,1992;Mortimer,1994b;ESHRE,1998) 标本的制备 CASA 分析所用精液标本的采集和处理同第 2 章所述 因为精子的运动对温度敏感, 必须将 CASA 系统精液标本温度保持在 37 可以用未稀释的精液检测精子运动特征和浓度 精子浓度为 /ml~ /ml 的标本, 适宜检测精子活力 (Garrett et al.,2003) 精子浓度高的标本 ( 即 > /ml) 可能会出现高频度精子碰撞, 由此可能产生误差 应进行稀释, 并且最好使用该标本的精浆稀释 1. 取出一定量精液样本离心 (16 000g,6 分钟 ), 以获得无精子的精浆 2. 用无精子的精浆稀释最初的精液标本, 使精子浓度低于 /ml 使用 20μm 深的一次性计数池可获得可靠的结果 这是一种具有双计数池的装置, 两个计数池都应被充满样本并进行评估 必须检测几个有代表性的视野 : 每个计数池检测 6 个视野 ( 一共 12 个视野 ) 通常可以得到可靠的结果 每个计数池至少需检测 200 个精子 采用 节中相同的质量控制原则, 用于精子活
140 第 3 章可供选择的方案 117 力的标准化评估 标本可以直接分析也可以用视频记录 分析视频记录 ( 如录像带 CD-ROM 和 DVD) 更容易实现标准化和更好地实施质量保证程序 ( 见附录 7, A7.5 部分 ) 厂家通常会推荐可应用的视频记录设备类型, 以及使精子头部和背景产生最大反差的最适宜照明条件 对于获得精确结果所需追踪精子的时间目前尚有争议, 但是时间最少 1 秒应足够用于基本的 CASA 检测 (Mortimer,1994b) CASA 术语 CASA 分析仪检测参数的一些标准术语见图 3-3 VCL(curvilinear velocity), 即曲线速率 (μm/s) 精子头沿其实际曲线, 即在显微镜下见到二维方式运动轨迹的时均速率, 反映精子活动能力 VSL[straight-line(rectilinear)velocity], 即直线速率 (μm/s) 精子头在开始检测时的位置与最后所处位置之间的直线运动的时均速率 VAP(average path velocity), 即平均路径速率 (μm/s) 精子头沿其平均路径移动的时均速率 平均路径是根据 CASA 仪器的算法将实际的曲线轨迹平滑化后计算出来的, 算法因仪器不同而有差异, 故不同 CASA 系统所得的数值可能不具有可比性 ALH(amplitude of lateral head displacement), 即精子头侧摆幅度 (μm) 精子头关于其平均路径的侧向位移幅度, 以侧摆的最大值或平均值表示 不同的 CASA 分析仪采用不同的算法计算 ALH, 故不同 CASA 系统所得的数值可能不具有可比性 LIN(linearity), 即直线性 曲线路径的直线性,VSL/VCL WOB(wobble), 即摆动性 实际的曲线路径关于平均路径的摆动值,VAP/VCL STR(straightness), 即前向性 平均路径的直线性,VSL/VAP BCF(beat-cross frequency), 即鞭打频率 (Hz) 精子曲线路径跨越其平均路径 3-3 CASA 系统检测参数的标准术语
141 118 第一部分精液分析 9. 的平均频率 MAD(mean angular displacement), 即平均角位移 ( 度 ) 精子头沿其曲线轨迹 瞬时转折角度的时均绝对值 不同的 CASA 分析仪采用不同的数学运算方法计算多项运动参数, 不同 仪器测量值之间的可比性尚属未知 CASA 虽然使用 DNA 荧光染色,CASA 分析仪可以精确地测定活动精子浓度和精子活动率, 但须严格遵守技术规范 (Garrett et al.,2003) 例如, 如果使用一次性计数池, 要从计数池上不同距离的几个位置来检测, 因为精子在计数池中的分布可能不均匀 (Douglas-Hamilton et al.,2005b) 结果的有效性必须要有血细胞计数板来验证 精子浓度在 /ml~ /ml 时, 可以直接用于检测 (Garrett et al.,2003), 如果标本的精子浓度高于 /ml, 需要进行稀释 ( 见 节 ) CASA 分析仪能够检测并计数有荧光的精子头部, 但如果不进行显微镜下观察, 就无法得知精子是否完整 ( 即精子头是否连有精子尾 ) 影像分析具有使精子形态学评估量化 客观性和可重复性获得重要进展的潜力 现在已有商品化的分析系统, 可用来定量分析精子头部形态学 中段甚至主段的形态 然而, 影响精子运动能力的尾部缺陷可以采用 CASA 测量精子活力和运动方式来进行更直接的评估 CASA 系统一般可以把精子头部和中段分类为正常或者不正常, 还可以给出头部和中段尺度 头部椭圆率和匀称性的均数 标准差和中位数, 以及对染色的精子顶体区进行测量 自动分析系统比手工操作具有更好的客观性 精确性和可重复性 (Menkveld et al.,1990) 自动分析系统的精确性和可重复性可小于 7%(Garrett & Baker,1995), 优于由熟练操作人员所做的人工评估 然而, 方法学上的不一致如聚焦 照明 样本处理和染色等不同 (Lacquet et al.,1996;menkveld et al.,1997), 以及正确区分精子头部和精液碎片的技术难度 ( 尤其是精子浓度很低时 )(Garrett & Baker, 1995;Menkveld et al.,1997;coetzee et al.,1999a,b), 都可能会影响计算机辅助精子形态计量分析 (computer-aided sperm morphometric assessment,casma) 结果的可重复性和准确性 自动分析的属性也意味着没有办法弥补样本制备缺陷和人工假象, 因此, 相对于精子染色背景阴影的细小差异都可能导致不正确的分类, 或者不能识别出精子, 从而导致结果的偏差 同人工形态学评估一样,CASMA 也应当使用标准化程序和设备, 以及进行质量控制, 以确保得到可比且可靠的结果 精液应当按 节所描述进行处理, 以减少 CASMA 记录的背景, 如果精子浓度低 (< /ml), 应按 节所描述离心浓缩标本
142 第 3 章可供选择的方案 119 离心可能会影响精子的形态, 如果离心处理, 必须记录 两项研究已经报道了 CASMA 结果与生育力评价的终点指标之间的显著相关性 :Coetzee 等 (1999c) 显示自动分析的正常形态精子结果是预示体外受精率和妊娠率的有意义指标 Garrett 等 (2003) 发现, 精液中能与卵透明带结合的 具有某种头部特征的精子百分率 (Z%), 和直线运动 (VSL) 的精子的百分率, 与一大组亚生育力夫妇的自然受孕率显著相关,Z% 和 VSL 与生育力之间的关系似乎是连续的, 并且显示没有临界值, 高于临界值, 妊娠率也没有进一步增加 CASA 应用于分析精子形态学, 还需要对大样本人群的生育力结局进行更多的研究 自动分析系统可为质量控制提供数据, 但其临床价值需做更多的研究
143 120 在进行精子功能试验时, 很关键的一点是要在精液射出后 1 小时内将精子从精液中分离出来, 这样可避免精液中非精子细胞所产生物质对精子的损害 对精子功能调控的分子机制的深入了解, 有助于发展新的精子功能诊断方法 例如, 最近的数据强调了精子核 DNA 致密化及其完整性对于人精子功能的重要性, 该数据受到关注, 一些报道也提示了精子核 DNA 完整性及染色质的组装与生育力有关 (Sakkas et al.,1998;aitken & Krausz,2001;Virro et al.,2004) 与之类似, 调控精子功能的信号传导通路方面的研究进展, 对于发展精子功能诊断方法, 阐明不育男性精子异常的具体机制, 也有着极其重要的意义 为研究导致男性不育深层次的生物学基础, 已经开发了一系列的功能试验, 以评价人精子在受精过程中必需的基本功能 : 与卵透明带结合 顶体胞吐 与卵膜融合等 4.1 reactive oxygen species ROS 一般认为, 过多的活性氧产生和存在高活性的胞浆酶类 ( 如肌酸磷酸激酶 ), 可以反映出异常精子中段有过量残留胞浆 (Rao et al.,1989;gomez et al.,1996; Aitken et al.,2004) 活性氧是氧的代谢物, 包括超氧阴离子 过氧化氢 氢氧基 过氧羟自由基 氧化亚氮等 过高浓度的活性氧可以诱导细胞的脂类 蛋白和 DNA 氧化损伤, 从而启动病理变化 (Griveau & Le Lannou,1997;Aitken et al.,2003;henkel et al., 2004) 大部分的细胞具有抵抗活性氧作用的系统, 包括酶抗氧化系统 ( 超氧化物歧化酶 谷胱甘肽过氧化酶 过氧化氢酶 ) 和非酶抗氧化系统 ( 尿酸 抗坏血酸 维生素 E), 当精子中的抗氧化系统被破坏, 精子功能就会受损 (Agarwal et al., 2004) 人精液中的活性氧由精子 (Aitken & Clarkson,1987;Alvarez et al.,1987; Iwasaki & Gagnon,1992) 和白细胞 (Aitken & West,1990) 产生 精浆中含有自由基的抗氧化清除物和抗氧化酶, 而有些男性则缺乏这些物质 (Jones et al.,1979; Smith et al.,1996), 所以, 在辅助生殖技术中精子制备时, 去除精浆会使精子更容易遭受氧化损伤 过多的活性氧产生导致氧化损伤和人精子功能受损, 以及核和线粒体 DNA 的损伤 (Sawyer et al.,2003) 精子存活试验常用于评价精子的质量, 其结果与精子的脂质过氧化密切相关 (Gomez et al.,1998) 采用鲁米诺 (luminol) 或光泽精 (lucigenin) 为探针的化学发光法, 可用于检测人精子的活性氧生成量及氧化还原活性
144 第 4 章用于研究的方法 原理在该方法中, 应用了敏感的光度计和化学发光探针 ( 如鲁米诺 ), 检测人精子所产生的微弱光信号 以下描述的方法是联合应用鲁米诺和辣根过氧化物酶来检测过氧化氢产生的敏感方法 其他探针 ( 如光泽精 ) 也可用于检测经洗涤人精液中生的活性氧 (Aitken et al.,1992;mckinney et al.,1996) 由于人精子表面没有甲酰三肽 ( 甲酰 - 甲硫氨酰 - 亮氨酰 - 苯丙氨酸,formylmethionyl-leucyl-phenylalanine,FMLP) 受体, 所以, 应答于 FMLP 为探针所产生的信号是白细胞特异性的 可用含已知数量的多形核白细胞悬液来校准数据 ( 图 4-1) 1 用这些探针所检测到的准确活性仍有待商榷 (Aitken et al.,2004), 但所得到的数据反映了精子功能 (Zorn et al.,2003;said et al.,2004) 2 一个白细胞能够产生的活性氧, 可达一个精子所产生的 100 倍以上, 所 以, 即使少量的白细胞污染也足以对精子悬液的化学发光信号产生很大的影响 试剂 Hanks 平衡盐溶液 (Hanks balanced salt solution,hbss), 不含酚红 : 附录 4, A4.5 节 Krebs-Ringer 液 (Krebs-Ringer medium,krm), 不含酚红 : 附录 4,A4.7 节 鲁米诺 (25mmol/L): 将 29mg 鲁米诺 (5- 氨基 -2,3- 二氢 -1,4- 二氮杂萘二酮 ) 溶于 10ml 二甲基亚砜 (DMSO) 中 辣根过氧化物酶 ( 型,310IU/mg 蛋白 ): 取 5mg(1550IU) 溶解于 1ml KRM 液中 FMLP( 白细胞特异性探针,10mmol/L): 将 44mg FMLP 溶于 10ml DMSO 中 PMA(12- 十四酸佛波酯 -13- 乙酸盐,phorbol 12-myristate 13-acetate),1mmol/L 储存液 : 取 6.2mg PMA 溶解于 10ml DMSO 中 使用时, 将 1mmol/LPMA 用 DMSO 稀释 100 倍, 得到 10μmol/L 的工作液 酵母多糖 明胶 :0.1%(1g/L), 溶解于 HBSS 中 酵母多糖的制备 加 500mg 酵母多糖于 10ml HBSS 中, 制成悬液 剧烈涡旋振荡 在加盖的烧杯中煮沸 20 分钟, 以防蒸发 以 500g 离心 5 分钟 加 10ml 的 HBSS 洗涤沉淀团
145 122 第一部分精液分析 4-1 酵母多糖刺激白细胞产生的化学发光信号白细胞浓度与化学发光信号之间存在对数线性关系 (Data courtesy of RJ Aitken) 重复操作 4 和 5, 再洗一次 将沉淀团重悬于 5ml 的新鲜人血清中, 轻柔吹打混匀 孵育 20 分钟 以 500g 离心 5 分钟 用 10ml 的 HBSS 洗涤沉淀 重复操作 9 和 10, 再洗一次 将沉淀团重悬于 10ml HBSS( 含 0.1% 明胶 ), 使终浓度为 50mg/ml, 轻柔吹打混匀 将配制的悬液冻存于 20 待用 检测自发产生的活性氧 1. 充分混匀精液标本 ( 方框 2-3), 取一定体积的精液 ( 含 个以上精子 ) 用于 ROS 检测 2. 用 KRM 液洗涤精子 ( 见 5.3 节 ), 并调整精子浓度为 /ml 3. 取 400µl 洗涤后的人精子悬液, 悬于不含酚红的 KRM 液中, 加入至一次性光度计容器中 小心操作, 避免产生气泡 4. 加入 4µl 浓度为 25mmol/L 的鲁米诺 5. 加入 8µl 浓度为 1550IU/ml 的辣根过氧化物酶溶液 6. 在 37 下监测光度计的化学发光信号约 5 分钟, 直至信号稳定 添加 FMLP 酵母多糖和或 PMA, 能够诱导精液中的白细胞产生活性氧, 此外,PMA 也能诱导精子产生活性氧 FMLP 诱导白细胞产生活性氧取 2µl 浓度为 10mmol/L 的 FMLP, 加入上述样本中以诱导精子悬液中的白细胞产生化学发光信号 ( 图 4-2)
146 第 4 章用于研究的方法 细胞悬液中白细胞和精子的活性氧产生的相对量 (a) 在有白细胞污染时, 加入白细胞特异性探针 FMLP 后, 产生一个尖锐的活性氧信号峰 再加入 PMA, 精子和白细胞群产生一个持久的强化学发光信号峰 ;(b) 在没有白细胞污染时,FMLP 反应则消失, 而 PMA 引发一个由精子产生的显著化学发光信号峰 ( 也见 Krausz et al.,1992)(data courtesy of RJ Aitken) 酵母多糖诱导白细胞产生活性氧取 20µl 经调理制备的酵母多糖混合液, 加入上述样本中以诱导精子悬液中的白细胞产生化学发光信号 所产生化学发光信号的大小直接与精液中白细胞污染水平成比例 ( 图 4-1) PMA 刺激白细胞和精子产生活性氧 将 PMA 储存液用 DMSO 按 的比例稀释成 10µmol/L 的工作液 待 FMLP 或调理酵母多糖的信号减退 加入 4µl 浓度为 10µmol/L 的 PMA 工作液处理精子悬液 ( 终浓度为 100nmol/L), 刺激精子产生化学发光信号 ( 图 4-2) 结果 通过观察人精子悬液的化学发光图形可间接分析精液中是否存在白细胞污染 精子与卵透明带的结合启动顶体反应, 释放游离的溶解性顶体成分并暴露出结合的溶解性顶体成分, 在经超激活而增强的鞭毛运动的驱动下使精子穿透卵透明带基质 为了检测这一过程若干环节, 可使用来源于尸检 卵巢切除术或体外受精失败的没有活性和未受精的人卵母细胞 这些试验可使用盐溶液中储存的卵母细胞, 但试验受到人卵母细胞来源的限制 (Yanagimachi et al.,1979;kruger et al.,1991;liu & Baker,1992b;Liu et al.,2004)
147 124 第一部分精液分析 4.3 有一种卵透明带结合试验方法被称为半卵透明带检测试验, 是将卵透明带显微切割成对等的两半, 分别与相同浓度的待检测精子和对照精子进行试验 (Burkman et al.,1988) 另一种卵透明带结合试验(Liu et al.,1988,1989), 是用不同的荧光染料分别标记待检测精子和对照精子, 即待检测精子用一种荧光染料染色 ( 如荧光素 ), 而对照精子用另一种荧光染料染色 ( 如罗丹明 ), 计算结合在同一个卵透明带上的待检测精子和对照精子的数量和比值 两种卵透明带结合试验所得结果均与体外受精率相关 (Liu & Baker,2003) 当体外受精失败或受精率低 特发性不育或畸形精子症时, 评价结合在卵透明带上的精子数目可能具有临床价值 (Franken et al.,1989;liu & Baker,1992a, 2004) 很少或没有精子结合在卵透明带上, 通常提示精子有缺陷 4.4 精子结合卵透明带后, 在卵透明带上发生生理性顶体反应 所以, 可用从卵透明带表面取下的精子, 或用人卵透明带分离出的蛋白处理精子, 来检测卵透明带诱发的顶体反应 (Liu & Baker,1994,1996;Franken et al.,2000) 在畸形精子症和少精子症的患者中, 尽管一些患者的精液分析结果可能正常, 但其精子在卵透明带诱发顶体反应方面存在缺陷, 或者是能与卵透明带结合, 但顶体反应较弱 (Liu et al.,2004) 人卵透明带很难得到, 使得这些方法的应用受到了限制, 且由于精子与卵透明带结合的种属特异性, 也不可用其他灵长类的卵透明带替代 (Bedford,1977;Liu et al.,1991b;oehninger et al.,1993) 其他的刺激方法, 如钙离子载体可以诱发顶体反应, 但其结果与卵透明带诱发的顶体反应不相关 (Liu & Baker,1996) 诱发顶体反应后的顶体状态检测可用荧光标记的凝集素( 如豌豆凝集素 花生凝集素 )( 见 节 ) 或顶体抗原 CD46 的单克隆抗体 (Cross,1995), 通过显微镜或流式细胞仪 (Fenichel et al.,1989;henley et al.,1994;cooper & Yeung, 1998) 分析结果 这项方法由 Cross 等 (1986) 首先建立, 随后 Liu 和 Baker(1988) 进行了改进 改良的方法更为简单, 重复性好, 而且获得非常清晰的图像 ( 图 4-3) 建议使用精子制备技术去除白细胞 生殖细胞和死精子等污染物, 以获得高活力精子 因此需根据精液标本的质量, 对标本进行洗涤 ( 见 5.3 节 ) 上游 ( 见 5.4 节 ) 或者密度梯度离心 ( 见 5.5 节 ) 试剂 1. PSA-FITC: 豌豆凝集素 (Pisum sativum agglutinin,psa), 用异硫氰酸荧光素 (FITC) 标记
148 第 4 章用于研究的方法 磷酸盐缓冲液 (PBS),pH 为 % 的氯化钠溶液 (9g/L): 将 0.9g 氯化钠溶解于 100ml 水中 95%(v/v) 的乙醇溶液 PSA 储存液 : 将 2mg 用 FITC 标记的 PSA 溶解于 4ml PBS 中 以每管 0.5ml 分装, 冻存于 20 PSA 工作液 : 将 0.5ml PSA 储存液稀释于 10ml PBS 中, 储存于 4 备用 ( 可存放 4 周 ) 简单的精子洗涤 充分混匀精液标本 ( 方框 2-3), 取 0.2ml 用 0.9% 的氯化钠溶液 (9g/L) 稀释至 10ml 以 800g 离心 10 分钟 弃去上清液, 仅留下 20~40µl 上清液 轻柔吹打, 将精子沉淀团重悬于留下的上清液中 重复以上精子洗涤操作步骤 已纯化精子的处理 用生理盐水将上游 ( 见 5.4 节 ) 后或经过一次密度梯度离心 ( 见 5.5 节 ) 的精子悬液稀释至 10ml 以 800g 离心 10 分钟 弃去上清液, 仅留下 20~40µl 上清液 轻柔吹打, 将精子沉淀团重悬于留下的上清液中 精子涂片制备 取 5µl 精子悬液, 制成约 1cm 长的精子涂片, 共做 2 张重复涂片 在 400 倍相差显微镜下观察湿涂片 确保精子均匀分布在玻片上, 不聚集 空气中干燥玻片 95%(v/v) 乙醇固定 30 分钟 空气中干燥玻片 PSA-FITC 染色 加 10ml PSA-FITC 工作液到垂直染色缸中 将已固定并空气干燥的涂片浸在 PSA-FITC 荧光染料中 4, 染色 1 小时以上 用纯净水洗涤每张玻片, 并且用可溶于乙醇的封片剂 ( 见 节和 节 ) 封片 染色时间长 ( 长至 18 小时 ) 并不影响 PSA 结果, 但染色时间短 ( 不足 1 小 时 ) 难以评估玻片
149 126 第一部分精液分析 结果评估 用 450~490nm 激发光, 于 400 倍油镜下观察精子涂片 精子分类如下 : 顶体完整 (acrosome-intact,ai): 精子头部一半以上荧光染色明亮且均匀 ( 图 4-3) 已发生顶体反应 (acrosome-reacted,ar): 精子仅在赤道带出现荧光带, 或者顶体区根本没有荧光染色 顶体异常 : 除上述两类精子外的所有其他精子 4-3 人精子豌豆凝集素 (PSA) 荧光染色图示顶体完整 (AI) 精子头的前部 ( 顶体区 ) 染色, 已发生顶体反应 (AR) 精子赤道带或顶体后区染色 (Micrograph courtesy of HWG Baker) 已发生顶体反应精子的计数 借助实验室计数器, 计数每种顶体类型精子 (AI 和 AR) 的数目 每张涂片计数 200 个精子, 以达到可接受的低取样误差 ( 方框 2-5) 计算 2 张重复涂片已发生顶体反应精子百分率的平均值和差异 根据表 2-1 图 A7-2 附录 7 来确定差异的可接受性 ( 每个数值显示, 预期发生在 95% 的标本中, 仅由于取样误差所致的两个百分率之间的最大差异 ) 如果两个百分率之间的差异是可接受的, 报告已发生顶体反应精子的平均百分率 如果差异太大, 则重新评估两张涂片 ( 方框 2-6) 以最接近的整数报告已发生顶体反应精子百分率 顶体反应发生在精子与卵透明带结合之后的胞吐过程 且在精子穿透卵母细胞膜并与卵母细胞融合前, 必然发生顶体反应 钙内流被认为是正常顶体反应的起始事件 使用钙离子载体诱导钙内流, 是检测已获能精子发生顶体反应的能
150 第 4 章用于研究的方法 127 力的一种手段 (Aitken et al.,1993), 也是本检测方法的理论基础 这种检测方法也称为离子载体激发的顶体反应试验 (acrosome reaction after ionophore challenge, ARIC) 然而, 在顶体状态检测作为一种常规临床检测前, 尚需更多研究支持 试剂 Ham s F-10 HSA 培养液 : 含 3.5%(35g/L) 人血清白蛋白 (HSA) 的 Ham s F-10 培养液 ( 见附录 4,A4.4 节 ) BWW 储备液 ( 见附录 4,A4.1 节 ) 二甲基亚砜 (DMSO) 钙离子载体 A23187 储备液 ( 浓度为 1mmol/L): 将 5.23mg 的 A23187 溶解于 10ml 的 DMSO 中 3%(v/v) 戊二醛或 70%(v/v) 乙醇 步骤 刚取出的精液放置 30~60 分钟, 使之完全液化 每次检测, 配制新鲜的 Ham s F-10 HSA 诱导获能培养液 培养液在使用前应 37 预热, 最好置于含 5% CO 2 和 95% 空气的培养箱内进行孵育 用新鲜的 Ham s F-10 HSA 培养液, 通过密度梯度法 ( 见 5.5 节 ) 获得高活力精子团, 去除如白细胞 生殖细胞和死精子等污染物 准备 1 个对照管和 2 个重复检测管, 每管约 1ml 精子悬液, 内含 个活动精子 将精子悬液在 37,5% CO 2 和 95% 空气的培养箱内孵育 3 小时 ( 拧松管盖, 使气体交换 ), 诱导获能 如果没有 CO 2 培养箱, 可以用 Hepes 缓冲培养液 ( 见附录 4,A4.1 节, 注释 1), 拧紧管盖, 在 37 孵育 向 2 个重复检测管中加入 10µl 浓度为 1mmol/L 的 A23187 储存液, 使终浓度为 10μmol/L 对照管中加入 10µl 的 DMSO 全部管置于 37 孵育 15 分钟 从每管中取出少量悬液评估精子活力 加入 100µl 3%(v/v) 戊二醛或 70%(v/v) 乙醇, 终止反应 将已固定的精子涂布在洁净玻片上, 空气干燥 用荧光标记物染色精子 ( 见 节 ) 用 450~490nm 激发光,400 倍油镜下评估精子 计算检测管 ( 检测 %AR) 和对照管 ( 对照 %AR) 中, 已发生顶体反应的精子百分率 结果分析 1. 离子载体激发的顶体反应 (ARIC) 结果为检测管已发生顶体反应的精子百分 率减去对照管已发生顶体反应的精子百分率
151 128 第一部分精液分析 正常差异值约为 15%AR 如果低于 10%AR 则为异常 数值介于 10% 和 15%AR 之间, 提示精子功能可能异常 如果对照管的数值 > 15%, 则提示过早发生了自发的顶体反应 质量控制 每次试验必须有阳性对照的质量控制标本 [ 精子取自先前对离子载体反应良好的男性精液标本 ( 已发生顶体反应的精子百分率 > 15%)] 在新配制的染料应用前, 为确保每批新配制的染料配制适当, 必须用已知阳性反应的质控精子同旧染料一起进行交叉试验 4.5 在功能上, 人精子与仓鼠卵母细胞的融合相同于与人卵膜的融合, 这一过程是通过已发生顶体反应的人精子赤道环上覆盖的质膜来启动 仓鼠卵穿透 (HOP) 试验, 或精子穿透试验, 与生理状态所不同的是不存在卵透明带 以下描述的是这项试验的标准方案 常规的仓鼠卵穿透试验, 取决于在体外长时间孵育的精子群体自发地发生顶体反应 由于体外孵育不及生物学过程有效, 而且可能涉及多种不同机制, 因此经常会出现假阴性结果 ( 在仓鼠卵穿透试验中失败的某男性精子, 但在体外或体内却成功地使人卵母细胞受精 )(WHO,1986) 尽管潜在的受这种混淆结果的限制, 这项试验仍可以提供获能精子头部膜基因融合的信息 随着精子 - 卵透明带的相互作用, 启动顶体反应的两个关键细胞内信号是钙流入和胞浆碱化作用 这两种细胞内信号均可用二价阳离子载体人工产生 (Aitken et al.,1993), 下面也描述了一种使用离子载体刺激精子的替代方法 试剂 BWW 贮备液 : 见附录 4,A4.1 节 透明质酸酶 (300~500IU/mg) 型胰蛋白酶 ( BAEE U/mg) 蜡 ( 熔点 48~66 ) 凡士林 石蜡油 去透明带仓鼠卵 : 可在市场上购买, 或者通过仓鼠的超排卵来获取 ( 方框 4-1) 二甲基亚砜 (DMSO) 离子载体 ( 用于替代方案 )1mmol/L 贮备液 : 将 5.23mg 二价阳离子载体 A23187, 溶解于 10ml DMSO
152 第 4 章用于研究的方法 确保注射活动物符合所有的伦理学要求 制备合适剂量的孕马血清 (PMSG) 和人绒毛膜促性腺激素 (hcg) 溶液 小瓶分装 使用前储存在 20 在性未成熟仓鼠, 或处于动情期第 1 天的成熟仓鼠, 腹腔内注射 30IU PMSG 48~72 小时后, 给仓鼠腹腔内注射 hcg 40IU 用一只手抓紧仓鼠的背部, 并且拉紧其腹腔上的皮肤 ; 另一只手持安有 21 号针头的 1ml 注射器, 将激素注射入仓鼠腹腔 ( 恰好在髋关节上 ) 注射另一只仓鼠时要更换针头, 以使针头容易穿透皮肤, 使动物的不适减至最少 不加入离子载体激发的标准方案 充分混匀精液标本 ( 方框 2-3) 用密度梯度离心法 ( 见 5.5 节 ) 或者上游法 ( 见 5.4 节 ) 制备精液标本 吸去精子团上的大部分上清液 用移液器轻柔地吹打精子团, 并且测定精子团中的精子浓度 ( 见 2.7 和 2.8 节 ) 用 0.5ml 的培养液, 将精子团稀释为 个精子 /ml 将试管倾斜与水平面成 45 角, 以增加管内精子悬液的表面积 在 37 含 5%(v/v)CO 2 的空气中孵育精子悬液 18~24 小时, 诱导获能 ( 旋松试管盖, 允许气体交换 ) 如果没有 CO 2 培养箱, 可以应用 Hepes 缓冲培养液 ( 见附录 4,A4.1 节, 注释 1), 塞紧试管盖, 在 37 中孵育 将试管恢复垂直位置 20 分钟, 使获能后不活动的精子沉降下来 在上清液上 1/3 处吸取活动精子, 注意勿扰动界面处的死精子, 将它们移入一支新试管 调整浓度为每 ml 培养液含 个活动精子 用正向置换式移液器吸取已知体积 (50~150µl) 的精子悬液, 缓慢地将精子 悬液散在滴布于小的 Petri 培养皿中 用一支一次性塑料吸管, 吸取经 CO 2 平衡和预温的石蜡油, 覆盖住精子滴, 注意勿扰乱精子悬液, 在周围加入足够的石蜡油并正好覆盖住每个精子滴 加入 Ca 2+ 离子载体的替代方案 1. 如 5.5 节所述, 用密度梯度法制备高活力精子团 2. 吸出 80% 密度梯度液层底部的液团, 并转入到 8ml BWW 液中 3. 以 500g 离心 5 分钟 4. 轻轻地倒出大部分上清液, 然后用移液器轻柔地吹打精子团 5. 测定精子团中的精子浓度 ( 见 2.7 和 2.8 节 ), 用新鲜 BWW 液稀释为 个活动精子 /ml 6. 在 2 份 1ml 的精子悬液中分别加入 1.25µl 和 2.5µl 的 A23187 贮备液 (1mmol/L), 以获得 1.25µmol/L 和 2.5µmol/L 的两个终浓度 7. 37, 将精子与离子载体一起孵育 3 小时 8. 以 500g 离心精子 5 分钟 9. 轻轻地倒出大部分上清液, 然后用移液器轻柔地吹打精子团 10. 测定活动精子百分率
153 130 第一部分精液分析 用新鲜 BWW 液稀释至约 个活动精子 /ml 使用低至 个活动 精子 /ml 的浓度, 仍可以获得正确结果 按 节步骤 11 的描述制备精子液滴, 覆盖石蜡油 离子载体处理的剂量反应曲线存在个体差异, 因此最好检测两种离子载 体的浓度 收集卵巢 注射 hcg 后 18 小时内, 按照相关的动物保护与使用委员会所批准的方法处死仓鼠, 回收卵母细胞 背部朝下放置仓鼠, 用 95% 乙醇涂湿腹部皮毛 用带齿的镊子夹住皮肤, 用剪刀剪开皮肤和肌肉, 暴露出子宫和卵巢 用 95% 乙醇棉球揩去镊子和剪刀上的皮毛 把肠子推出腹腔, 暴露出子宫角 用镊子夹住一侧子宫角, 从腹腔提出, 暴露出输卵管 卵巢和卵巢韧带 用镊子夹住子宫角最远的部分, 紧贴着镊子下方剪断子宫末端 剪下卵巢, 放入小的培养皿内预温 (37 ) 的 BWW 液中 用同样方式收集另一侧卵巢 收集卵丘细胞团 用倒置显微镜透射光检查卵巢, 确定输卵管膨大部位中含有卵母细胞的颗粒细胞的位置 用镊子夹住输卵管, 用 21 号针头刺破膨大区, 卵丘团会从刺破孔涌出 用针拨出卵丘团 用镊子挤压输卵管, 移出全部卵丘团 回收和处理卵母细胞 用针和镊子将颗粒细胞团集拢在一起, 然后把这些颗粒细胞团移入表面玻璃皿 滴试板 或者其他浅底容器中 容器中盛有含有 0.1%(1g/L) 透明质酸酶, 预温 并经 CO 2 平衡的 BWW 液 用铝箔覆盖容器, 使颗粒细胞团避光, 并在室温下孵育 10 分钟, 用倒置显微镜观察颗粒细胞的分散情况 用火焰烧拉制成的玻璃移液管 ( 方框 4-2), 从透明质酸酶液中转移已分离出的卵母细胞到经预温和平衡的 BWW 液里 通过转移卵母细胞到新鲜的预温和平衡的 BWW 液滴中, 漂洗回收的卵母细胞 2 次 这个程序可以在玻璃多孔板或滴试板上完成 每次转移卵母细胞之间, 用 BWW 液漂洗移液管 在室温下, 用 0.1%(1g/L) 胰蛋白酶 (10 000IU/ml) 消化处理卵母细胞约 1 分钟, 以酶解除去卵透明带 用倒置显微镜观察卵透明带的消化情况 一旦卵透明带已经溶解, 立即移出卵母细胞 用 BWW 液漂洗卵母细胞 3 次
154 第 4 章用于研究的方法 预热分离出的卵母细胞, 将卵母细胞移入精子悬液中 另一种方法是, 将分离出的卵母细胞在使用 24 小时前储存在 在 Bunsen 火焰灯上方转动玻璃毛细管或巴氏移液管, 用双手分别持着玻璃管的两端, 在火焰上前后滚动, 使其均衡受热 在玻璃管刚要熔化时, 迅速拉开双手, 拉长玻璃管 将玻璃管的细线段折断到理想的开口宽度 ( 约 1mm) 将移液管没有拉制端用胶管连接到 1ml 注射器上 配子共培养 将去透明带卵母细胞分配入几个精子液滴中, 每个液滴放入约 5 个卵母细胞 ( 例如, 每份精液标本用 20 个卵母细胞, 制备 4 个精子悬液滴, 每个液滴 5 个卵母细胞 ) 将 1 组约 5 个卵母细胞吸入移液管, 装入的培养液量要少, 以使精子悬液不会被稀释太多 将玻璃移液管的尖端直接插入精子悬液滴的中央, 缓慢地放入卵母细胞, 保持着正压力以避免石蜡油吸入移液管, 注意勿将气泡打入精子液滴 移液管从精子悬液滴中移出来后, 揩去移液管尖端过多的石蜡油 重复步骤 3, 直至全部卵母细胞转入精子悬液滴 每次转移卵母细胞后, 在 BWW 液中彻底地冲洗移液管, 以避免精子的交叉污染 在 37 含 5%(v/v)CO 2 的空气中孵育配子 3 小时 从石蜡油滴中回收卵母细胞 在转移卵母细胞到 BWW 液前, 注释揩去移液管尖端的石蜡油 用火焰拉制成的巴氏移液管, 在 BWW 液中冲洗掉疏松附着在卵母细胞上的精子 卵母细胞的分析 用蜡 - 凡士林混合物 ( 方框 3-1) 在载玻片上做 4 个柱子以形成一个矩形, 以它的角支撑起盖玻片 (22mm 22mm, 厚度号码 1.5,0.17mm) 在 4 个支柱中央放入含有卵母细胞的 BWW 液小滴 盖玻片放在 4 个支柱上, 轻轻地压盖玻片, 至卵母细胞变扁 显微镜观察解凝聚的精子头需要充分压扁卵母细胞 如果必要, 多添加一些 BWW 液, 充满盖玻片, 以避免压碎卵母细胞 在相差显微镜 200 倍下检查制备情况 计数带有尾或靠近尾部的解凝聚精子头的数量 ( 图 4-4) 记录至少有 1 个精子穿透的卵母细胞百分率 记录穿透每个卵母细胞的精子数 记录经最初冲洗卵母细胞后, 仍然结合在卵母细胞表面的精子数, 因为这可以得到发生顶体反应的精子比率
155 132 第一部分精液分析 4-4 含有人精子的去卵透明带仓鼠卵母细胞的相差显微镜照片宽箭头指示胞浆中解凝聚的精子头 ; 窄箭头指示在卵母细胞表面未穿透的精子 [Reproduced from Aitken et al.(1983)with kind permission of Springer Science+Business Media] 质量控制 本试验必须使用显示 > 50% 穿透的精液标本作为阳性对照 4.6 已经使用多种方法测试精子染色质和 DNA 的正常性 这些方法都使用与组蛋白 ( 苯胺蓝 ) 结合或与核酸 ( 吖啶橙, 色霉素 ) 结合的染料, 而且应用组织学方法或流式细胞仪检测 较新的方法包括 DNA 链断裂的检测, 例如脱氧核糖核苷酸末端转移酶 (TdT) 介导的三磷酸脱氧核糖核苷酸 (dutp) 缺口末端标记 [ 短的用 TUNEL( 原位末端标记,ISEL)], 彗星试验或精子染色质扩散 (SCD) 试验 这些试验的结果之间互相关联 (Chohan et al.,2006), 并且与精子形态学 精子活力和精子存活率相关 这些试验可以给出有关标准体外受精的受精率, 还可能, 有关于自然妊娠率的额外信息 精子染色质结构试验 (SCSA) 能够预示体内和体外的受精失败 (Evenson & Wixon,2006) 尚不清楚这些试验与流产或其他妊娠结局是否存在相关性
156
157
158 在很多情况下, 需要将精子从精浆中分离出来, 用于精子功能检测 治疗性授精和辅助生殖技术 (ART) 等 在用于精子功能检测时, 在精液射出后 1 小时内将精子从精浆中分离出来尤显重要, 可减少精浆中非精子成分对精子的损害 1 计数精子太少时可能得到并不准确的结果 ( 见附录 7,A7.1.1), 进而影响到诊断与治疗 ( 见附录 7,A7.2) 但是当得到的精子数量少而又必须用于治疗时, 这种情况无从避免 2 当得到的精液量过少且计数的精子数比推荐数量少时, 计数的准确性将 大大降低 计数少于 400 个精子时, 需同时报告所计数精子的取样误差 ( 表 2-2) 虽然精浆有助于精子穿透宫颈黏液 (Overstreet et al.,1980), 但在应用宫腔内人工授精 (IUI) 或体外受精 (IVF) 等辅助生殖技术规避了宫颈等自然屏障时, 精浆中某些成分 ( 如前列腺素 锌 ) 可阻碍妊娠 将人精子从精液中分离出来, 最终制备出含高比例的形态学正常的活动精子且没有碎片 其他细胞及死精子的精子悬液, 对于临床很重要 目前, 用培养液稀释精液然后离心的制备方法仍然应用于精液正常标本的 IUI(Boomsma et al.,2004), 但是, 对于有一项或多项精液参数异常的精液标本, 最好采用密度梯度离心法和直接上游法 (Morshedi et al.,2003) 有报道表明 (Rhemrev et al.,1989;johnson et al.,1996), 玻璃棉柱可用于分离质量欠佳的精液标本中的精子, 其效果与密度梯度离心法相当 精子制备方法的选择取决于精液标本的质量 (Canale et al.,1994) 例如, 直接上游法常用于精液参数基本正常的标本, 而在严重少精子症 畸精子症或弱精子症的情况下, 则选择密度梯度法更好, 因为可回收到更多的活动精子 密度梯度法也可根据各个标本的具体特点来优化处理方法 : 可减少梯度液的总体积, 以减少精子迁移的距离而最大限度地回收活动精子, 而对于黏滞性高的标本可增加离心时间 为得到易处理的精子沉淀团, 每个实验室都应该确定所需的离心力和离心时间 当精子数目极低时, 可能需要改变离心力和离心时间, 以尽可能回收精子 对推荐的离心力和离心时间做出改变时, 需要经严格的实验论证才可临床应用 精子制备最合适的方法可根据所制备出的精子的功能测试来确定, 如去透明带的仓鼠卵母细胞穿透试验 ( 见 4.5 节 )
159 136 第二部分精子制备 精子优选技术的效率通常用精子绝对数目 活动精子总数或者形态学正常的活动精子回收率来表示 上游法对活动精子的回收率 (< 20%) 一般低于密度梯度离心法 (> 20%)(Ng et al.,1992), 而且两种方法制备的最终精子悬液中精浆成分污染的水平也不同 用前列腺分泌的锌作为可溶性的精浆成分标志物,Björndahl 等 (2005) 证实了锌从精浆向上层上游液的扩散呈时间依赖性, 上游法制备的精子悬液中锌的浓度比密度梯度法高 精液标本可能含有有害病原体, 技术人员应该将精液视为生物危害物而极其小心地进行处理 精子制备技术在清除精液病原体上并不是百分之百的有效 ( 见 5.6 节 ) 附录 2 所列出的安全指南应该严格遵守, 良好实验室规范是实验室安全的基础 (WHO,2004) 5.2 以下部分将介绍三种简单的精子制备技术 在这些方法中, 推荐的培养液为含有蛋白和缓冲成分的平衡盐溶液, 这种溶液适合于精子的处理 对于辅助生殖技术而言, 如卵胞浆内单精子注射 (ICSI) 体外受精 (IVF) 人工授精 (AI) 配子输卵管移植 (GIFT) 等, 所用的人血清白蛋白必须高度纯化, 且无病毒 细菌和朊病毒 (prion) 等的污染, 目前, 这种用途的白蛋白已经商品化 如果培养箱内仅为空气及 37 环境条件, 培养液中必须含有 Hepes 或类似的缓冲成分, 试管盖必须拧紧 ; 如果培养箱有 5%(v/v)CO 2, 培养液最好以碳酸氢钠或类似成分作为缓冲系统, 并将试管盖松开允许气体交换 这样一来, 可以保证培养液 ph 值适宜于精子的存活 选择哪种缓冲液取决于精子处理的最终用途, 例如, 用于精子功能检测时, 一般要使用有助于精子获能的培养液, 其中通常含有碳酸氢钠 (25mmol/L) 精液采集需无菌操作 ( 见 节 ), 制备精子用于治疗用途时, 必须采用无菌技术和材料 5.3 这种简单的洗涤程序可回收最多的精子, 适合于精液参数好的标本, 常用于 宫腔内人工授精 BWW,Earle s,ham s F-10 或人输卵管液 (HTF)( 已有商品化试剂, 或见附录 4,A4.1,A4.3,A4.4 和 A4.6 节 ), 其中首选添加人血清白蛋白 (HSA) 或血清, 见以下的描述 HSA: 高纯度, 不含病毒 细菌 朊病毒和内毒素等 HSA 的用量 :50ml 培养液中添加 300mg HSA,1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠
160 第 5 章精子制备技术 血清的用量 :46ml 培养液中添加 4ml 热灭活 (56 20 分钟 ) 的患者血清, 1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠 充分混匀精液样本 ( 方框 2-3) 用培养液稀释精液标本 (1 2), 以便精子从精液中分离 将已稀释的悬液转移到多个离心管中, 最好每管不超过 3ml 以 300~500g 离心 5~10 分钟 小心吸取并丢弃上清液 加 1ml 培养液, 轻柔吹打, 重悬精子 以 300~500g 离心 5~10 分钟 小心吸取并丢弃上清液 根据使用目的 ( 如人工授精 ) 添加适量的培养液, 轻柔吹打, 重悬精子沉淀团, 以便测定精子的浓度和活力 ( 见 2.5 和 2.7 节 ) 可通过使用较少的离心管但增加每管的精液量来减少洗涤的次数 如果 这样做, 离心力和离心时间必须相应增加, 例如, 以 500~600g 离心 8~10 分 钟, 以确认精子完全沉淀成团 5.4 利用精子从精液上游到培养液中的能力来优选精子, 这种方法称为 上游法 在上游前精液最好不要稀释和离心, 以减少对精子膜的过氧化损害 (Aitken & Clarkson,1988) 直接上游法是分离活动精子的首选方法(Mortimer,1994a,b) 操作时, 可以是将培养液加到液化精液的上方, 也可以是将液化精液加到培养液的下方, 活动的精子就会游动到培养液里 这种技术回收的精子比洗涤法少, 但由于是依靠精子的活力进行的优选, 因此适合于精液中活动精子百分率低的情况, 如 ICSI 和 IVF 时使用 BWW,Earle s,ham s F-10 或 HTF( 见附录 4, 以及 A4.1,A4.3,A4.4 和 A4.6 节 ), 添加 HSA( 首选 ) 或血清, 见以下的描述 HSA: 高度纯化, 不含病毒 细菌 朊病毒和内毒素等 HSA 的用量 :50ml 培养液中添加 300mg HSA,1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠 血清的用量 :46ml 培养液中添加 4ml 热灭活 (56 20 分钟 ) 的患者血清, 1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠 充分混匀精液样本 ( 方框 2-3)
161 138 第二部分精子制备 取 1ml 精液置于 15ml 的无菌锥形离心管中, 在精液上方轻缓加入 1.2ml 培养液形成液层 或者是将精液小心地加在培养液的下方 将离心管倾斜 45, 以增加精液和培养液的接触面积,37 孵育 1 小时 轻轻将试管竖直, 吸取最上层 1ml 培养液, 其中包含高活力的精子 用 1.5~2.0ml 培养液稀释 以 300~500g 离心 5 分钟, 然后弃上清液 用 0.5ml 培养液重悬精子沉淀团, 检测精子浓度 总活动率和前向活动率 ( 见 2.5 和 2.7 节 ) 制备好的精液可直接用于治疗或研究 5.5 非连续密度梯度法能很好地将精子和其他细胞及碎片分开, 是分离高质量精子的最佳方法 这种方法比上游法更易于标准化, 因此结果也更稳定, 常用于 IVF 和 ICSI 中的精子制备 这种方法是将精液放置于由硅烷包被的胶体二氧化硅构成的密度梯度液的上方, 在离心过程中由于密度不同而分离, 另外, 活动精子主动游动, 穿过梯度液在管底形成一个松软的沉淀团 应用最广泛的是一种简单的两步法非连续密度梯度法, 通常由上层 40%(v/v) 下层 80%(v/v) 密度梯度液构成 用密度梯度离心法可获得部分活力很好的精子, 不含碎片 白细胞 非精子细胞和退化的生精细胞 用于精子制备的密度梯度液已商品化, 产品有很多, 应按照生产商的使用说明来使用, 任何改动都必须有证据的支持 大部分密度梯度液含有相对高分子量的成分, 鉴于这些分子固有的低渗透压特性, 使用时, 常用等渗于女性生殖道液体的培养液进行配制 BWW,Earle s,ham s F-10 或 HTF( 见附录 4, 以及 A4.1,A4.3,A4.4 和 A4.6 节 ), 添加 HSA( 首选 ) 或血清, 见以下的描述 HSA: 高度纯化, 不含病毒 细菌 朊病毒和内毒素等 HSA 的用量 :50ml 培养液中添加 300mg HSA,1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠 血清的用量 :46ml 培养液中添加 4ml 热灭活 (56 20 分钟 ) 的患者血清, 1.5mg 丙酮酸钠,0.18ml 乳酸钠 [60%(v/v) 糖浆液 ],100mg 碳酸氢钠 等渗密度梯度液 :10ml 10 浓缩培养液 ( 有商品化产品, 或见附录 4, 以及 A4.1,A4.3,A4.4 和 A4.6 节 ), 加上 90ml 密度梯度液,300mg HSA,3mg 丙酮酸钠,0.37ml 乳酸钠 [60%(v/v) 糖浆液 ],200mg 碳酸氢钠 80%(v/v) 梯度液 :40ml 等渗密度梯度液添加 10ml 培养液 40%(v/v) 梯度液 :20ml 等渗密度梯度液添加 30ml 培养液
162 第 5 章精子制备技术 139 虽然这些等渗密度梯度液名义上称作 100% 80% 和 40%(v/v), 但实际浓 度分别是 90% 72% 和 36%(v/v) 在试管中制备密度梯度液, 下层为 1ml 80%(v/v) 上层为 1ml 40%(v/v) 的密度梯度液 充分混匀精液样本 ( 方框 2-3) 将 1ml 精液放入密度梯度液上方, 以 300~400g 离心 15~30 分钟 必要时, 每份精液标本可用一个以上的试管 弃去精子沉淀团上的绝大部分上清液 用 5ml 培养液重悬精子沉淀团, 轻轻吹打 ( 有助于洗去密度梯度液 ), 然后以 200g 离心 4~10 分钟 重复上述第 4 步和第 5 步洗涤过程 用培养液重悬精子沉淀团, 轻柔吹打, 检测精子的浓度和活力 ( 见 2.5 和 2.7 节 ) 5.6 HIV 如果精液中有人类免疫缺陷病毒 (HIV), 在精浆和非精子细胞里可发现病毒 RNA 和前病毒 DNA 由于 HIV 受体 (CD4,CCR5,CXCR4) 只在非精子细胞表达, 所以密度梯度离心法后再使用上游法来制备精子, 被推荐为防止未感染的女性配偶受到感染的一种措施 (Gilling-Smith et al.,2006;savasi et al.,2007) 这种方法是通过密度梯度离心法去除病毒感染的非精子细胞和精浆 ( 位于密度梯度液的上清液中 ), 再用上游法获得无 HIV 感染的活动精子 ( 位于密度梯度液的沉淀中 ) 制备好的精子标本在使用前应用反转录聚合酶链式反应 (RT-PCR) 进行检测, 确认无 HIV 后才能用于 ART 虽然到目前为止, 结果还让人振奋, 但是, 还没有足够的证据显示通过精子制备可消除 HIV 感染的风险 这种技术只能在安全设施里进行, 以最大限度地降低无 HIV 感染的标本受到交叉污染的风险 (Gilling-Smith et al.,2005) 5.7 从睾丸组织和附睾中获取的精子需要经过特殊的处理 一般而言, 附睾穿刺取精的适应证是梗阻性无精子症而非睾丸生精功能低下, 因此, 相对而言能获得较多的精子用于治疗目的 附睾穿刺所获得样本中红细胞和非精子细胞的污染通常极少, 活动精子的分离和优选相对简单 如果穿刺获得了大量的附睾精子, 密度梯度离心法是一种有效的精子制备手段 ( 见 5.5 节 ), 但如果精子的数目较少, 则进行简单的洗涤 ( 见 5.3 节 ) 睾丸精子可用开放式活检或经皮穿刺活检来获取 睾丸精液标本不可避免
163 140 第二部分精子制备带有非生殖细胞和大量红细胞, 因此需要额外的措施分离获得洁净的精子 为了分离附着在精曲小管上的长形精子细胞 ( 睾丸精子 ), 需要采用酶学或机械方法 由于精子数目少 活力差, 睾丸精子制备只能用于 ICSI 将睾丸组织与胶原酶孵育 ( 如每毫升培养液含 0.8mg 的 1A 型溶组织梭菌 ) 37,1.5~2 小时, 每 30 分钟涡旋振荡一次 以 100g 离心 10 分钟, 然后检查精子沉淀团 用玻璃盖片将睾丸组织在培养液里压碎, 直到产生离散的组织匀浆 也可将细注射针头 ( 如一次性结核菌素注射器所附带的 ) 折弯成平行于培养 皿底部的样子, 从精曲小管剥离细胞 ICSI 加入 1.5ml 培养液洗涤精子标本 以 300g 离心 8~10 分钟 弃去精子沉淀团上大部分上清液, 用 0.5ml 培养液重悬精子沉淀团 评估精子的活力和数目 ( 一些标本的精子数目很少, 需要用更少的培养液重悬精子 ) 在培养皿中做一个 5~10μl 的培养液滴 用 CO 2 预平衡过的矿物油覆盖 在培养液中加入 5~10μl 的精子悬液 用 ICSI 吸管小心吸取培养液和矿物油交界面上的活动精子 转移精子到一种黏稠溶液的液滴中, 如 PVP[7%~10%(100g/L)] 5.8 一些男性射精时精液进入膀胱, 导致无精子症或无明显射出物 这种情况可 通过在射精后检查尿液中有无精子来证实 假如不可能进行药物治疗或治疗不成 功, 可以从尿液中回收精子 摄入碳酸氢钠碱化尿液, 可使进入尿液中的精子保 持活力的机会增加 (Mahadevan et al.,1981) 在实验室, 应该告知患者 : 排尿, 但不完全排空膀胱 ( 取精液前 ); 手淫法射精, 将精液射入标本容器中 ; 再次排尿至另一个装有培养液的容器中 ( 进一步碱化尿液 ) 射出的精液和尿液都应该进行分析 由于尿液体积大, 需要离心浓缩标本 (500g,8 分钟 ) 浓缩后的逆行射精标本和前向射精的精液 ( 如果有的话 ), 都能用 密度梯度离心法得到有效的处理 ( 见 5.5 节 )
164 第 5 章精子制备技术 一些患者射精障碍或不能射精, 可直接震动刺激阴茎或经直肠电刺激前列腺来采集精液 脊髓受伤的患者排出的精液通常精子浓度高 精子活力低, 含有红细胞和白细胞 电诱导射精的标本用密度梯度离心法可得到最有效的处理 ( 见 5.5 节 ) 无论制备的方法如何, 这些类型的精液通常含大量的不活动精子
165 精子的冷冻保存是很多精液分析实验室工作的一个重要组成部分, 特别是在那些与不育症临床有联系的实验室 人类精子低温生物学始于 20 世纪 40 年代后期 在当时, 发现甘油可以保护精子免受冷冻损伤, 由此开始了应用 79 干冰冻存人精子 (Polge et al.,1949; Bunge & Sherman,1953;Bunge et al.,1954) 嗣后, 随着液氮的应用和很多商业性精子库或协调性国家服务机构的建立, 精液冷冻保存在很多国家得以迅速发展 (Perloff et al.,1964;david et al.,1980;clarke et al.,1997;leibo et al.,2002) 目前, 结合不同的冷冻保护液和冷冻程序, 冷冻保存有多种方案 冻融后细胞的存活主要取决于能否将细胞内冰晶形成减少到最低程度 应用适当的冷冻保护剂及控制冷冻和解冻速率, 可以使细胞内形成冰晶的水分减至最少 (Sherman, 1990;Keel & Webster,1993;Watson,1995) 如果精子在 130 ( 玻璃化转变的温度 ) 之上经历时间过长, 特别是在解冻过程中, 可能会随着细胞内潜在损害性冰晶的生长而发生再结晶 人精子可以耐受一定范围内的冷冻和解冻速率 精子对初始阶段迅速降温 ( 冷休克 ) 引起的损害不很敏感, 可能缘于脂质双层不饱和脂肪酸膜的高流动性 (Clarke et al.,2003), 也可能是精子含水量低 ( 约 50%) 的特性, 使精子比其他细胞更能耐受冷冻保存造成的损伤 然而, 冷冻保存确实对人精子功能有不良效应, 特别是降低精子活力 一般而言, 冷冻和解冻后仅约 50% 的活动精子存活 (Keel & Webster,1993) 优化冷冻保存程序可使冷冻损伤降至最低, 并且可以由此增加妊娠率 (Woods et al.,2004) 应用供者冷冻精液进行人工授精的妊娠率, 通常与复温后的精子质量 授精时机, 特别是与接受精液妇女的因素如年龄 以前用供者精液人工授精的妊娠情况, 以及排卵 子宫输卵管疾患有关 (Le Lannou & Lansac,1993) 如果精液在合适条件下贮存, 精子质量不会随时间推移而发生明显的不良改变, 有报道用冷冻保存了 28 年的精液授精后成功出生了孩子 (Feldschuh et al.,2005;clarke et al.,2006) 精子冷冻保存可以有多种原因 ( 方框 6-1) 在某些情况下, 可能需要改良冷冻保存程序 ( 见 节 ) 1 为保存生育力或治疗不育症, 应储存可进行 10 次以上授精的足量正常标本以确保有一个好机会建立妊娠 对于异常精液, 一直没有证据表明多次采集标本合并用于 AIH 是有益的 2 因为每枚卵母细胞的 ICSI 仅需要一个精子, 因此任何活精子的冷冻保 存都是有价值的
166 第 6 章精子的冷冻保存 储存已知或假定有生育力的健康供精者的精液以备将来使用 临床或精子库可以招募供精者, 并且匿名使用他们的精子 接受精液捐赠者也可选择了解供精者的情况 供精者精子可以用于 AI IUI IVF 或 ICSI: 对没有活精子或没有适合做 ICSI 的长形精子细胞的不育男性, 或是在治疗失败或不能负担过于昂贵治疗费用的情况下, 其配偶可接受供精者精液 ; 避免遗传性疾病传递给下一代 ; 避免血型不合导致的胎儿溶血性贫血 ; 反复流产之后, 应用供精者精子授精可能成功怀孕的情况下 ; 有生育愿望却没有男性伴侣的女性 应该遵循国家及地方有关遗传基因筛查和传染性疾病筛查的法律法规 当男性暴露于可能导致生育力受损的有害因素或进行某种可能损害其生育力的治疗之前, 可以取出精液进行储存 例如 : 输精管切除术 ( 以防将来婚姻状况发生改变或者将来还想生育更多小孩 ); 有可能永久性损害生精功能的细胞毒素或放射线治疗 (Meseguer et al.,2006;schmidt et al.,2004); 从事危险职业的现役人员, 例如, 在某些允许死亡后生育的国家中的现役军人 精子可以储存用于配偶进行夫精人工授精 (AIH) IUI IVF 或 ICSI 可能用到的情况有 : 严重少精子症或精液中间歇存在活动精子 ( 以备 ICSI)(Bourne et al.,1995); 不育症的非持续性治疗, 例如生殖管道梗阻的手术治疗, 或下丘脑 - 垂体性腺功能减退的促性腺激素治疗 ; 需要以特殊方式采集精液, 例如脊髓损伤的患者辅助射精 逆行射精收集尿液中精子, 或从生殖管道中手术取精 ; 在辅助生殖治疗当天不能提供新鲜精液的患者 感染 HIV 的男性通过抗反转录病毒治疗病情控制后, 将检测不到病毒载量的精液储存, 用于 IUI IVF 或者 ICSI 使其配偶妊娠, 以减少 HIV 感染的危险 3 在生育力丧失之前进行精液采集和储存, 能够给予储存者未来做父母的希望, 因而常具有明显的心理作用, 如 : 接受烷化剂或放射线治疗的患者, 精子有遗传学改变的危险, 因此必须在治疗开始前采集精液 应该为所有需要接受化疗或放疗的患者包括青少年提供精子储存的可能 (Kamischke et al.,2004) 人精子的冷冻与贮存是一个高度复杂的过程, 这给实验室工作人员带来了特殊的责任和潜在的麻烦 推荐进行一个全面的风险评估 ( 方框 6-2) 1 与液氮中相比, 在液氮气相中贮存能够减少交叉污染的机会 然而, 在液氮气相贮存罐中, 温度的梯度变化大, 具体取决于容器的形状 容量和材料类型 在某些特别的情况下, 可能达不到 100 以下温度 (Tomlinson,2005) 如果应用气相贮存, 需确保标本温度不高于 130 ( 玻璃样化转变温度 ), 否则可能造成精子损伤 (Clarke,1999)
167 144 第二部分精子制备 6-2 在评估与精液冷冻保存相关的风险时, 应考虑如下事宜 : 贮存罐 标本和贮存室的物理安全性, 减少因盗窃或火灾 贮存容器 ( 麦管 安瓿和贮存罐 ) 问题及液氮供应问题等带来的灭失风险 ; 仪器设备相对于拟定用途的适宜性 ; 液氮的防泄漏和清除系统 个人的防护设备 ; 贮存罐液氮监测报警系统, 空气氧含量监测报警系统 为降低储存时标本间感染原的交叉污染风险 ( 例如 HIV, 或乙肝 丙肝病毒经由冷冻贮存罐的传播 ), 注意 : 贮存容器的类型 : 小瓶或麦管 ; 以及麦管的密封方法 ( 热封或聚合物堵塞 ); 贮存的性质 : 液氮或液氮气相 ; 高风险 ( 已知或疑含病毒 ) 标本的贮存方案和方法 分装标本并贮存在不同位置, 以降低全部灭失的风险 ; 每个步骤都双重核对标本身份 ; 使用牢靠的标签和识别码 ; 对使用材料和留存标本有定期审验的程序 来源 :Tedder 1995;Mortimer,2004;Gilling-Smith et al.,2005;tomlinson, 用于液氮中贮存的麦管须用可热封的离子型树脂制成, 以保证在 196 低温下维持其抗漏 防菌防病毒污染及机械抗性 (Mortimer,2004;Gilling-Smith et al.,2005;tomlinson,2005) 6.2 几种现成的精子冷冻及精子库管理方案可以采用 (Mortimer,2004;Wolf, 1995), 一些冷冻保护剂也有商品化产品 常用的甘油 - 卵黄 - 柠檬酸盐 (GEYC) 冷冻保护剂, 以及程控或气相冷冻程序的详细介绍如下 GEYC 冷冻保护剂的制备 称量 1.5g 葡萄糖和 1.3g 柠檬酸三钠二水, 加消毒的纯净水至 65ml 加入 15ml 甘油完全混匀 加入 1.3g 甘氨酸, 完全溶解后用 0.45μm 微孔滤器过滤 加入 20ml 新鲜卵黄 ( 最好由特定的无病原蛋中获得 ): 清洗鸡蛋, 去壳, 刺破卵膜, 用注射器吸取卵黄 ( 每只鸡蛋可获得约 10ml 卵黄 )
168 第 6 章精子的冷冻保存 所制成的悬浮液置 56 水浴中 40 分钟, 经常搅拌 检测溶液的 ph 值 如果 ph 值在 6.8~7.2 范围之外, 丢弃溶液重新制备, 以防加入了不正确的试剂成分或剂量 细菌培养可在这一环节进行, 以检测溶液是否无菌 精子毒性试验也可在此环节进行 在超净台中将溶液以 2ml 分装, 70 保存 在 3 个月之内使用 也有类似 GEYC 的冷冻保护剂商品售卖 将冷冻保护剂加入精液 解冻冷冻保护剂, 复温到室温并混匀 初始复温至 37 可能是有益的 高浓度的甘油对精子有害 加入冷冻保护剂与精液混合时, 需要特别小心 1 份体积 GEYC 加入到 2 份体积精液中, 逐滴加入同时旋转试管, 或用移液器轻柔上下吹吸, 或分 5 次逐步加入并轻柔混匀, 室温下操作过程大约在 10 分钟以上 加入 GEYC 后, 混合液在 30~35 孵育 5 分钟 麦管装入精液 ml 塑料麦管由于其热传导性能好和易于储存而比较常用, 塑料冷冻小瓶可以储存较大的体积 将精液 -GEYC 的混合液吸入 0.5ml 塑料麦管或装入冷冻小瓶 可在麦管上端连接真空抽吸装置的歧管或者转换器来装填麦管 精液麦管的密封麦管上端两棉栓之间充填了聚乙烯醇干粉, 当其与精液接触时即发生聚合而自动密封 1. 在容器边缘轻轻磕打麦管, 使其下端留出 1cm 空气段 2. 将麦管下端插入无菌聚乙烯醇干粉, 然后浸入水中 1cm 3. 由于感染原有可能透入这种粉末聚合封栓, 热封麦管可能更好些 4. 标本也可以用塑料小管或安瓿储存 装填体积不应超过其容量的 90% 5. 将容器外部揩干并以 70%(v/v) 酒精或其他消毒剂消毒 使用程控冷冻仪冷却和冷冻精液 程控冷冻仪能够控制液氮蒸气注入冷冻室的速率 把麦管或冷冻小瓶放入程控冷冻仪中, 按照厂商的操作指南启动程序 常用的冷却麦管的降温程序是 : 从 20 到 6, 每分钟降温 1.5 ; 然后每分钟降温 6 直到 100 整个过程大约需要 40 分钟 仪器冷冻室温度在 100,30 分钟, 将麦管转移到液氮中 也可以使用其他更复杂的程序, 这主要取决于每个实验室自己的经验 (Pérez- Sánchez et al.,1994)
169 146 第二部分精子制备 精液的人工降温和冷冻与程控冷冻相比, 人工方法较不易控制, 但仍能取得适宜的效果 人工程序有多种方案可供选择 1. 把麦管置于冰箱冷冻室 ( 20 ) 中 30 分钟, 然后放入干冰 ( 79 ) 上 30 分钟, 最后投入液氮 ( 196 ) 中 2. 麦管可以从 20 冷冻室移到 70 冷冻室, 或放入一个提篮或小筒内, 置于小液氮罐颈部液氮蒸气与空气的混合气中, 温度 80 ~ 100, 放置 15 分钟, 然后投入液氮中 也可以在大液氮罐的液面上方 10~20cm 处放置支架, 在上面放置 1 小时以上, 利用液氮上方的温度梯度而逐渐降温 冷冻精液的贮存 把麦管先放入小塑料套管, 然后插入较大塑料储存筒 将冷冻小瓶卡在金属杆的夹子上或置于贮存盒中放入贮存罐, 最好气相贮存, 因为冷冻小瓶盖不能达到完全密封 装有麦管的提桶或卡有冷冻小瓶的金属杆置于液氮真空瓶 ( 杜瓦瓶 ) 或罐中 冷冻精液的运输系统冷冻精液可以采用商售的吸附液氮的低温运输罐干式运输 随着液氮的蒸发, 运输罐可维持合适的低温达数天至数周, 具体取决于运输罐的大小 确保液氮及人类生物标本的运输符合地方 国家和国际法规 冷冻精液的解冻 应用之前, 从液氮罐或液氮蒸气罐中取出所需数量的麦管, 放在棉纸或支架上复温到室温 ( 大约需要 6 分钟 ), 冷冻小瓶的复温时间更长 (10~20 分钟 ) 在 10 分钟之内, 用无菌剪剪去麦管末端, 连接授精装置 ( 治疗用 ), 或排出管内液体检测解冻后的精子活力 ( 检查冷冻程序 ) 如果是快速冷冻程序, 用快速复温的效果可能更好 (Verheyen et al.,1993) 用小量连续稀释方式去除冷冻保护剂, 以避免高渗透压状态 (Gao et al., 1995), 可能改善妊娠结果 仅有很少活动精子的精液 生殖管道中获得的精子悬液都可以贮存, 用于 ICSI 必要时可以 1500g 离心 10 分钟浓缩精液至最小体积约 0.4ml, 按上述步骤加 入 GEYC 进行处理 附睾液 睾丸提取物, 或在实验室以其他方式如上游法或密度梯度离心 ( 见 5.4 和 5.5 节 ) 获得的精子, 在含有 4mg/ml 人血清白蛋白和 Hepes 的精子制备 液中重悬为精子悬液, 加入 Tyrod- 葡萄糖 - 甘油 (TGG) 或商品化的含人血清 白蛋白冷冻保护剂, 加以冷冻保存
170 第 6 章精子的冷冻保存 改良的冷冻保护剂 (TGG) ml 无菌 Tyrode s 液 ( 见附录 4,4.9 节 ), 加 5ml 无菌人血清白蛋白储液 (100mg/ml),0.9g 葡萄糖和 5ml 甘油 0.45μm 微孔滤膜过滤 分装为 2ml 储存在 程序 如果标本体积大于 2.0ml, 而且精子活力很差, 在室温下以 1500g 离心 5 分钟 弃去上清液, 留大约 1.0ml 重新悬浮精子 测定活动精子 (AR + NP) 百分率, 如果活动精子数目非常少, 则评估整张玻片活动精子数目 解冻 2ml TGG 把 1 体积 TGG 逐滴加入 1 体积制备好的精液, 混匀 装入麦管或冷冻小瓶, 如上述步骤冷冻 如果有麦管未装满, 需要给套管加盖以防冷冻时麦管漂浮 必须采用一个强有力的编码系统将麦管或冷冻小瓶分类标记 为保证供精 者匿名, 所有实验室数据记录和计算机数据库管理系统均使用编码 解码供精者 身份的钥匙必须单独保存并保证其安全性 可采用的编码系统有多种, 关键条件 是能赋予每位供精者或精子保存者一个独特的代码 下面的编码系统可以满足所 需条件 : 每个新匿名供精者被分派一个两字母的代码 (AA AB AC BA 直到 ZZ, 之后便需要换一种新的编码方式 ) 三字母的编码系统用于患者和已知的供精者 :AAA AAB 等 每一名特定供精者的每份标本代码标示为其个人代码 - 数字, 例如, 个人代 码为 BT 的供精者第 8 次捐精, 标记为 BT-8 该字母代码和标本编号应该使用不脱色的黑色标记笔标记在每一支麦管或冷 冻小瓶上, 也可使用专用于液氮的印刷标签 存放麦管的套管也应标记相同代码及标本号 对贮存筒 套管 麦管及封粉进行颜色编码, 也有利于标本的快速识别 随着冻存精子的使用, 数据库中麦管或冷冻小瓶的账目要相应地调整记录 凡涉及供精者标本或患者标本的身份确认 样本接收 麦管的制备和标 记 液氮罐中的放置以及麦管的解冻使用和废弃等操作, 都应该有两人的双重 核对并在实验报告中记录 在任何情况下, 一名技术人员每次最好只处理一份 精液标本
171
172
173
174 男科学实验室必须为正确诊断和卫生保健决策提供可靠的结果 由于精液分析高度复杂, 操作难以标准化, 因此必须进行质量控制 ( 质控,QC) 以发现并纠正系统误差和结果的高度变异性 不同实验室间在精子浓度和形态学评价上的巨大差异 (Neuwinger et al.,1990;matson,1995;cooper et al.,1999,2002) 使强化质控和标准化的需求更加迫切 每个实验室无论规模大小, 都应该在标准化方法和操作的基础上执行质量保证 (QA) 项目, 以保证结果的准确性和精确性 (De Jonge,2000;Mortimer & Mortimer,2005) 质量保证在有些国家是法律规定, 而在另一些国家则为认证机构或医保系统所要求 在某些医疗机构, 尚不具备充分执行这里所描述的那些质量控制的条件, 但无论如何, 精子浓度 形态学和活力等基本参数应该始终有内部质量控制的监控, 可能的情况下还应参加外部质量控制 描述质量控制的书籍有不少 ( 如 Wheeler & Chambers,1992;Wheeler,1993), 其中一些论述实验室质量控制的专著更深入地描述了质量控制的方法 ( 如 Cembrowski & Carey,1989;Carey & Lloyd,1995;Westgard,2002) 内部质量控制 (IQC) 是指在一个实验室内进行的质量控制活动, 而外部质量控制 (EQC) 是评价不同实验室对同一样本的检测结果 ( 见 7.11 节 ) 7.2 对 QC 程序进行管理需要了解测量误差的来源和大小 任何测量都有一定程度的误差, 误差的大小采用有上下限的可信区间来描述 精确测量是指其上下限很接近 ; 准确测量是指其结果接近真值 误差有两种 : 随机误差和系统误差 随机误差影响精确度, 来源于结果的判读或取样过程中产生的偶然差异, 通过同一观察者使用同一设备的重复测量可将此类误差检测出来 系统误差 ( 有时叫偏倚 ) 来源于那些只在一个方向影响结果的因素, 所以更难察觉, 也无法通过重复测量检测到 即使精液标本经充分混匀, 精液分析结果的精确性不足在很大程度上还是归咎于精子在精液 固定液或培养液的随机分布 评估精子浓度 活力 存活率和形态学等都是计数有限数量的精子来推测整个精液标本的结果 选择一定体积 ( 用于评估浓度 ) 或一定数量的精子 ( 用于活力分级 形态学评价或存活率分析 ) 所产生的取样变异是一种随机误差, 通常称作统计学误差或抽样误差 方框 7-1 中列举了一些这方面的统计学术语 在标本混匀或取出一定量样本时, 会产生更进一步的误差, 但可以通过提高技术而减少这样的误差 ( 见 7.13 节 ) 常规精液分析中质控的目的是监测并尽可能降低随机误差和系统误差的程度 必须使这些误差最小化, 使结果可信并被临床医生和研究人员使用
175 152 第三部分质量保证 7-1 准确度 认定值 偏倚 二项式分布 Bland-Altman 图 共同原因变异 检验结果与真值的接近程度 对真值的估计, 通常是来自于许多实验室结果的平均值 ( 靶值 公议值 约定真值 ) 一个检测结果偏离认定值的程度 其不准确性具备可重复性且始终在同一方向出现 ( 系统误差 ) 一种理论分布, 用于模式化表达那些只有两种互斥结果的事件 例如活动 / 不活动, 存活 / 非存活 一种描述一系列配对测量值差值相对于其均值的散点图 影响所研究的过程中所有个体值的一种自然变异 95% 可信区间根据观察数据计算得到的区间, 真值就包含在 95% 的重复测量值中 ( 计算公式为均值 ± 1.96 SE 或 N ± 1.96 N ) 公议值 约定真值 质控图 控制限 漂移 外部质量控制 良好实验室规范 (GLP) 在控 内部质量控制 ISO 成品质控样本 失控 见认定值 见认定值 一种时间序列图, 它显示了一系列个体测量值以及中心线和控制限 源于单纯共同原因的最大允许变异 变异超过控制限, 则表明有特殊原因影响检测过程 测量值连续的微小改变, 随时间的推移将导致准确度的改变 由外部机构执行的 对检测程序进行实验室间比较的质量检验过程 有助于发现检测的系统误差和评估检测的准确度 从计划 实验 监督 记录 报告到档案管理等方面为实验室研究提供管理框架的一套规范 测量过程的所有值都在预期控制限内 测量实验室内部程序变异性的质量检验过程 该过程用于评价日常操作的精确度 有助于发现随机变异 ( 评估精确度 ) 国际标准化组织 一个制订国际标准 ( 包括实验室质量标准 ) 的组织 遵照制备指南制备的 并经过分析的商品化样本 测量值超过预期的控制限, 或测量值虽在控制限内但显示了明显的失控趋势, 就表明该测量程序失控 凡失控程序都必须进行评估 PDCA 计划 执行 检查 行动 (Shewhart 循环 ) Possion 分布 精确度 精确度误差 随机误差 S 图 抽样误差 Shewhart 循环 一种用于建立计算模型的理论分布 重复测量结果间的一致程度 通常以不精确度表示 ( 漂移 ; 每种检测方法或每个批次样本内部 之间 每次运行间的变异, 或实验室变异 ) 精确度的测量不受偏倚的影响 ( 见抽样误差 ) 见抽样误差 见抽样误差 测量值的标准差对时间所作的一种质控图 用于监控程序的一致性和测量的精确度 计数有限数量的精子所产生的误差, 与计数的精子数的平方根成反比 抽样误差 (%SE) 是某个计数量的标准误 ( N ), 以百分率表示为 [100 ( N/N )] ( 随机误差, 精密度误差, 统计学抽样误差 ) 见 PDCA
176 第 7 章质量保证和质量控制 特殊原因变异标准操作规程统计学抽样误差系统误差靶值变异 X bar 图 Youden 图 是指较大的 非连续性的或无法预测的 仅影响某些值 ( 随机变异 ) 的变异来源 应遵循的操作步骤和方法的指导性文件 见抽样误差 见偏倚 见认定值 检测过程中个体检测结果之间的差异 变异 ( 误差 ) 的原因可能是常见的或特殊的 测量值的均值对时间所作的质控图 用于监测过程的变异性和检查与靶值的差异 ( 评估准确度 ) 一个样本的测定值对另一个样本的测定值所绘制的图形 7.3 通过评估更多精子可以减小抽样误差 ( 表 2-2 方框 2-5 和 2-7), 但需权衡增加精确度与时间花费及因检测人员疲劳导致准确性下降之间的利弊 使用 95% 可信区间来评估重复测量结果的可接受性, 意味着对约 5% 的样本而言, 差异大于 1.96 个标准误是单纯偶然变异 ( 随机误差 ) 的结果, 重复测量并不必要 这样不必要的额外工作尚可接受, 但也可以通过选择较宽的限度 (2.6 或 3 标准误 ) 来减少这种事件的发生率 ( 可分别降至 1% 和 0.2%) 7.4 欲得到可接受的结果, 最好的方式是制订并实施一个连续性的质量保证项目, 对实验室提供的数据与服务的质量和适宜度定期进行监测和评价 管理 执行 统计分析 预防和修正行动构成了 QA 计划的核心 连续性监测不但可以检查和修正问题, 还有助于预防问题的出现 质量保证项目必须在质量手册 (QM) 中描述, 内容包括标准操作规程 (SOPs) 和一套关于实验室操作程序和方法的详细指南 与这些指南相关的是一系列表格和文件, 如转诊单 实验室工作记录表 结果报告单 给患者和转诊医生的信息册等 质量手册描述的是实验室的组织结构, 其中具体列举了不同职位 ( 职责描述 ) 所需要的技能 ( 培训 ), 另外还叙述了检验人员和监督人员之间的会议时间安排 继续教育计划以及员工的发展和培训计划 7.5 所有实验室技术人员都应严格遵循正式的 SOPs SOPs 也可用于培训, 且 为非常规操作程序或在为那些没有得到可接受结果的操作步骤排错时提供重要 参考
177 154 第三部分质量保证手册的方案内容包括转诊单 患者就诊程序 患者预约安排 检验操作过程 检验结果报告 新实验室工作人员培训 检查和监测设备 质控图的使用及质控图反应出问题 ( 失控 ) 时所应遵循的操作程序 SOPs 应涵盖用于核查设备正常运转的所有操作程序, 包括操作的例行检查 校准日程和记录, 以及对诸如显微镜 离心机 移液器 天平 冰柜 冰箱和急救设备 ( 如洗眼器和淋浴 ) 等科研设备维护保养的文件记录 基本的方法是每个设备都有一个日志簿, 记录所有的调试和校准活动 一旦某个实验操作出现失控结果, 这些记录可用于排查和纠错 7.6 内部质量控制 (IQC) 监控精确度, 并且可在分析过程出现错误时, 以超出控制限的结果给予提示 因为不同的分析过程对不同类型的误差敏感, 应根据所要监控的分析过程选择使用不同的质控程序 凡涉及稀释 加样和重复使用计数池等的检验程序需要进行例行检查, 而对固定涂片或录像带的评估程序因可产生误差的步骤较少, 而不必频繁检查 执行 IQC 的一个实用方法是将 IQC 质控品与实验室常规工作内容共同检测, 并使用质控图监测这些质控品的结果 以这种方式,IQC 成为实验室常规工作的一部分并按照本地或区域性标准来进行 重要的是将质控样本作为常规实验室工作的一部分, 而不要特殊对待, 否则会得到比常规样本更精确和更准确的结果 用于监测检测人员自身和之间的变异, 所使用的 IQC 材料可以外购, 也可实验室自制, 两种方式各有利弊 QC 商品化的 IQC 样本提供了均值和已知变异范围, 优点是可以评估准确度和精确度 实验室中精液分析结果的变异可以与那些有确定来源的质控样本的变异进行比较 如果采用这些质控样本, 实验室应建立起自己的质控图用于评估精确度, 并应当用生产商的推荐范围来评价准确度 (Westgard,2002) 外购 IQC 样本的缺点是成本与可获得性的问题 需要关注的是, 生产商所给靶值的获得方式 ( 多次分析 计算机辅助精子分析 公议值 修正均值等 ) QC 实验室自制 IQC 样本的优点是降低了成本, 可根据实验室的特殊需要而专门制备, 可以制备很多样本 ( 涵盖结果范围更大 ) 并长期储存, 缺点是靶值未知 推荐 ( 有时候是必要的 ) 备有正常值范围 ( 例如, 精子浓度 /ml) 和临界范围值 ( 例如, 精子浓度 < /ml) 的质控样本 QC 储存的精液样本可以用于 IQC 项目中评估精子浓度 活力 形态学和存活率 优点是靶值或已知 ( 外购者 ), 或已提供 (EQC 项目 ), 或经多次评估得出 ( 实验室自制者 ), 因此可以通过重复测量检查出系统误差
178 第 7 章质量保证和质量控制 精子浓度可以稀释并储存不同精子浓度的标本 可以将若干份标本合并以达到某一特定浓度或某一更大体积的稀释标本, 但可能会发生精子凝集 用于精子浓度测量 IQC 的非凝集精子悬液的制备和储存方法, 见附录 7 的 A7.6 节 精子形态学和存活率对于精子形态评价, 可使用空气干燥的精液涂片 固定后的精液涂片 ( 见 节 ) 或经固定和染色的精液涂片 ( 见 2.14 节 ) 等 ; 而对于存活率检测, 可使用伊红 - 苯胺黑染色涂片 ( 见 节 ) 涂片应该从实验室的常规标本中选取, 并掩饰标识码 选择好 中 差三类精液制备 QC 样本 质控片可以重复使用, 一旦质量下降, 应该重新制备 最好使用一大套质控片, 以消除检测人员因对某些涂片熟悉而出现偏倚结果的可能性 关于如何制备形态学分析用 QC 涂片, 见附录 7 的 A7.7 节 如果涂片制备和储存得当, 可以保持稳定数月甚至数年 在质控片更替的过渡时期, 不同批次的质控片可以交替使用或互相重叠使用 精子活力记录在磁带 CD 或 DVD 上的标本视频录像, 无论是来自诊所 EQC 项目配发或特别制作的, 都可用于 QC 录像的放大倍数要与实际的标本分析时显微镜下所见一致 所有日常分析中所用的摄像机和显示屏采用的是与视频录像时相同的放大倍数和对比度, 这样也增加录像资料用于 QC 的有效性 关于如何制作精子活力测量的 QC 视频录像, 见附录 7 的 A7.5 节 QC IQC 的一个简单方法是将同一份精液标本分装后交给一个或多个检测人员分别重复测量, 这种重复测量应该以日常精液分析同样的方法进行 这种质控形式可以应用于精子浓度 活力 形态学和存活率分析 鉴于凝集和聚集评估的主观性 混合抗球蛋白反应的变异性 (Bohring & Krause,1999), 加之需要活精子和阳性对照, 其他分析的质控难度较大 在对新鲜精液标本的精子活力分析进行 IQC 时呈现出特殊的问题, 由于精子活力随时间而下降, 因此需要所有检测人员在第一时间而且基本上同时进行评估 在用普通载玻片和盖玻片制备的样片中, 精子活力只能稳定几分钟, 所以可使用精子活力稳定达 30 分钟的固定深度的腔室玻片 使用桥联显微镜 (bridge microscope) 或有摄像机连接到显示器的显微镜, 可以使几个检测人员同时分析同一样本的同一视野 可以将醋酯膜网格覆盖在监视器上模拟镜下活力分析中目镜上的网格 ( 见附录 7,A7.5 节 ) 使用 CASA 系统的实验室应该遵循生产商的质量控制程序, 经常性的做法包括重播录存的标记为各种泳动速度的活动精子影像
179 156 第三部分质量保证 7.7 质控图的制作和解读是实验室质量保证的必备内容之一 具体采用哪种 QC 系统取决于问题和可得材料的性质 X bar X bar 图主要是设计用来发现那些极端偏离靶值的实验结果或全方位增加的结果变异 连续性地测量相同样本可检测出系统误差 对同一样本重复测量, 用均值对时间作图 因为该程序要求有已知真值或靶值, 而储存样本有厂商 ( 购买的样本 ) 或 EQC 项目提供的靶值, 或实验室经多次分析得到的估测值 ( 自制样本 ), 故而须采用储存样本 X bar 图在发现是否由检测人员造成的高度变异结果上没有 S 图敏感 ( 见 节 ) 为了检查变异性, 可使用与 X bar 图相同的方式在 S 图上监测每一质控样本的数值范围, 并设置相应的警戒限和处置限 计算 X bar 图的控制限同一 IQC 制品做成一系列样本进行连续测量 前 10 个样本分析完成后, 为每个检测人员计算控制限 这样的控制限显示了同一检测人员对同一样本以特定操作程序进行重复测量的检测值范围 以后每检测完 10 个样本后重新计算均值和标准差, 如果 QC 没出现问题, 就用这些新值来更新 X bar 和 S bar 的控制限 在质控样本用完之前, 应该准备新的混合样本 新批次的前 10 个质控样本和剩下的原有样本一起测定分析, 共同建立新的控制限 用于计算控制限的参数见表 7-1, 样例见方框 7-2 和方框 X bar 图和基于平均标准差 (S bar) 的 S 图的控制限的决定因素 检测人员数 n SD 测量值 Cn Xbar 控制限 警戒限 处置限 A2 A3 处置低限 S0.999 Sbar 控制限 警戒低限警戒高限 S0.975 S0.025 处置高限 S
180 第 7 章质量保证和质量控制 Xbar 下表给出的是 4 个检测人员对同一 IQC 制品的 10 个质控样本的精子浓度测量值, 以及每个样本的均值和标准差 样本 精子浓度 (10 6 /ml) 检测人员 A 检测人员 B 检测人员 C 检测人员 D 均值 标准差 个质控样本均值的平均数 (X bar) 是 : ( )/10 = 39.7 标准差的平均数 (S bar) 是 : ( )/10 = 3.40 检测人员数量 n = 4 时, 系数 A 2,n 和 A 3,n 对应的值分别为 和 1.628( 表 7-1) 所以警戒限 ( 距离均值 2 个标准误 ) 为 :X bar ± A 2,n S bar = 39.7 ±( )= 39.7 ± 3.7, 即 /ml 和 /ml 同理, 可以得到处置限 ( 距均值 3 个标准误 ): X bar ± A 3,n Sbar = 39.7 ±( )= 39.7 ± 5.5, 即 /ml 和 /ml 7-3 X bar 检测人员之间的标准差也可通过 S bar 乘以 C n( 当样本量为 4 时为 1.085, 见表 7-1) 得出, 在这里是 3.69, 与直接计算出的合并标准差 3.84 接近 合并标准差 s = (s s s i2 )/10, 其中 s i 是第 i 个质控样本的标准差 可以利用合并标准差直接计算出警戒限和处置限, 分别为距均值两侧 2 个和 3 个标准误 (s/ n) 本例中, 警戒限为 35.8 和 /ml, 处置限分别为 33.9 和 /ml, 与使用 S bar,a2,n 和 A3,n 得到的结果非常接近 绘制 X bar 图每个检测人员都要分析 IQC 样本, 并将结果用于绘制质控图 一旦某个分析程序开始运转且结果变异处于可接受范围内, 就应当常规对 IQC 样本进行分析并将结果与已建立值进行比较, 做法是将每次分析中 IQC 样本的测量均值绘制在质控图上, 观察是否落在本实验室为该方法确定的变异 ( 误差 ) 范围之外 举例见图 7-1 可以为精子活力 形态学和存活率分析构建 X bar 图并设置警戒限和处置限, 所进行的这些分析要求遵循精子浓度分析和百分率间差异评估的步骤 ( 见 7.8 节 ) S 该图用于检查是否由于检测人员造成了高度变异的结果 对样本进行重复测量, 并用标准差对时间作图 由于 QC 样本全部来源于同一个混合的储存样品, 样本之间预期没有差异, 所以检测人员之间的任何显著性差异将提示是某个或多个人员在分析中产生的系统性偏倚
181 158 第三部分质量保证 7-1 精子浓度的 X bar 图在一张带有先前测定靶值 (X bar) 警戒限和处置限的图上绘出连续测量所得的各个均值 ( ) S 图控制限的计算 S 图控制限的设置方式与 X bar 图相同 然而, 由于标准差的分布并非对称,S 图警戒限和处置限以这样的方式来设置 : 在准确度和精确度都不变的情况下, 新的观察值落在控制限外的概率与 X bar 图相同 因此, 将分别有 5% 和 0.2% 的样本因单纯随机误差超出警戒限和处置限 这些控制限是按卡方分布计算得到, 用来同平均标准差 S bar 相乘的因子 sα,n, 见表 7-1 方框 7-4 展示的是一个样例 S 图上如果结果落在控制限下限以下表示非预期的低变异, 可能提示检测人员之间一致性水平的真实提高, 或可能私下串通过 7-4 S 使用方框 7-2 的数据, 平均样本标准差 S bar 为 /ml 采用 n = 4 时的 s α,n 值 ( 表 7-1), 得出 : 处置下限 :S bar s = = /ml, 警戒下限 :S bar s = = /ml, 警戒上限 :S bar s = = /ml, 处置上限 :S bar s = = /ml 制作 S 图将后续测量值的标准差画在质控图上, 以确定它们是否落在本实验室为所用测量方法确定的变异性 ( 误差 ) 之外 举例见图 7-2 可以为精子活力 形态学和存活率分析构建 S 图并设置警戒限和处置限, 所进行的这些分析要求遵循精子浓度分析和百分率间差异评估的步骤 ( 见 7.8 节 )
182 第 7 章质量保证和质量控制 精子浓度 S 图将各个连续测量值的标准差 (S bar) 画在显示有以前测量均值 ( ) 警戒限和处置限的图上 7.8 当精子被分成两个或以上类别时 ( 如正常或异常形态, 前向或非前向活动, 存活或死亡 ), 每一类别的百分率测量值的标准误取决于其实际但未知的百分率及所计数的精子数量 (N) 百分率 p 范围为 20%~80% 时, 其标准误近似值估算为 p(100 p)/n 超出这个范围时, 则应使用更恰当的角度转换 (arc sin square root 反正弦平方根 )z = sin 1 (p/100), 其标准差为 1/(2 N) 弧度, 也就是说只取决于计数的精子数, 而与实际百分率无关 ( 见 Kuster et al.,2004) 所有的个体值都应当接近这些值, 但平均标准差 (S bar) 可能会因为检测人员间的额外变异而超过 2.5% 在此情况下, 应采取措施以降低平均标准差 7.9 X bar S 技术人员和实验室监督者应该一起检查分析质控图 如果质控值超出质控 范围, 则应系统地评估整个检测分析过程, 以确定变异的可能来源 已有监控质控过程的基本指南 应根据这些指南检查质控图, 并在有指征时 采取行动 有各种可提示某实验方法失控的质控规则, 包括如下 : 单独一个点超过 3SD 控制限 这是一个最简单的规则, 且被普遍采纳 它可 能提示检测程序出现某个突然的大变化 3 个连续点中的 2 个点超出处置限 5 个连续点中的 4 个点超出警戒限 连续 2 个结果高于警戒上限或低于警戒下限 连续 2 个结果一个高于警戒上限, 一个低于警戒下限
183 160 第三部分质量保证 8 个连续的点在中心线的一侧 这个规则很受青睐, 因为应用简单, 且对第一个规则可能遗漏的平缓的改变或趋势敏感 在实际应用中, 第一个和最后一个规则被广泛接受 如果质控样本的结果是 被拒绝, 所警示的误差类型 ( 随机性或系统性 ) 应能指示方向去追查可能的原因 ( 方框 7-5) 实验室监督人员应该经常性地检查分析质控结果 7-5 控制规则 提示的误差 一个结果在处置限外 随机误差 3 点中的 2 点超出处置限系统误差 5 点中的 4 点超出警戒限系统误差 连续 2 个结果均高于警戒上限或均低于警戒下限 连续 2 个结果一个高于警戒上限, 一个低于警戒下限 系统误差 随机误差 8 个连续结果, 都在均值以上或以下系统误差 包括 : 必须仔细评估质控程序的提示信号, 任何程序误差都必须鉴定 可能的误差 标本混匀不充分 ( 常见于黏稠和凝集的标本 ); 检测人员紧张 ( 如取样不稳定或记录错误 ); 技术粗糙 ( 如制片时或计数池加样时操作疏忽 )( 见 7.13 节 ); 培训不充分 ( 如在精子计数 正常形态学分类 精子存活率检测时粉红色与白 色精子头或卷尾的评估 检测活动精子等过程中的系统误差 ; 一贯性计算错 误所致偏倚 )( 见 7.13 节 ); 仪器的问题 ( 如 : 磨损或未校准的自动移液器会降低取样和稀释过程的可重 复性 ; 轴心偏移的显微镜会降低视觉清晰度并妨碍存活率和形态学的正确评 分 ; 不准确的天平或量筒 )( 见附录 7,A7.8 节 ); 质控样本变质 ; 仪器设备尤其是加样器和计数池的更换 ; 程序或实验室环境改变 当结果超出控制限, 应记录可能的原因和所采取的修正行动 如果问题不明 显, 重新分析质控样本, 核查第一个结果是否异常 如果质控结果仍超出控制限, 必须找出原因, 并在进行进一步分析之前进行纠正 程序如下 : 制作整个检测过程的详细流程图 SOP 和表 7-2~ 表 7-5 可以帮助完成此工作 通过该流程图, 确定可能出现变异的位置, 推断可能的原因, 并制订降低变异 的计划
184 第 7 章质量保证和质量控制 161 收集更多的数据, 制作新的质控图, 检查分析质控图以确定该变异程度是否可接受 找出问题 生成和检验假设 重新评估程序, 这一系列过程被称为 Shewhart 或 PDCA( 计划 执行 检查 行动 ) 循环 7.10 新鲜精液标本分析的质控程序与用于储存样本的相似, 可以评估检测人员自身和之间的差异 然而因为真值未知, 不能使用 X bar 图, 且不能评估系统误差 ( 检测人员偏倚 ) 评估检测人员之间变异的主要 QC 程序是使用 S 图, 也可在每测量 5 或 10 个 QC 样本之后用双因素方差分析 (ANOVA) 来评估检测人员之间的系统变异 可以使用以下几种方法比较两个或更多检测人员之间的结果 用两个测量值的差对应其均值作图 (Bland & Altman,1986) 比较两个检测人员对同一精液样本精子浓度的检测结果, 应得到一个与图 7-3 类似模式的图形 图 7-3 是精子活力的人工分析结果和计算机辅助分析结果的比较图 7-3 前向运动精子百分率的人工和 CASA 测量值 Bland-Altman 图此图是以两种方法测量值的差 ( 人工 CASA) 对应于其均值 [( 人工 + CASA)/2] 作图 计算均值和差异的 SD( 配对比较 ) 因为两个检测人员分析的是同一样本, 均值间的差异应该是零 因为使用的是配对 t 检验, 任何非零的显著性差异 都揭示两个检测人员之间的偏倚 ( 系统误差 ) 用两个不同样本的结果互相作图 (Youden plots) 每个检测人员分别检测两 份不同标本的精子浓度, 然后将几个检测人员的测量结果进行比较, 应得到 与图 7-4 类似的图 每个检测人员 (IQC) 或每个中心 (EQC) 对两个标本的检
185 162 第三部分质量保证测结果互相对应作图 图中的水平点线和垂直点线分别表示两个标本检测结果的 95% 可信区间, 系由本实验室有经验的检测人员 (IQC) 或参考实验室 (EQC) 的测量结果确定 检测值应落在由这些点线交叉形成的靶窗口区域 如果在图中, 一个样本的值落在其靶范围, 而另一个样本的值不在靶范围, 表明为随机误差 (1 区 ); 而两个样本的值都高 ( 右上方,2 区 ), 或都低 ( 左下方, 2 区 ), 表示系统误差 ; 若一个样本的值过低, 而另一个过高, 最有可能是随机误差所致 (3 区 ) 7-4 精子浓度测量值 Youden 图几个检测人员对两个样本 (A,B) 的分析结果各自相互对应作图 每个检测人员 ( 或实验室, EQC) 的结果可以用不同的符号及颜色表示 图上标记为 2 的区域中结果可能是系统误差造成的, 而 1 区和 3 区的结果可能归咎于随机误差 双因素方差分析 该技术在许多统计学教科书上都有描述 ( 如 Armitage et al.,2002), 也有计算机程序和差异显著性的统计学检验 就上述的配对比较而言, 所有检测人员检测结果的差异应该为零 因此, 计算每个检测人员所测每个样本的离均差, 然后得到每个检测人员离均差的均值和标准差 若有离均差绝对值大于 3 个标准误, 则指示有偏倚 检测人员之间差异的正式的统计学检验是以双因素方差分析表 F 检验为基础, 很多计算机统计程序可以直接计算给出结果 均方根误差 (σ^) 是取自方差分析表的残差 ( 或误差 ) 均方的平方根 均差大于 2.5 个标准误不可能是单纯偶然变异 (< 1.2%) 的结果 至于检测人员之间的差异是否显著, 必须检查分析检测人员检测结果的均值或均差, 以确定哪个值大于预期值 并非所有计算机软件包都可提供检测人员间差异的标准误, 有可能需要单独计算 若检测人员间出现重大差异, 应立即对所有程序展开审核, 以确定措施来改进一致性 方框 7-6 中的样例说明了如何直接计算检测人员间精子浓度测量值差异的标
186 第 7 章质量保证和质量控制 163 准误, 并分析这些标准误是否大于预期的单纯偶然变异的标准误 当直接从观察 值计算时, 要保留足够的小数位数, 以避免舍入误差 7-6 下表显示的是三位检测人员对 5 份 QC 样本精子浓度的检测结果精子浓度 (10 6 /ml) 样本 检测人员 A 检测人员 B 检测人员 C 样本均值 用各观察值减去样本均值得到样本离均差 (d ij) 样本 检测人员 A 检测人员 B 检测人员 C 计算每个检测人员离均差的均值 m j = id ij/n, 标准差 s j = id ij2 /(n 1),n 代表分析的精液样本数 均值 mj 标准差 sj 均值 / 标准误 mj/se mj 检测人员 A 检测人员 B 检测人员 C 检测人员 C 的离均差均值为 /ml, 比另两名检测人员的平均值小 5.7[ 3.8 ( )/2] 10 6 /ml 为评估这种低估是否符合偶然变异, 应根据检测人员差异的标准差计算均方根误差,σ^ = js j2 /(t 1), 此处 t 是检测人员数目 在本例中,σ^ = /ml 每个检测人员离均差的标准误为 se(m j)= σ (1 1/t)/n, 也就是 /ml 检测人员 C 的离均差绝对值 ( /ml) 大于 3 个标准误, 与预期值零 ( 假设检测人员间没有系统差异 ) 有显著性差异 检测人员间差异的正规统计学检验是依据检测人员和 QC 样本双因素方差分析的 F 检验 采用上述精子浓度的方差分析表显示如下 来源平方和自由度均方 F 值 P 值 QC 样本 < 检测人员 误差 总计 均方根误差为 = /ml, 与上面得到的结果相同 不出所料, 因为 QC 样本来源于不同的新鲜精液标本, 因此样本间的差异非常大 (P < 0.001) 检测人员间差异的 F 检验 (F = 4.81, 自由度为 2 和 8,P = 0.042) 在 0.05 水平有统计学意义, 提示这些差异大于单纯随机误差引起的变异
187 164 第三部分质量保证 7-7 IQC 程序 检测的误差 QC 材料 检测人员数量 X bar 图 偏倚 全面性变异 准确度 贮存样本 一个, 多个 S 图 偏倚 / 精确度 贮存 / 新鲜样本 多个 双因素方差分析 偏倚 / 精确度 贮存 / 新鲜样本 多个 Bland-Altman 偏倚 / 精确度 贮存 / 新鲜样本 两个 配对分析 偏倚 / 精确度 贮存 / 新鲜样本 两个 Youden 图 偏倚 / 精确度 贮存 / 新鲜样本 多个 虽然主要的 IQC 程序是立足于评价检测人员自身和之间差异, 但也可以通过监控精液分析结果的时间趋势获得额外信息 可每隔一段时间 ( 如一个月 ) 将该时间段内所有被检患者的每个变量的均值制作成 X bar 图, 并分别以 2 个和 3 个标准误在均值两端设置警戒限和处置限 各时间段内原始观察值的标准差除以精液分析次数的平方根即为标准误, 或直接从均值分布估算标准误 控制限的设置应至少采用 6 个月的观察值, 并定期修改 每个均值应至少来自于 20 个结果, 小型实验室可能要汇总一个多月的结果 方法的完善包括监控参数正常患者的月均值和使用累积和控制图 (CUSUM chart) 来快速检测出任何相对于均值的系统性偏离 (Barnett,1979) 偏离预期值可反映不同的被检者特性 ( 被分析男性的时间依赖性改变 对相同男性进行重复测量的次数改变 不同类型不育症男性转诊模式的改变 ) 或技术因素 ( 检测人员的改变 实验室用品的改变 季节温度的变化等 ) 7.11 外部质量控制 (EQC) 是监测分析结果的完整质控程序的一部分 (Cekan et al., 1995), 而外部质量保证 (EQA) 则监控着与样本收集和结果报告有关的所有实验室程序, 以确保实验室程序在控 EQC 使实验室之间的结果得到比较, 也能以一种在单个实验室无法实现的规模对不同方法进行评价和比较 内部质控和外部质控是互补的过程 如果没有适当掩盖质控品或选择质控品, 外部质控可揭示准确性问题, 而内部质控则不能 EQC 优点是让一个实验室拥有监测其所用方法准确性和稳定性的能力 然而,EQC 样本有明显的外部来源特征, 很容易被特殊对待 应该避免这种情况, 以尽可能使其与常规样本用同样的方式检测 EQC 包括同行比较 (peer comparison) 和能力验证程序 在 EQC 过程中, 假定标本是完全相同的并分发给所有参与的实验室进行分析 (Cembrowski & Carey, 1989) 实验室将他们的结果提交给某中心机构, 在那里对数据的离群值进行检查并计算均值和标准差, 以对参与实验室的工作表现给出评价鉴定 国家级精液分析 EQC 项目名单见附录 8
188 第 7 章质量保证和质量控制 EQC EQC 项目为实验室提供他们自己和其他参与实验室的结果信息 需要明确 的是指定靶值的来源 : 是否来源于准确测量 血细胞计数板多次精子浓度计数 计 算机辅助精子活力分析, 是来源于一组控制良好的参考实验室还是所有参与中心 的修正均值 EQC 结果常用图形表示, 如直方图等 如果几次 EQC 使用的是同 一质控样本, 那么各实验室自身对该样本检测结果的偏倚和变异也应报告 当提供两份样本进行分析时, 用两份样本的检测结果分别作为 x 轴和 y 轴做 成 Youden 图 ( 图 7-4) 通过各个标记值的散点分布, 可以很清晰地看到各中心结 果的偏离程度 其他资料也可以在图中直观显示, 比如用不同的颜色或符号代表 不同的方法 ( 计数板 染色或评估标准 ) 或不同的中心 在发出两个以上样本的情况下, 可以得到有关偏倚 ( 与认定值的差异 ) 的多方 面数值, 包括 : 偏倚指数评分 (BIS): 偏倚除以某一选定的变异系数 100, 该值可正可负 ; 变异指数评分 (VIS): 与偏倚指数评分 (BIS) 相似, 但该值永远是正值 ; 平均连续 BIS 或平均连续 VIS 得分 (MRBIS,MRVIS): 帮助确定趋势 MRBIS 和 MRVIS 均低, 表明结果接近认定值 ;MRBIS 低但 MRVIS 高, 可能 提示随机误差 ;MRBIS 和 MRVIS 均高提示系统误差 以成功 / 失败或分等级的 形式所报告的结果对实验室检查和认证很有意义 监控工作表现的一个简单方法是用各参数的实验室检测结果 (y 轴 ) 对其靶值 (x 轴 ) 作图, 如此可清晰地显示实验室检测值与均等线 (line of identity) 的接近程 度, 也可以用 Bland-Altman 图 ( 图 7-3) 来显示检测值与靶值的偏离程度 EQC 项目得到的基本信息关系到实验室及实验室方法的偏倚或准确度, 理想 的结局是让实验室能保证或提高它们所用方法的准确性 (Plaut & Westgard,2002) EQC 项目中, 结果持续高于或低于认定值或均值的实验室必须重新评估其方法 EQC 结果变异大通常与 IQC 结果变异大有关, 且提示样本间的评估程序存在不 一致性, 需要仔细重新评估技术步骤以确保其与手册推荐相一致 恰当的行动包括对那些在 IQC 中曾经讨论过的程序 ( 见 节 ) 进行再培训 和再测试 表 7-2~ 表 7-5 也提示了精液分析中可能的变异原因与推荐的解决方 法 实验室间研究人员的交换通常是有帮助的, 且在 EQC 结果好的实验室对技 术人员进行培训会有益处 从 EQC 结果好的实验室请来的顾问常常能找出从何 处着手改进方法以提高重复性 7.12 QC QC 样本应该例行分析 分析的频率可依据国家或当地推荐意见来确定, 或 遵照实验室认证法或认证机构的规定 有些管理条例要求 QC 样本每天都要随患 者精子浓度分析一起进行, 而且 IQC 样本要占到 1%~5%
189 166 第三部分质量保证 QC 样本应用于 : 监控新员工和原有员工 ; 每当引入新的实验室设备 用品 程序以及新批次 IQC 样本时 方框 7-8 列出的是 QC 日程安排的总则 在实际操作中,QC 日程要根据实验 室的工作量来安排 方框 7-9 列出的是不同 QC 方案的优先次序 ; 有些程序对资 金缺乏的实验室来说可能是不可行的 7-8 QC 总是 每周 / 月 每月 / 季 每季 /6 个月 样本内部结果的监测和相关性 不同检测人员的重复测量值的分析 分析均值 参加 EQC 6 个月 / 年校准加样器 计数池和其他设备 7-9 QC 参数 材料 靶值 准确度 偏倚 精确度 优先性排序 浓度 新鲜 IQC 样本 未知 S 图, 双因素方差分析 1 储存 IQC 样本 已知 X bar 图 S 图 3 EQC 样本 已知 X bar 图 S 图 2 形态 新鲜 IQC 样本 未知 S 图, 双因素方差分析 1 储存 IQC 样本 已知 X bar 图 S 图 3 EQC 样本 已知 X bar 图 S 图 2 活力 新鲜 IQC 样本 未知 S 图, 双因素方差分析 1 储存 IQC 样本 已知 X bar 图 S 图 3 EQC 样本 已知 X bar 图 S 图 2 存活率 新鲜 IQC 样本 未知 S 图, 双因素方差分析 1 储存 IQC 样本 已知 X bar 图 S 图 3 EQC 样本 已知 X bar 图 S 图 当培训检测人员 引入新方法或修改现有分析方法时, 都可使用与 QC 相似 的途径 检测人员培训应该包括让被培训者了解如下方法 核查混匀和稀释过程 计数池网格和计算过程 加样后 10~15 分钟内分析样本, 超出时限会因蒸发而显著影响到计数池内 精子的位置 两个检测人员合作, 用桥联显微镜或带有摄像机和显示器的显微镜同时观 测, 比较彼此的稀释 加样和计数过程 两人应计数同一个计数池, 比较计数
190 第 7 章质量保证和质量控制 167 排或计数格的结果, 以发现差异的来源 在计数和培训时, 或用有网格的目镜检查精子时, 使用桥联显微镜来确定是 否应将个别认为是落在线上的精子计数在内 复习表 精子浓度分析时变异 ( 误差 ) 的来源和建议的解决方案 程序预防措施控制方案 稀释前没有充分混匀标本培训,SOP 重复稀释 稀释误差 ( 如, 将 1 20 稀释成 , 而事实上应该是 ) 培训,SOP IQC 移液器失准 ( 如调到 100μl 但实际加了 95 或 110μl) 设备维护保养,SOP 重复稀释,IQC,EQC 使用不适当的移液器 ( 如使用了空气置换型而非正向式置换型移液器 ) 培训,SOP 重复稀释,IQC,EQC 用很少量的精液稀释, 没有样本代表性的风险很高培训,SOP 重复稀释,IQC,EQC 在将样本加入到稀释液时移液器吸头外面残留有精液培训,SOP IQC 计数池没有擦净和干燥培训,SOP 重复分析 不正确地组装或安放计数池 ( 如计数池支架上有灰尘颗粒有可能改变计数池的高度 ) 精液混匀与取样稀释之间时间间隔过长 ( 精液中的精子立即开始沉降 ) 涡旋混匀稀释样本与将样本加到计数池之间时间间隔过长 ( 稀释的精子立即开始沉降 ) 培训,SOP 培训,SOP 培训,SOP 重复分析 重复稀释和分析 重新稀释和分析 显微镜没有恰当地清洁或校准 ; 放大倍数不正确培训,SOP, 设备维护 IQC 和 EQC 加样后没有等待足够的时间就进行分析 ( 沉降时间不足 ) 精子沉降过程中血细胞计数池不水平, 或不在湿润环境中 错误识别精子 ( 例如将碎片计为精子, 或漏计难以识别的精子 ) 计数了网格中太少或太多排 ( 即不正确计算 ); 一排没有计数完就停止 培训,SOP 培训,SOP 培训,SOP 培训,SOP 重复分析,IQC,EQC 重复分析,IQC,EQC IQC,EQC IQC,EQC 计数精子过少, 导致抽样误差高培训,SOP IQC,EQC 计数格边线上精子的计数标准不一致 ( 如果上下左右边线上的精子都计数, 则会高估精子浓度 ) 培训,SOP IQC,EQC 多键计数器故障设备维护保养 IQC,EQC 计算或修改稀释度上的数学错误培训,SOP IQC,EQC 使用了毛细充填式计数池 ( 充填时精子分布不均匀 ) 培训,SOP IQC,EQC 遵循手册中的指导原则 : 研究每个精子的显微图像和相应的注释 特别注意临界形态的精子 ; 它们应该被定义为异常
191 168 第三部分质量保证 举办精子分类培训, 培训课采用桥联显微镜或带摄像机和显示器的显微镜 复习表 精子形态学分析时变异 ( 误差 ) 的来源和推荐的解决方案 操作步骤预防措施控制方案 显微镜没有恰当地清洁或校准 ; 放大倍数不正确培训,SOP, 设备维护 IQC,EQC 分析操作前培训不充分培训 IQC,EQC 无明确指导原则的主观判断培训,SOP IQC,EQC 同行对分类系统的微妙影响 ( 分析过程中可能引起变化 ) 培训 IQC( 质控图 ) 制备涂片时精液未充分混匀培训,SOP IQC 涂片质量差 ( 过薄或过厚 ) 培训,SOP IQC 染色技术差 ( 过浅 过深或背景色过重 ) 培训,SOP IQC 评估玻片边缘的精子培训,SOP IQC 试图评估非扁平精子或重叠精子培训,SOP IQC 未评估视野内的全部精子, 而是选择精子进行分析培训,SOP IQC 染色片因时间过久而褪色 ( 如储存的 IQC 样本 ) 培训,SOP IQC( 质控图 ) 计算百分率时没有乘以 100 培训,SOP IQC,EQC 多键计数器故障设备维护保养 IQC,EQC 制备好玻片要立即分析 精子停止漂动后才能读片, 以减少总活力的偏倚 随机选择视野, 而不要刻意选择活动精子数高或低的视野 要做到这一点, 有个办法就是在选定视野前不用目镜观察 不要等活动精子进入视野再开始计数 快速分析 ; 一次只计数网格的一小部分 ( 取决于精子浓度 ) 用较短时间计数网格的一个区域, 避免将计数过程中游进分析区域的精子计 数在内 分两阶段计数前向 非前向和不活动的精子 如果技术上有问题, 则颠倒分 析顺序 复习表 精子活力分析时变异 ( 误差 ) 的来源和建议的解决方案 程序预防措施控制方案 取样前精液标本混匀不正确培训,SOP 重复取样和分析,IQC 玻片制备好到分析等待时间过长 ( 精子很快丧失活动力 ) 培训,SOP 加热平台的温度不正确 ( 如温度太高会杀死精子 ) 培训,SOP, 设备维护 显微镜没有恰当地清洁或校准 ; 放大倍数不正确培训,SOP, 设备维护 IQC,EQC 重复取样和分析,IQC 缺乏目镜网格作为参照维护 IQC( 质控图 ) 分析靠近盖玻片边缘的精子 ( 盖玻片外缘 5mm 内的精子运动迟缓或死亡 ) 培训,SOP IQC 重复分析,IQC
192 第 7 章质量保证和质量控制 169 程序预防措施控制方案 分析速度过慢 ( 分析过程中其他精子游进计数区域 ) 培训,SOP IQC 多键计数器故障设备维护 IQC,EQC 计算百分率时没有乘以 100 培训,SOP IQC,EQC 主观偏倚 ( 持续的高活动率或低活动率 ) 培训,SOP IQC,EQC 能降低活力的准备程序 ( 如温度的变化 过度的混匀 毒素污染 ) 非随机选择分析视野 分析延迟 ( 如等待活动精子游进视野或网格内再计数 ) SOP 培训,SOP IQC IQC,EQC 续表 尤其要注意区分红色 ( 死亡 ) 和粉色 ( 存活 ) 的精子头 ( 精子头微弱粉染色者应 评估为存活 ) 如果染色仅限于颈区某个部分而头部其他区域未着色, 可考 虑为 颈部质膜出现裂隙, 并非细胞死亡和质膜完全破裂的特征 考虑使用伊红 - 苯胺黑染色方法 ( 见 节 ) 复习表 精子存活率分析时变异 ( 误差 ) 的来源和推荐的解决方案 程序预防措施控制方案 显微镜没有恰当地清洁或校准, 放大倍数不正确培训,SOP, 设备维护 IQC,EQC 染色不当 : 有些配方造成低渗透压环境, 可杀死精子培训,SOP 与活力比较 放置过久才染色培训,SOP 与活力比较 如果没有立即封片, 涂片干燥后复水将使所有精子着色培训,SOP 与活力比较 高估死亡精子 ( 如把头轻微粉染的精子认作死亡精子 ) 培训,SOP IQC,EQC 将仅限于颈部粉染的精子计数为死精子培训,SOP IQC,EQC
193
194
195
196 173
197 174 参考文献
198 参考文献 175
199 176 参考文献
200 参考文献 177
201 178 参考文献
202 参考文献 179
203 180 参考文献
204 参考文献 181
205 182 参考文献
206 参考文献 183
207 184 参考文献
208 参考文献 185
209 186 参考文献
210 参考文献 187
211 188 参考文献
212
213
214 191 A1.1 精液标本的检测结果要与参考值进行比较, 以决定对患者的治疗以及制订临 床试验或调查的临界值 本部分列出的参考值是根据几项精液质量和生育力的 前瞻性横断面调查结果得出的, 数据来自于对有生育力男性的直接回顾性筛选 有生育力男性定义为那些使其性伴侣在停用避孕措施后 12 个月内怀孕的男子 (Cooper et al.,2009) 该分析只选用那些完整的精液标本 禁欲 2~7 天后取精, 每人只提供一次 标本 ( 多次提供者只用首次提供的标本 ) 精液体积用 WHO 当时的推荐方法测量, 即称重法或转移至吸量管或刻度容 器 精子总数是根据血细胞计数板对固定过的稀释样本测出的浓度计算得 出 总活力 (PR + NP) 前向运动 (PR) 非前向运动 (NP) 和不活动精子 (IM) 在室温或 37 测量 精子正常形态学的数据仅采自于那些能提供不超过严 格分类法 (Tygerberg) 预期最高水平 ( 约 35% 正常形态 ) 的数值的实验室 精 子存活采用精子头细胞膜伊红拒染法来检测 依统计学惯例从双侧参考区间取第 2.5 个百分位数的参考值数据作为临界值, 低于此值被认为来自不同的群体 然而, 由于精液参数的高值对生育力并无 损害, 因此可认为单侧参考区间对精液参数更合适些 表 A1-1 给出了第 5 个百分位数的下限参考值, 表 A1-2 给出了整体的频数分布 1 表 A1-2 中的参考值分布给出最近成为父亲者的精液特征, 这些人的性 伴侣是在停止使用避孕措施后 12 个月内怀孕的 2 这些父亲是一组经过挑选的人群, 他们的精液参数可能与普通的健康 男性有所不同 3 精液特性在同一位男性或不同男性之间都是高度变化的, 而且也不是 夫妇生育力的唯一决定因素 因此, 此参考范围提供的只是男性生育力状态的 指导值 4 精液参数的数值处于 95% 参考区间内并不保证具有生育力 5 精液特性低于此参考范围下限的男性不一定不能生育 他们的精液特 性是比最近成为父亲者的参考范围要低 但此参考范围是以有生育力男性 的第 5 个百分位数提供的数据计算出的 6 男性的精液特性需结合临床资料加以解释
215 192 附录 7 精液质量可能有地区性差异, 甚至实验室之间差异 各实验室应考虑 根据本手册介绍的方法制订自己的参考范围 8 女性伴侣的生育力状态也影响妊娠等待时间 A1-1 精液特性的参考值下限 ( 第 5 个百分位数,95% 可信区间 ) 参数 参考值下限 精液体积 (ml) 精子总数 (10 6 / 一次射精 ) 精子浓度 (10 6 /ml) 总活力 (PR + NP,%) 前向运动 (PR,%) 存活率 ( 活精子,%) 精子形态学 ( 正常形态,%) 其他共识临界值 1.5(1.4~1.7) 39(33~46) 15(12~16) 40(38~42) 32(31~34) 58(55~63) 4(3.0~4.0) ph 7.2 过氧化物酶阳性白细胞 (10 6 /ml) < 1.0 MAR 试验 ( 与颗粒结合的活动精子,%) < 50 免疫珠试验 ( 与免疫珠结合的活动精子,%) < 50 精浆锌 (µmol/ 一次射精 ) 2.4 精浆果糖 (µmol/ 一次射精 ) 精浆中性葡萄糖苷酶 (mu/ 一次射精 ) A1-2 源自性伴侣在停止使用避孕措施后 12 个月内怀孕的男性精液参数值的分布 参数 单位 N 百分位数 精液体积 (ml) 精子总数 (10 6 / 一次射精 ) 精子浓度 (10 6 /ml) 总活力 (PR + NP,%) 前向运动 (PR,%) 非前向运动 (NP,%) 不活动精子 (IM,%) 存活率 (%) 正常形态率 (%) 来源 :Cooper et al.,2009
216 附录 1 参考值和精液术语 193 A1.2 本手册对那些用文字而非数字来描述精液参考值的偏离的术语予以保留 ( 表 A1-3), 尽管一些人主张弃用这些术语 (Grimes & Lopez,2007) 术语只简单地将精液质量分级, 但并不提示任何生物学原因 (Eliasson et al.,1970) 这些术语用于描述那些数值落在参考范围以外而可能源于不同群体的标本 多数精液术语只涉及单个精液参数 ( 然而, 正常精液这个术语却与 3 个精子参数有关 数目 活力和形态 ) 因此, 可以单独描述每项精液参数参考值的偏离 A1-3 与精液质量相关的术语 无精液症 (aspermia) 无精液 ( 没有精液射出或逆行射精 ) 弱精子症 (asthenozoospermia) 弱畸精子症 (asthenoteratozoospermia) 前向运动 (PR) 精子百分率低于参考值下限 前向运动 (PR) 精子百分率和正常形态精子百分率均低于参考值下限 无精子症 (azoospermia) 精液中无精子 ( 本手册检测方法未检出 ) 隐匿精子症 (cryptozoospermia) 血精症 (haemospermia) 白细胞精液症 ( 脓性精液症 )[leukospermia, (pyospermia)] 坏死精子症 (necrozoospermia) 正常精子 (normozoospermia) 少弱精子症 (oligoasthenozoospermia) 少弱畸精子症 (oligoasthenoteratozoospermia) 少畸精子症 (oligoteratozoospermia) 少精子症 (oligozoospermia) 畸形精子症 (teratozoospermia) 新鲜精液制备的玻片中没有精子, 但在离心沉淀团中可观察到精子 精液中有红细胞 精液中的白细胞数超出临界值 精液中活精子百分率低, 不活动精子百分率高 精子总数 ( 或浓度, 取决于报告结果 ) *, 前向运动 (PR) 精子百分率和正常形态精子百分率均等于或高于参考值下限 精子总数 ( 或浓度, 取决于报告结果 ) * 和前向运动 (PR) 精子百分率低于参考值下限 精子总数 ( 或浓度, 取决于报告结果 ) * 前向运动 (PR) 精子百分率和正常形态精子百分率均低于参考值下限 精子总数 ( 或浓度, 取决于报告结果 ) * 和正常形态精子百分率低于参考值下限 精子总数 ( 或浓度, 取决于报告结果 ) * 低于参考值下限 正常形态精子百分率低于参考值下限 * 应该总是优先考虑精子总数, 因为精子总数优于精子浓度 后缀 spermia 用于精液而 zoospermia 用于精子, 所以在英文写作中 应避免使用如下术语 :asthenospermia asthenoteratospermia cryptospermia oligoasthenospermia oligoteratospermia oligospermia teratospermia
217 194 附录
218 195 A2.1 以下所列是男性实验室开展本手册中介绍的基本试验所需要的用品和设备 如果需要寻找下列用品和设备来源的协助, 可以咨询本手册引用的或别处找 到的已发表科研文献 A2.1.1 天平 ; 表面不渗透的实验台 ; 容器 : 用于装丢弃的锋利物品 用于装有害废物 实验室生物安全手册 (WHO,2004); 低温冰箱 ; 消毒剂或次氯酸钠, 用纯净水稀释成 0.1%(v/v) 和 1%(v/v); 消毒皂或抗菌皮肤清洁剂 ; 一次性手套 ; 眼部清洗液 ; 急救药箱 ; 通风橱, 用于存放和操作有毒试剂 化学药品或染料 ; 冰箱 ; 淋浴室 A2.1.2 毛细管和密封剂 ( 用于黏液穿透试验 ); CASA 仪 ( 可选 ); 离心机 : 台式离心机, 能达到 300~500g( 用于常规的精液和尿液处理 ),1000g( 用 于精液标记物测定 ) 和 2000g( 用于处理黏稠的标本 ); 能达到 3000g 的高速离心机 ( 用于处理疑似无精子标本 ) 或 g 的微 量离心机 ( 用于得到无精子的精浆 )( 方框 A2-1); 冷冻保存设备 ( 可选 ); 避孕套 : 无杀精子剂, 无毒性 ( 可选 ); 稀释管 ( 瓶 ); 解剖显微镜 ( 可选 ; 用于采集仓鼠卵母细胞 ); 滤纸,90g/m ( 2 用于过滤染色液 );
219 196 附录 荧光显微镜和物镜 ( 可选 ; 用于高灵敏度的精子浓度测量和精子顶体反应 试验 ); 血细胞计数板 : 改良 Neubauer 计数板或替代品, 池深 100µm, 厚盖玻片 ( 厚度 4 号, 为 0.44mm); 培养箱 (37 ), 最好带 5%(v/v)CO 2( 可选 ); 实验用薄膜 : 自封式可塑型 ; 实验室多键计数器 (6~9 个键 ); 大容量计数板 ( 可选 ; 用于评价低精子浓度样本 ); 光度计 ( 可选 ; 用于 ROS 试验 ); 显微镜载玻片 ; 笔 / 铅笔 : 带磨砂面或粗糙书写面和盖玻片 ( 厚度 1.5 号, 为 0.16~0.19mm); 普通载玻片, 用于在另一块载玻片上把一滴精液推展做成涂片 ; 在载玻片磨砂处写字用 ;HB 型软性铅笔 ( 美国等级为 2) 适用 ; 蜡笔 / 油笔 ( 免疫组化笔 - 可选 ; 用于在载玻片上圈定抗体溶液的区域 ); 永久性记号笔 ; ph(isfet) 电极 ( 可选 ; 用于黏稠精液标本 ); ph 试纸 ( 范围 :6~10); 光源至少为 50 瓦特的相差显微镜 ( 用于评估精子浓度 活力 形态学 ) 以及下 列配件 ( 见附录 3): 10, 20( 或 25), 40( 或 63) 正相位物镜, 100 油物镜 ; 40 负相位物镜 ( 可选 ; 用于伊红存活试验 ); 10( 或 12.5) 宽视野目镜 ; 目镜刻度尺 ( 用于精子活力扫描视野区域的判定 ); 镜台测微尺 ( 用于精子形态学测量 ); 显微检测对位片 (England Finder)( 有网格的载玻片 - 可选 ; 用于 QC 评定 ); 保温载物台 ( 可选 ; 用于测量精子运动速度 ); 移液器和吸头 : 用于混匀精液的带胶乳头的巴斯德滴管或一次性塑料移液管或自动吸 量管 ; 空气置换式移液器 ; 量度为 10~100µl 的正向置换式移液器 ; 精液和宫颈黏液分析结果的登记表 ( 见附录 6); 标本混匀器 : 用于混匀精液的水平振荡器或旋转轮 ( 可选 ); 用于稀释精液的涡旋混合器 ; 用于 96 孔板的封口胶带 ( 可选 ; 用于果糖测定 ); 精液收集容器 : 有盖的一次性广口容器 ; 耐高压消毒的玻璃采集管 ;
220 玻片盒, 一次性使用 ( 可选 ; 用于 QC 精子活力样品制备 ); 分光光度计 ( 可选 ; 用于精液生化分析 ); 瓷或硼硅胶玻璃材料的点滴试板 ( 用于伊红 - 苯胺黑试验 ); 定时器 ( 可选 ; 用于 QC 样本制备 ); 不掉屑的纸巾 ; 台式保温板 ( 可选 ; 用于活动力分析时预热载玻片 ) A2-1 附录 2 设备与安全 197 离心过程中作用于精子的力 ( 相对离心力,RCF) 取决于旋转速度 (N, 每分钟的转数, r.p.m.) 和从转子中心到被力测量点 ( 通常是离心管底部 ) 之间的距离 ( 半径,R,cm) 根据以下公式计算 RCF: R N 2 例如, 转子半径为 8.6cm, 离心速率为 5000r.p.m., 将产生 2404g 力 ; 转子半径为 13.5cm, 离心速率为 3900r.p.m., 将产生 2296g 力 图 A2-1 是根据转子半径和离心速度计算 RCF 的列线图 A2.1.3 抗体 ( 检查白细胞 CD45); 防泡沫剂 ( 可选 ; 用于 QC 样本制备 ); 细胞过氧化物酶检测试剂盒 ( 可选 ); 冷冻保护剂 ( 可选 ); 密度梯度液 ( 用于精子制备 ); 果糖分析试剂盒 ( 可选 ); 戊二醛 ( 可选 ; 用于 HOP 试验 ); 矿物油 ( 可选 ; 用于 HOP 试验 ); 中性 α- 葡糖苷酶检测试剂盒 ( 可选 ); 巴氏染色剂 ; 凡士林 ( 可选 ; 用于 HOP 试验 ); 快速染色试剂盒 ( 可选 ; 用于精子形态学分析 ); 蜡 ( 熔点为 48~66 )( 可选 ; 用于 HOP 试验 ); 锌检测试剂盒 ( 可选 ) A2.2 人体液, 如精液, 是潜在的传染源, 应该特别小心操作和丢弃 对于男科学实验室而言, 最重要的感染性微生物是精液中的 HIV 病毒和乙型肝炎及丙型肝炎病毒 (HBV 和 HCV) 实验室人员应将所有生物标本都视为具有潜在传染性, 在操作时采用恰当的谨慎措施 A2.3 凡接触人样本的实验室人员都应当接种乙型肝炎疫苗
221 198 附录 A2-1 根据转子半径和转速测定相对离心力 (RCF) 的列线图用一条直线连接转子半径 (cm, 左轴 ) 和旋转速度 (r.p.m., 右轴 ) 贯穿 RCF 所在的中轴, 交点为相应的 RCF 如图例, 半径 8cm, 转速 2500r.p.m. 得到的 RCF 大约是 550g( 计算值是 559g, 见方框 A2-1) 不允许任何人在男科学实验室进食, 吸烟, 化妆或存放食物 不允许用嘴吹吸移液管 应当用机械移液装置进行液体的操作 实验室所有人员在实验室内应当穿着实验室工作外套或者一次性工作服, 并 在离开时脱下 实验室人员应当佩戴一次性手套 ( 橡胶 乳胶或乙烯树脂材 质, 有或无干粉 ), 尤其是在操作新鲜的或冷冻精液或精浆或其他生物样本 和任何接触过这些样本的容器时 当工作人员离开实验室或使用电话 电脑 时, 必须摘下并丢弃手套 手套不能重复使用
222 附录 2 设备与安全 199 实验室人员应当经常洗手, 尤其是离开实验室之前 处理样本之后以及脱下 实验服和手套之后 实验室人员应采取预防措施防止由那些可能被精液污染的尖锐器械造成的意 外伤害, 并且避免精液接触到裸露的皮肤 破口 擦伤或病变部位 应当采取措施防止并在必要时清除精液 血液或尿液样品的溢漏 所有用过的尖锐物品 ( 针头 刀片等 ) 应放进一个有标记的容器里 该容器不 等完全装满就加以密封, 并以处理实验室其他危险品同样的方式处理掉 所有潜在的危险品 ( 手套 精液容器 ) 应收集到一起以适当方式处理 所有实验室人员在进行可能产生气雾或飞沫的操作时应戴面罩或医用口罩, 例如, 在对敞口容器涡旋混匀或离心时 不要强行排出移液管内最后残留的 精液样本, 因为这样可能造成飞沫或气雾 在必要的时候, 实验室成员应当穿戴安全防护眼镜 绝缘手套和防护鞋, 例如 在使用液氮时 ( 见 A2.5 节 ) A2.4 已经接触过精液或其他生物样本的工作台和非一次性容器应当灭菌或消毒 必须实施以下操作 : 完成分析后, 日常工作 : 用消毒剂清洗工作台面, 如 0.1%(1g/L) 次氯酸钠或类似的消毒剂, 处理至少 1 小时 ( 或过夜 ), 然后用清水冲洗 把计数板和盖玻片浸泡在 0.1%(1g/L) 次氯酸钠或类似消毒剂中过夜处理 用清水冲洗掉消毒液即可 样本溢洒后 : 如果装样本的容器外面被污染了, 要用消毒剂清洗, 如用 0.1%(1g/L) 次氯酸 钠或类似的消毒剂, 然后用水冲洗 溢洒发生后立即用消毒剂清洗工作台, 如用 1.0%(10g/L) 次氯酸钠或类似消 毒剂, 至少处理 4 小时再用水冲掉消毒剂 必要时, 可用以下方法对精液收集管内的 HIV 病毒进行热灭活 : 在 170 (340 ) 干热消毒至少 2 小时 加热前用铝箔纸包裹容器, 待冷却后 再取出 在 121 (250 ),101kPa(15psi 或 1 个标准大气压 ) 以上, 蒸汽消毒至少 20 分钟 持续煮沸 20~30 分钟 A2.5 液氮是危险品 操作时总要小心, 只能用核准的液氮罐装, 不要企图把罐口 密封 用持物钳夹取浸在液氮中的物品 用面罩或防护眼镜保护眼睛 用宽松干燥的皮革手套或隔热手套保护双手
223 200 附录 穿高帮鞋保护脚部 当液氮溢洒时会完全铺开, 因此会冷却大片区域 通常在室温下柔软的物体 遇液氮会变得又硬又脆 极低的温度会造成严重损伤 液氮溅到皮肤上会造成灼伤样损伤 液氮蒸气 也极冷, 脆弱的组织 ( 如眼睛的组织 ) 即使短暂暴露于液氮蒸气也会受损伤, 但这种情况对脸部或手部的皮肤没有影响 避开沸腾和飞溅的液氮和蒸气 往热的容器里加液氮或将物品置入液氮时总 会发生沸腾和飞溅 因此这些操作要缓慢, 尽量减小沸腾和飞溅 避免触摸未绝缘的导管 身体任何未加保护的部位绝不能接触盛装液氮的导 管或容器 极冷的金属会快速粘住皮肤, 若试图分开, 会撕裂皮肉 在通风良好的区域工作 少量液氮就能产生大量的气体 ( 室温下气态是液态 体积的 9 倍 ) 如果在密闭房间内液氮气体蒸发, 会使空气中的氧气百分含量 减低, 有窒息的危险 存放液氮的房间应安装氧探测器, 当氧含量低于 17% (v/v) 时氧探测器会发出警报 只能使用专门用于液氮冷冻的试管或麦管 操作时要时刻小心, 因为当它们 复温时也可能发生爆炸
224 201 对于特殊的显微镜来说, 最好的信息来源就是制造商提供的使用手册, 手册 应带有一份各个零件的图解 如果没有这样的手册, 可以从因特网上搜寻显微镜 的安装与使用信息 推荐使用相差显微镜进行本手册中介绍的精液检测 这种显微镜至少带一个 50 瓦的光源, 最好是双筒 ( 有两个目镜 ), 带相差聚光镜, 10 20( 或 25) 和 40 ( 或 63) 的相差物镜 ( 用于常规分析 活力 存活, 和精子及非精子细胞计数 ) 和一 个 100 的亮视野油浸物镜 ( 用来评价形态学和存活 ) 检测精子存活可能需要一 个负相位透镜和某种 CASA 设备, 荧光显微镜还需要荧光透镜 不同物镜的质量和价格相差很大 ( 方框 A3-1) 价格越高的物镜所呈现的图 像越清晰, 但是质量稍差的物镜也可应用 目镜刻度尺 ( 十字线 格子线 目镜测微尺 ) 是带已知量程 ( 通常 5mm 或 10mm) 分刻值或不同形式格线的玻璃圆片 一些目镜上固定安装了刻度尺, 另一些 目镜则需要拆卸而插入活动刻度尺 目镜刻度尺的直径规格各有不同, 应准 确地与目镜的孔径匹配 目镜刻度尺可以用镜台测微尺加以校准, 用于测量 精子大小, 也可以在精子活力评估中用于限定视野区域 图 2-4(a) 和图 A7-4 (a) 显示的是一个 5mm 5mm 的网格, 这一尺码适合于在 20 和 40 放大倍 数下进行精子活力分析 有些技术员更愿意用 10mm 10mm 网格来测量精 子浓度和评估精子形态学 镜台测微尺是一张表面刻有刻度的改良载玻片, 通常把 1mm 细分成 10µm 的等份, 可以用来校正目镜测微尺或标线网格, 也可用于测量距离 ( 如活力分 析 )( 图 A7-5) 下面描述的步骤能确保得到可能最好的显微镜图像 如果光路经过正确地 准直和调校, 图像会是清晰透亮的, 不会造成眼睛疲劳 在使用新显微镜或在图 像质量不是很好时按照以下步骤操作 A3.1 取 10µl 精液 ( 或不同体积, 见方框 2-4) 加到显微镜载玻片上, 用 22mm 22mm 的盖玻片 ( 厚度为 1.5 号,0.17mm; 或者其他尺寸, 见方框 2-4) 盖上, 然后把 载玻片放到载物台上 调校显微镜时, 也可用镜台测微尺代替精液载玻片 打开光源调整强度到对比度最大, 但眼睛观察起来舒适 选择 10 的正相位物镜 旋转聚光器轮, 对应到所选物镜的放大倍数 如果是三筒显微镜 ( 即有第三个目镜能连接照相机用于照相或视频记 录 ), 会有一个光偏转旋钮, 通常在目镜的右侧 这个旋钮大多设置三个挡位 : 一个挡位让所有光线到达目镜 ; 另一个挡位让所有光线到达照相机 ; 第三个挡 位让一半光线偏向目镜, 一半光线偏向照相机
225 202 附录 A3-1 每个显微镜镜头上都有规格信息, 例如 : UplanFl PlanApo Plan Neofluor Plan S Fluor 20 /0.80imm corr 40 /0.75 Ph2 100 /1.35 oil iris 100 /1.25 oil Ph3 20 / /0.17 /0.17 / /0.17 WD 1.0 各种标识的解释如下 Plan 平面透镜, 形成一个平面视野, 所观察的物体都位于焦距上 Apo 复消色差透镜, 高度纠正色 ( 像 ) 差 F Fl FL Neofluor Fluo Fluotar UV S-Fluor 透射紫外光的透镜, 用于荧光显微镜 透镜的放大倍数 透镜的数值孔径 (NA) 是透镜对光聚集能力的指示 NA 与光的波长 ( 用 λ 表示 ) 共同决定分辨率 ( 两个分开的目标之间的最小可辨距离 ) NA = η sinα, 其中 η 是浸入介质的折射率,α 是光锥边缘和垂直线的夹角 由于 sinα 最大值是 1.00,NA 的理论最大值等于 η, 但实际中最大值是 1.4 选用最大 NA 来获得最高分辨率 Ph Ph1 Ph2 Ph3 NP N 提示带有相差圈 ( 环 ) 的透镜 Ph 表示带正相位环,NP 或 N 表示带负相位环 Ph1 Ph2 和 Ph3 每种透镜所用的聚光器上的相位孔不同 正相差光能观察细胞内结构 ( 用于湿片制备和活力评估 ), 而负相差光能在暗背景下产生白色图像 ( 用于湿片制备评估存活或 CASA) Imm immersion oil W 提示透镜在使用时需要在物体和透镜之间有液体 常常是油 水 (W) 或甘油 ( 如果没标注, 透镜就是 干用, 使用时不能加液体 ) Iris 提示该透镜带有一个齿环控制的可变光圈 Corr 提示透镜有带细齿的校正环, 供使用不同折射率的浸入介质 160 目镜和物镜之间的距离或管长 通常是 160mm, 但在现代的透镜可以是无穷大 ( ) 0.17 物镜要求的盖玻片厚度 大多数情况用 1.5 号 ( 厚 0.16~0.19mm) 盖玻片 血细胞计数板需要 4 号 ( 厚 0.44mm) 盖玻片 表示盖玻片的厚度不重要或是浸入液可直接加到载玻片上 WD 工作距离 ; 当样本在清晰聚焦时从物镜前透镜到最近盖玻片表面的距离 WD 通常随着放大率和 NA 的增加而减小, 透镜按工作距离分为标准 (NWD, 最高 5mm) 长 (LWD, 5.25~9.75mm) 加长 (ELWD,10~14mm) 和超长 (SLWD,15~30mm) 一些显微镜用改良的 Neubauer 计数板时可能需要长距离 (LWD) 透镜 当光通过一种介质时的相位阻滞程度 真空的折射率 (RI,η) 是 , 空气近似于 1.0(1.0008), 水是 1.33, 甘油是 1.47, 大部分浸镜油是 封片剂干燥后的折射率 (1.488~1.55) 接近于玻璃 (1.50~1.58) A3.2 通过推拉调整两个目镜之间的距离到适合自己眼睛的位置 A3.3 旋转粗调节螺旋使载物台尽量接近物镜 ( 20 或 40) 为避免压碎物镜镜片和载玻片, 调节时要从前面或侧面观察物镜和载物台, 不能从目镜里看 用
226 附录 3 显微镜的使用 203 粗调节螺旋调节载物台的高度直至载玻片几乎接触到物镜 特别注意下一步粗调节螺旋的旋转方向 两眼通过目镜边观察边缓慢旋转粗调节螺旋, 使载物台慢慢离开物镜, 直到接近样本焦点处 再用细调节螺旋调整达到最清晰的图像 如果焦距很难调, 尝试用载玻片磨砂端调焦, 以接近正确的焦距面 A3.4 有些显微镜, 两个目镜各自独立调焦 还有些显微镜, 一个目镜是固定焦距, 另一个可调 可调节的目镜通常会标有 +/0/ 在开始调节之前先把目镜调到 0 如果一个目镜是固定的, 只从固定的目镜中观察 ( 闭上或盖住你的另一只眼 ) 用细调节螺旋调节样本图像的焦距 对静止的目标 ( 如死精子 尘粒或载物 台测微尺网格 ) 调焦要容易些 用另一只眼睛通过可调节的目镜进行聚焦时, 闭上或盖住固定目镜上的另一 只眼睛 把目镜根基部带细齿的圈向 + 或 旋转直到焦距适合你的眼睛 A3.5 关闭视野光圈 ( 在显微镜基底部光源的上方 ) 用聚光器左边或右边的小旋钮升高或降低聚光器直到光圈的边界尽可能的 清晰, 光形成的圆环小而清楚 当聚光器在最顶部位置时一般能达到这一要 求 随着聚光器的聚焦, 光影像的边缘可能会从蓝变红 ( 色差 ), 聚光器的边 缘将有轻微的模糊 光线可能在也可能不在中心位置 如果视野光孔没有可调光圈, 可把一个尖锐的东西 ( 如铅笔尖 ) 放在光源 上进行调焦 A3.6 用聚光器的居中钮把视野光圈居于中心 通常在聚光器下面有两个钮 ( 通常 带细齿边 ), 斜对于正面和侧面 一旦光影位于中间, 打开视野光圈让光线刚好充满视野 不要把视野光圈开 到超过这个位点 关小聚光器孔径直至眩光消失 在右侧居中钮的正后面, 可能有一个小螺丝是锁定聚光器用的, 拧松后 可将整个聚光器卸下来 当聚光器居中后须小心不要再动它
227 204 附录 A3.7 这个操作要用对中望远镜, 可从显微镜制造厂得到 先看一下聚光器上相应物镜所需的相位环位置 摘下一个目镜用对中望远镜替代 眼睛看着对中望远镜, 同时一手握住其基 底部不动, 另一手旋转其顶部, 在镜下聚焦对中望远镜的环, 直到两个环处于 清晰的聚焦状态 : 一个暗环 ( 相位环 ), 一个亮环 ( 光环 ) 旋转相差聚光器上的相位调节钮, 使两环同轴 相位调节钮通常位于聚光器 的背面 用显微镜目镜替换下中心定位镜 A3.8 精子用 Hoechst 染料染色后 ( 见 节 ), 要在荧光显微镜下进行精子核计数, 顶体反应也要在荧光显微镜下检测 FITC 标记的植物凝集素 ( 见 节 ) Hoechst 染料和 FITC 激发光谱的最大值分别是 346nm 和 494nm, 相应的发射光谱最大值是 460nm 和 520nm 需要荧光透镜( 方框 A3-1) 每款荧光显微镜可选购必要的分色镜和吸收滤色镜组件, 用于特定标记染料的测定
228 205 所有溶液都要用纯净水配制 ( 蒸馏水 双蒸水或去离子水 ) A4.1 Biggers Whitten Whittingham BWW 储备液 (Biggers et al.,1971) 将 5.54g 氯化钠 (NaCl),0.356g 氯化钾 (KCl),0.294g 硫酸镁 (MgSO 4 7H 2O), 0.250g 二水氯化钙 (CaCl 2 2H 2O) 和 0.162g 磷酸二氢钾 (KH 2PO 4) 加入到 1000ml 纯净水中 用 1mol/L 的 NaOH 调节 ph 至 7.4 每升加 1.0ml(0.04%,0.4g/L) 酚红 此溶液在 4 可储存数周 BWW 工作液, 使用当天配制 : 在 100ml 的储备液中添加 210mg 碳酸氢钠 (NaHCO 3),100mg D- 葡萄糖,0.37ml 乳酸钠液 (60%(v/v)),3mg 丙酮酸钠,350mg 牛血清白蛋白 V,10 000U 青霉素和 10mg 硫酸链霉素 使用前在含 5%(v/v)CO 2,95%(v/v) 空气的环境中加温至 37 1 在空气中孵育时 : 加入 20mmol/L 的 Hepes( 钠盐 :5.21g/L), 并把 NaHCO 3 减到 0.366g/L 2 密度梯度液配制 ( 见 节 ): 用 10 倍规定重量的化合物 ( 酚红除外 ), 配制 10 的浓缩储备液 配制密度梯度之后, 每 100ml 的补充物与上面的相同 A4.2 Dulbecco s Dulbecco s 葡萄糖 -PBS: 将 0.2g 氯化钾 (KCl),0.2g 磷酸二氢钾 (KH 2PO 4),0.1g 氯化镁 (MgCl 2 6H 2O),8.0g 氯化钠 (NaCl),2.16g 磷酸氢二钠 (Na 2HPO 4 7H 2O) 和 1.00g D- 葡萄糖加入到 750ml 纯净水中 将 0.132g 氯化钙 (CaCl 2 2H 2O) 溶于 10ml 纯净水中, 边搅拌边缓慢加入上述溶液中 用 1mol/L NaOH 调节 ph 至 7.4 用纯净水定容至 1000ml 1 为了防止出现沉淀,CaCl 2 应单独加入, 缓慢加入并不断搅拌
229 206 附录 2 如果需要, 使用前每 100ml 溶液加入 0.3g 的牛血清白蛋白 (BSA)( 用基 本上不含脂肪酸的 ) A4.3 Earle s 将 6.8g 氯化钠 (NaCl),2.2g 碳酸氢钠 (NaHCO 3),0.14g 磷酸二氢钠 (NaH 2PO 4 H 2O), 0.4g 氯化钾 (KCl),0.20g 硫酸镁 (MgSO 4 7H 2O) 和 1.0g D- 葡萄糖加入到 750ml 纯净水中 在上述溶液中溶解 0.20g 无水氯化钙 (CaCl 2), 边搅拌边加入 用 1mol/L 盐酸 (HCl) 或 1mol/L 氢氧化钠 (NaOH) 调节 ph 至 7.4 用纯净水定容至 1000ml 1 用于空气中孵育 : 加入 20mmol/L 的 Hepes( 钠盐 :5.21g/L), 并将 NaHCO 3 减至 0.366g/L 2 密度梯度液配制 ( 见 节 ): 用规定重量 10 倍的化合物 ( 碳酸氢 钠除外 ), 配制 10 的浓缩储备液 配制密度梯度之后, 每 100ml 补充 0.22g NaHCO 3 A4.4 Ham s F 将 7.4g 氯化钠 (NaCl),1.2g 碳酸氢钠 (NaHCO 3),0.285g 氯化钾 (KCl),0.154g 磷酸氢二钠 (Na 2HPO 4),0.153g 硫酸镁 (MgSO 4 7H 2O),0.083g 磷酸二氢钾 (KH 2PO 4),0.044g 氯化钙 (CaCl 2 2H 2O) 和 1.1g D- 葡萄糖加入到 750ml 纯净水中 用 1mol/L 氢氧化钠 (NaOH) 调节 ph 至 7.4 用纯净水定容至 1000ml 1 用于空气中孵育 : 加入 20mmol/L 的 Hepes( 钠盐 :5.21g/L),NaHCO 3 减 到 0.366g/L 2 密度梯度液配制 ( 见 节 ): 配制 10 的浓缩储备液, 化合物的重量 为 10 倍规定重量 ( 碳酸氢钠除外 ) 配制密度梯度液之后, 每 100ml 补充 0.12g NaHCO 3 A4.5 Hanks 1. 将 8.0g 氯化钠 (NaCl),0.4g 氯化钾 (KCl),0.35g 碳酸氢钠 (NaHCO 3),0.185g 氯 化钙 (CaCl 2 2H 2O),0.1g 氯化镁 (MgCl 2 6H 2O),0.1g 硫酸镁 (MgSO 4 7H 2O),
230 附录 4 储备溶液 g 磷酸二氢钾 (KH 2PO 4),0.048g 磷酸二氢钠 (NaH 2PO 4) 和 1.0g D- 葡萄糖加入到 750ml 纯净水中 用 1mol/L 氢氧化钠 (NaOH) 调节 ph 至 7.4 用纯净水定容至 1000ml A 原始配方 (Quinn et al.,1985): 将 5.931g 氯化钠 (NaCl),0.35g 氯化钾 (KCl),0.05g 硫酸镁 (MgSO 4 7H 2O), 0.05g 磷酸二氢钾 (KH 2PO 4),2.1g 碳酸氢钠 (NaHCO 3),0.5g D- 葡萄糖,0.036g 丙酮酸钠,0.3g 氯化钙 (CaCl 2 2H 2O) 和 4.0g DL- 乳酸钠 (60%(v/v)) 加入到 750ml 纯净水中 1ml 上述培养液中加入 10µg 酚红,100U 青霉素和 50µg 硫酸链霉素 用 1mol/L 盐酸 (HCl) 调节 ph 至 7.4 用纯净水定容至 1000ml 1 用于空气中孵育 : 加入 20mmol/L 的 Hepes( 钠盐 :5.21g/L),NaHCO 3 减 少至 0.366g/L 2 密度梯度液配制 ( 见 节 ): 用规定重量 10 倍的化合物配制 10 的 浓缩储备液 ( 碳酸氢钠 丙酮酸钠和乳酸钠除外 ) 配制浓度梯度液之后, 每 100ml 补充 0.21g NaHCO g 丙酮酸钠和 0.4g 乳酸钠 A4.7 Krebs-Ringer 无酚红 Krebs-Ringer 培养基 (KRM): 将 6.9g 氯化钠 (NaCl),2.1g 碳酸氢钠 (NaHCO 3),0.35g 氯化钾 (KCl),0.32g 氯化钙 (CaCl 2 2H 2O),0.18g 磷酸二氢钠 (NaH 2PO 4 2H 2O),0.1g 氯化镁 (MgCl 2 6H 2O) 和 0.9g D- 葡萄糖加入到 750ml 纯净水中 用 1mol/L 氢氧化钠 (NaOH) 调节 ph 至 7.4 用纯净水定容至 1000ml A4.8 Tris 将 6.055g Tris 碱和 8.52g 氯化钠 (NaCl) 加入到 750ml 纯净水中 用 1mol/L 盐酸 (HCl) 调节 ph 至 8.2 用纯净水定容至 1000ml 可用规定重量 10 倍的化合物配制 10 的浓储备液 使用时, 用纯净水做 10 倍稀释, 然后用 1mol/L HCl 调节 ph
231 208 附录 A4.9 Tyrode s 将 0.2g 无水氯化钙 (CaCl 2),0.2g 氯化钾 (KCl),0.05g 磷酸氢二钠 (Na 2HPO 4), 0.2g 氯化镁 (MgCl 2 6H 2O),8.0g 氯化钠 (NaCl),1.0g 碳酸氢钠 (NaHCO 3) 和 1.0g D- 葡萄糖加入到 750ml 纯净水中 用 1mol/L 盐酸 (HCl) 或 1mol/L 氢氧化钠 (NaOH) 调节 ph 至 7.4 用纯净水定容至 1000ml 如果需要, 使用前每 100ml 加入 0.3g BSA( 用基本上无脂肪酸的 ) A4.10 Papanicolaou 可从市场上买到满意的染色液, 也可实验室自制 在配制不同浓度的乙醇之前要检查纯净水的酸度 ph 应为 7.0 EA-36 EA-50 组成成分 伊红 Y( 颜色指数 45380) 苯胺棕 Y( 颜色指数 21000) 亮绿 SF, 浅黄色 ( 颜色指数 42095) 纯净水 95%(v/v) 乙醇磷钨酸水饱和碳酸锂 (> 1.3g/100ml) 10g 10g 10g 300ml 2000ml 4g 0.5ml 储备溶液 按照下列方法分别配制每种染料的 10%(100g/L) 溶液 : 100ml 纯净水中溶解 10g 伊红 Y 100ml 纯净水中溶解 10g 苯胺棕 Y 100ml 纯净水中溶解 10g 亮绿 SF 配制 配制 2L 染色液 : 将 50ml 伊红储备液与 10ml 苯胺棕 Y 储备液混合, 再加入 12.5ml 亮绿 SF 储备液 用 95%(v/v) 乙醇定容至 2000ml 加入 4g 磷钨酸 加入 0.5ml 水饱和碳酸锂溶液 充分混匀, 置深棕色瓶拧紧瓶盖室温下保存
232 附录 4 储备溶液 此溶液在 2~3 个月内稳定 2 使用前用 0.45µm 滤器过滤 G6 组成成分 橙黄 G 结晶 ( 颜色指数 16230) 10g 纯净水 100ml 95%(v/v) 乙醇 1000ml 磷钨酸 0.15g 储存液 1 号 [ 橙黄 G6,10%(100g/L) 溶液 ] ml 纯净水中溶解 10g 橙黄 G 结晶 充分摇匀 于深棕色或用铝箔纸包裹的带塞试剂瓶中室温保存 使用前 1 周 配制 储存液 2 号 ( 橙黄 G6,0.5% 溶液 ) 将 950ml 95%(v/v) 的乙醇加入至 50ml 储存液 1 号 加 0.15g 磷钨酸 充分混匀 室温下储存于深棕色或铝箔纸包裹的带塞试剂瓶中 1 使用之前过滤 2 溶液在 2~3 个月内稳定 Harris s 组成成分 苏木精 ( 深色结晶 ; 颜色指数 75390) 95%(v/v) 乙醇硫酸铝铵 [AlNH 4(SO 4) 2 12H 2O] 氧化汞 (HgO) 配制 在 1600ml 纯净水中加入 160g 硫酸铝铵, 加热溶解 在 80ml 95%(v/v) 乙醇中溶解 8g 苏木精 把苏木精溶液加入硫酸铝铵溶液中 混合溶液加热至 95
233 210 附录 5. 从加热器上拿开后边搅拌边缓慢加入 6g 氧化汞 溶液颜色应为深紫色 立即将容器插入冷的水浴中 溶液变冷后过滤 储存在深棕色或用铝箔纸包裹的试剂瓶中于室温保存 放置 48 小时后再使用 使用前根据所需用量用等量的纯净水稀释 再次过滤 Scott s 当用普通自来水对细胞核的返蓝不充分时, 再用 Scott s 溶液 ; 使用时应 经常换液, 如漂洗 20~25 张载玻片之后 组成成分 g 碳酸氢钠 (NaHCO 3) 20.0g 硫酸镁 (MgSO 4 7H 2O) 几粒麝香草酚结晶 ( 作为防腐剂 ) 1000ml 纯净水 组成成分 ml 95.5%(v/v) 的乙醇 2.0ml 浓盐酸 (HCl) 100ml 纯净水
234 211 A5.1 宫颈黏液中的精子悬浮于液体介质中 精子与女性生殖道分泌物的相互作 用对它们的生存和功能发挥至关重要 目前尚无可行的方法来评估人子宫及输卵 管液对精子的影响 但是, 宫颈黏液便于取样和研究 人的宫颈上皮是由不同类型的分泌细胞组成的, 并且分泌颗粒的性质和丰度 在宫颈的不同部位呈现出差异 这些细胞的分泌物形成宫颈黏液 卵巢激素调节 宫颈黏液的分泌 :17β- 雌二醇刺激产生大量的水性黏液, 而孕酮抑制上皮细胞的 分泌活性 宫颈黏液的分泌量呈现周期性变化 月经周期正常的育龄妇女, 在月 经中期每天分泌的黏液量可达 500µl, 而其他时期则少于 100µl 宫颈黏液的构成 中还有少量子宫内膜液和输卵管液, 可能还有少量卵泡液 此外, 宫颈黏液中有 来自子宫和宫颈上皮的白细胞和细胞碎片 特征 : 宫颈黏液是一种非均质分泌物, 水含量超过 90% 它表现出一系列的流变学 黏性 ( 黏稠度 ) 受宫颈黏液的分子排列以及蛋白质和离子浓度的影响 黏液 的黏稠度从月经来潮前的高度黏稠状态 ( 通常细胞含量较多 ) 到月经中期排 卵前的水样状态不断变化 到排卵完成时, 黏液的黏稠度又再次开始增加 成丝性 描述宫颈黏液的微丝性 拉丝性 或弹性特征的术语 羊齿化 是指当宫颈黏液在玻片上干燥后, 所观察到的结晶程度和形态 ( 图 A5-1) 宫颈黏液是一种水凝胶物质, 由高黏性成分和含有电解质 有机物及可溶性 蛋白质的低黏性成分组成 构成高黏性成分的是黏蛋白的大分子网, 它影响着黏 A5-1 玻片上干燥的宫颈黏液羊齿状结晶形成示例 (a) 羊齿状结晶 :1. 主干 ;2. 二级干 ;3. 三级干 ;4. 四级干 (3 分 ) (b) 主要是主干和二级干 (2 分 ), 但也有一些三级干 (c) 不典型羊齿状结晶 (1 分 ) (d) 没有结晶 (0 分 ) 圆形结构为气泡 评分说明见 A5.3.3 节
235 212 附录液的流变学性质 宫颈黏蛋白是一个纤维状系统, 由肽核和低聚糖侧链构成的一些亚单位组成 宫颈黏液组成成分的周期性变化可能会影响精子的穿透和存活能力 从正常 28 天月经周期的大约第 9 天开始, 精子可以穿透人宫颈黏液, 此后其穿透能力逐渐增强, 且恰于排卵前达到高峰 随后, 在宫颈黏液的性质发生显著变化之前, 精子的穿透能力就开始减弱 精子的穿透能力在时机和程度上常有个体差异 活动的精子可能在体内由宫颈黏液纤丝导向宫颈隐窝, 并可能在此处停留, 然后以缓慢的速度释放, 进入子宫和输卵管 将评估精子 - 宫颈黏液相互作用作为不育症全面检查的一部分是重要的 精子 - 宫颈黏液相互作用异常可能是采用人工授精或其他辅助生殖技术的指征 A5.2 A5.2.1 用阴道窥器暴露宫颈, 以棉拭子轻轻擦拭宫颈外口以除去积存的阴道污染物 然后用棉拭子或镊子清除宫颈外的黏液 用黏液冲洗器 结核菌素注射器 ( 不带针头 ) 吸管或聚乙烯管从宫颈管内采集宫颈黏液 施加抽吸压力的方式应当标准化 当器械的吸头进入宫颈管内大约 1cm 的时候开始抽吸, 撤出时保持抽吸状态, 恰在抽吸器完全撤出宫颈外口之前解除抽吸压力 最好在由宫颈管中撤出器械之前夹紧导管, 使采集的黏液免受气泡堆积的影响或阴道分泌物的污染 如有可能应立即对所采集的黏液质量进行评估, 否则在进行实验室检查之前应妥善保存 ( 见 A5.2.2 节 ) 如果想在月经中期以外的时段采集宫颈黏液, 可在采集前每日给予炔雌醇 20~80µg 共 7~10 天, 这样可以增加黏液的产生 这样处理会产生含水量较高而黏稠性较低的黏液分泌 (Eggert-Kruse et al.,1989) 虽然这种方法有益于评估精子 - 宫颈黏液的体外相互作用, 但未必能反映出未给予激素时夫妇的体内情况 A5.2.2 宫颈黏液可以保存在原始采样管或小试管中, 用塞子或实验室自封膜密封以防风干 注意尽可能减少贮藏容器中空气所占的空间 应当将标本贮存于 4 冰箱中, 最多 5 天 如条件许可, 黏液标本应在采集后 2 天之内使用 ; 并且每次都应该记录从采集到检测的时间间隔 经过冻融的黏液标本不应用于流变学和精子穿透试验 A5.3 对宫颈黏液性质的评估包括测定黏液的成丝性 羊齿状结晶形成 黏性和 ph 值 附录 6 有一个样表用于对这些宫颈黏液性质进行评分和记录, 依据的是在 Insler 等 (1972) 原有方案的基础上由 Moghissi(1976) 设计的系统 评分是根据所
236 附录 5 宫颈黏液 213 采集的宫颈黏液量 ( 见 A5.3.1 节 ) 及描述其特征与外观的 4 个变量 ( 见 A5.3.2~ A5.3.5 节 ) 而确定的 黏液的 ph 值不包括在总的宫颈黏液评分中, 但应作为精 子 - 宫颈黏液相互作用的一个重要参数进行测定 (Eggert-Kruse 等,1993) 最高分 为 15 分, 高于 10 分通常表示宫颈黏液较好, 有利于精子穿透 ; 低于 10 分则表明 该宫颈黏液不利于精子穿透 A5.3.1 黏液体积因其黏性而难于准确测量 可以通过已知直径的导管内的黏液长 度来进行估算 ( 方框 A5-1) A5-1 管截面积 (A,mm 2 ) 乘以所含黏液的长度 (L,mm) 可以得到黏液标本的体积 (V, µl = mm 3 ):V = A L 截面积 A = πr 2,π 大约为 3.142,r 为管的半径 那么在一个直径 2mm 管 (A = = 3.142mm 2 ) 中的一段长为 10cm(100mm) 的黏液体积为 A L = = 314mm 3 = 314µl 或 0.31ml 体积评分标准如下 : 0 分 = 0ml 1 分 = 0.01~0.10ml 或大约 0.1ml 2 分 = 0.11~0.29ml 或大约 0.2ml 3 分 = > 0.3ml 或大约 0.3ml 或更多 A5.3.2 宫颈黏液的黏稠度是影响精子穿透的最重要因素 月经中期的宫颈黏液对精子迁移几乎没有阻挡, 而黏稠的黏液 如黄体期所见 形成了一个精子难于穿越的屏障 黏稠度评分标准如下 : 0 分 = 稠厚, 黏稠度高, 月经来潮前黏液 1 分 = 中度黏稠的黏液 2 分 = 轻度黏稠的黏液 3 分 = 水样, 黏稠度最小, 月经中期 ( 排卵前 ) 黏液 A5.3.3 通过检查显微镜载玻片上空气干燥的宫颈黏液, 对羊齿化 ( 图 A5-1) 程度进行评分 空气干燥的宫颈黏液涂片上可观察到各种各样羊齿样外观的结晶形成 依据宫颈黏液成分的不同, 羊齿 可能只有一个主干, 也可能由主干经过一次 两次或三次分支, 分别生出二级 三级和四级干 应当观察样本中的若干个视野, 以样本中典型的最高程度的羊齿化进行评分 羊齿化的类型变化较大, 例如可因制片的稠厚程度和细胞的多寡而不同 制片可能呈现出不同程度的羊齿化, 有时在一个制片中可以观察到各种程度的羊齿样变
237 214 附录 羊齿化评分标准如下 : 0 分 = 无结晶 A 分 = 非典型羊齿状结晶形成 2 分 = 具有主干和二级干的羊齿状结晶 3 分 = 具有三级和四级干的羊齿状结晶 将一滴宫颈黏液滴在显微镜载玻片上, 并用盖玻片或另一张载玻片以十字交 叉方式接触宫颈黏液 ; 然后轻轻提起盖玻片或第二张载玻片 测量两张片子表面 间宫颈黏液拉丝的长度 成丝性评分标准如下 : 0 = < 1cm 1 = 1~4cm 2 = 5~8cm 3 = 9cm 或更长 A5.3.5 建议以每 µl 中的细胞数来表示 传统上是按照每高倍视野 (HPF) 中的细胞 数来估算宫颈黏液中的白细胞和其他细胞数 ( 方框 A5-2) A µm 每视野的黏液体积取决于显微镜视野面积 (πr 2,π 大约为 3.142,r 为视野的半径 ) 和黏液充填空间的深度 ( 这里为 100µm) 显微镜视野的直径可以用镜台测微尺来测定, 或者用目镜孔的孔径除以物镜放大倍数来估算 在物镜为 40 倍 目镜为 10 倍且孔径为 20mm 的条件下, 显微镜视野的直径大约为 500µm (20mm/40) 在这种情况下,r = 250µm,r 2 = µm 2,πr 2 = µm 2, 体积为 µm 3 或大约 20nl 因此, 每高倍视野 10 个细胞大约相当于每 20nl 中有 10 个细胞或 1µl 中有 500 个细胞 由于计数的细胞数目少, 因此取样误差较高 ; 重复计数结果为 10 个细胞的取样误差为 22%( 表 2-2), 因此细胞数应当介于 280~720 个细胞 /µl 之间 细胞的评分等级是 : 0 分 = 细胞数 > 20 个 /HPF, 或 > 1000 个 /µl 1 分 = 细胞数为 11~20 个 /HPF, 或 501~1000 个 /µl 2 分 = 细胞数为 1~10 个 /HPF, 或 1~500 个 /µl 3 分 = 未见细胞 A5.3.6 ph 宫颈管内的宫颈黏液的 ph 值应在原位或采集后立即使用范围 6.0~10.0 的 ph 试纸进行测试 如果是原位测试, 应注意避免碰触宫颈外的黏液, 因为宫颈外黏液 ( 酸性更强 ) 的 ph 值常低于宫颈管内的黏液 还应注意避免受到阴道分泌物
238 附录 5 宫颈黏液 215 的污染, 因为其 ph 值较低 精子对于宫颈黏液 ph 值的变化甚为敏感 酸性黏液可使精子制动, 而碱性黏液可使精子活力增强 但是宫颈黏液的碱性过强 (ph 值超过 8.5) 则对于精子存活不利 精子在宫颈黏液中迁移和存活的最适 ph 为 7.0~8.5, 这也是月经中期宫颈黏液 ph 值的正常范围 尽管宫颈黏液的 ph 为 6.0~7.0 时精子仍能穿透, 但 ph 值低于 6.5 时, 精子的活力常常受到损害, 如果黏液的 ph 值低于 7.0, 精子 - 宫颈黏液相互作用实验通常不做 在一些情况下, 宫颈黏液实际上呈现更高的酸性, 这可能是由于异常分泌或细菌感染, 或受到阴道分泌物的污染所致
239 216 A6.1 以下所提供的标本记录表格是作为一个模板, 可用于记录按本手册阐述方法进行精液分析的观察结果 可以对表格加以改编, 以包括更多的衍生变量, 成为原始资料的结果大集合 ( 例如一次射精的精液中过氧化物酶阳性细胞总数等 ) 当标本记录表格中的资料用于研究目的时, 可直接输入计算机数据库, 并且任何衍生变量都可以通过计算机计算出来 标本记录表格有多列栏目, 用于记录不同时间进行精液分析的结果, 方便显示系列精液标本分析的结果 表格内的某些部分可以增加额外的空白, 以便记录附加的注释和额外的观察结果 必要时在方括号中标注参考范围和公认临界值 ( 附录 1 表 1-1 和注释 )
240 附录 6 精液和宫颈黏液分析记录表格 217 姓名 : 编号 : 日期 ( 日 / 月 / 年 ) 标本采集 (1. 在实验室 ;2. 在家 ) 采集时间 (h:min) 运送标本时间 (h:min) 开始分析时间 (h:min) 患者禁欲时间 ( 天 ) 使用药物采集标本过程中遇到的困难精液处理 ( 例如菠萝蛋白酶 ) 完整精液?(1. 完整 ;2. 不完整 ) 外观 (1. 正常 ;2. 异常 ) 黏稠度 (1. 正常 ;2. 异常 ) 液化 (1. 正常 ;2. 异常 )(min) 凝集 (1-4,A-E) ph[ 7.2] 量 (ml)[ 1.5] 精子总数 (10 6 / 每次射精 )[ 39] 浓度 (10 6 /ml)[ 15] 如果计数精子少于 400 个时的误差 (%) 存活率 (% 活精子 )[ 58] 总活力 PR + NP(%)[ 40] 前向运动 PR(%)[ 32] 非前向运动 NP(%) 不活动 IM(%) 正常形态 (%)[ 4] 头部异常 (%) 中段异常 (%) 主段异常 (%) 过量残留胞浆 (%) 直接 MAR 试验 IgG(%)(3 或 10min)[< 50] 直接 MAR 试验 IgA(%)(3 或 10min)[< 50] 直接 IB 试验 IgG( 附珠精子 %)[< 50] 直接 IB 试验 IgA( 附珠精子 %)[< 50] 非精子细胞过氧化物酶阳性细胞, 浓度 (10 6 /ml)[< 1.0] 附性腺功能锌 (µmol/ 每次射精 )[ 2.4] 果糖 (µmol/ 每次射精 )[ 13] α- 葡糖苷酶 ( 中性 )(mu/ 每次射精 )[ 20] 检测人员 :
241 218 附录 A6.2 姓名 : 编号 末次月经 ( 日 / 月 / 年 ): 日期 ( 日 / 月 / 年 ) 月经周期第几天量 (0,1,2,3) 黏稠度 (0,1,2,3) 羊齿化 (0,1,2,3) 成丝性 (0,1,2,3) 细胞性 (0,1,2,3) 总分 ( 最高 15 分 ) ph 每日宫颈评分 日期 ( 日 / 月 / 年 ) 性交后时间 (h) 精子浓度 ( 精子数 / ml) 精子活力 PR(%) NP(%) IM(%) 检测人员 : 性交后试验 阴道池宫颈内池阴道池宫颈内池阴道池宫颈内池
242 219 A7.1 A7.1.1 精子浓度的测量是采用计数板计数稀释精液定量体积中的精子数目 但是, 如果离开精确度指标的话, 单次估量值的意义有限 精确度可以通过可信区间来表示, 可信区间是包含真值的特定概率 ( 置信系数或可能覆盖率 ) 最常用的概率为 0.95 因此该区间被称作 95% 可信区间, 这个区间的上下界值即为 95% 可信限 (Armitage et al.,2002) 假定精子在整个计数池中是随机分布的, 那么在一定体积中的精子数目符合 Poisson 分布, 其方差就等于所计数的精子数目 一次计数 (N) 的标准误 (SE) 为其平方根 ( N), 抽样误差 (%SE) 为 100 ( N/N),95% 可信区间 (CI) 近似为 N ± 1.96 SE( 或 N ± 近似 2 SE) 这些值仅是近似值, 因为可信限并非总是对称的 基于 Poisson 分布特征, 计数 400 个精子时精确的 95% 可信区间为 ~441.21, 计数 100 个精子时为 81.36~121.66, 计数 10 个精子时为 4.80~18.39, 计数 1 个精子时为 0.025~5.572, 计数 0 个精子时为 0.0~3.7 A7.1.2 建议将每份精液标本独立稀释两次并进行重复计数, 因为尽管对标本进行了彻底混匀, 但仍可能存在精子分布不均的情况 ( 见 节 ) 对同一计数池计数两次, 或计数同一计数池的两侧, 但每侧均来自同一稀释样本, 这些都不是真正的重复计数, 因为这样检测不到因标本制备 混匀或稀释造成的误差 两次独立计数之间的差异预期为 0, 且标准误为两次计数总和的平方根 因此, 仅由于随机误差,z =(N1 N2)/ (N1 + N2) 应当 < 1.96; 如果是这样, 这些数值可以接受 如果 z > 1.96, 应该制备新的重复稀释样本 图 A7-1 列出了可接受的 N1 N2 的整数近似值 例如, 平均计数 200 个精子 ( 总计 400 个 ), 重复计数之间的差异可高达 39, 因此, 这两个计数值由于随机误差可能为 180.5( ) 和 219.5( ) 表 A7-1 总结了图 A7-1 中的数据, 可用于评估重复计数之间的一致性 ( 见 和 2.11 节 ) 常规计数精子时, 建议每次重复计数至少 200 个精子, 故计数总共约 400 个精子 ; 那么抽样误差会小于 5%( 表 2-2) 如果精子数太少, 则不可避免高的取样误差 ( 见 和 节 ), 在这种情况下, 应该报告所计数精子数目的取样误差 (%SE)( 表 2-2)
243 220 附录 A7-1 根据评估的精子总数得出的两次重复计数之间的可接受差异曲线表示随机误差所致重复计数的最大差异 A7-1 对应于特定总数的两次重复计数之间的可接受差异 总数 * 差异 总数 * 差异 总数 * 差异 35~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ * 基于 95% 可信区间的整数近似值 A7.2 手册特别强调计数足够数量的精子, 并使重复评估结果的偏差保持在一定范围内 这是非常必要的, 因为这样可以使得到的浓度或总数更接近于真值 ( 但未知 ) 如果计数的精子数太少, 得出的浓度将会不准确 如果计数的精子数不能达到 400 个, 则应在报告表中说明, 并注明误差 ( 表 2-2) 提高精子计数准确性的最好方法是在深且网格区域大的计数池中进行精子计数, 这样的计数池可容纳大量的精子, 不要使用仅能够容纳少量精子的浅且网
244 附录 7 抽样误差和质量控制 221 格区域小的计数池 为了便于计数, 应该在固定液中充分稀释精液, 从而避免不 活动精子重叠 下面举例说明在精子浓度低的情况下, 为了准确测量精液样本, 使用不同计数池的差异 在带有 1 个 1mm 1mm 网格的小容积计数池中充满未稀释的精液 : 如果实际精子浓度为 /ml, 精子数应该是 1000 个 /µl 或 1 个 /nl 在一个深度为 10µm 带一个 1mm 1mm 网格的计数池中, 整个 10nl 的网格 中会有 10 个精子 仅计数 10 个精子的误差是 32%, 其 95% 可信区间为 10 ± 1.96 N(= 10 ± 6.2) ( 表 2-2) 这么大的可信区间意味着在总共 10nl 体积中, 实际计数值可能为 4(10-6)~ 16(10 + 6) 个精子 因此, 精子浓度的估值应该为每毫升精液中 ~ 个精子 实际上, 这意味着最好评估 50µl 的体积, 里面含有 ~ 个精子 如果已经检测了两次重复制备的样本, 若观察 20 个精子的误差为 22%, 可 信区间为 2.0±8.8, 则 20nl 总体积中相应的实际精子数应为 11(20 9) 或 29 (20 + 9), 真值的估计范围为每毫升精液 ~ 个精子, 每 50µl 体积中有 ~ 个精子 在带有 9 个 1mm 1mm 网格的大容积计数池中充满 1 + 1(1 2) 稀释的精液 : 如果实际精子浓度为 /ml, 并进行了 1 + 1(1 2) 稀释 ( 见 2.8 节 ), 那么精 子数为 个 /ml,500 个 /µl 或 0.5 个 /nl 在一个深度为 100µm, 有数个 1mm 1mm 网格 ( 每个网格 100nl) 的计数池中, 4 个网格 (400nl) 中会有 200 个精子, 两次重复计数 (800nl)400 个精子 计数 400 个精子的误差是 5%,95% 可信区间为 400 ± 1.96 N(= 400 ± 39) ( 表 2-2) 这个可信区间意味着在总体积为 800nl 的 1 + 1(1 2) 稀释精液中, 实际计数 值可能为 360(400 40)~440( ) 个精子 因此, 精子浓度的估值为每毫升未稀释精液中含有 ~ 个精子 实际上, 这意味着评估的 50µl 体积中含有 ~ 个精子 A7.3 A7.3.1 当把精子分成两种类别时 ( 例如, 形态学正常或不正常, 活动或非活动, 活的或死的, 发生或不发生顶体反应, 与去透明带的仓鼠卵融合或不融合 ), 其百分率服从于二项式分布 在这种情况下, 每种类别所估测百分率 (p) 的标准误取决于真正的 但未知的百分率以及所计数的精子数目 (N) 标准误为 p(100 p)/n, 并可由正态分布得出一个近似的可信区间, 在 20%~80% 的范围内获得好的近似值 如果计数 100 个精子, 且正常形态精子百分率为 20%, 那么估测正常形态精子百分率的标准误是 20(100 20)/100 = (20 80)/100 = 1600/100 = 4.0%,95%
245 222 附录 可信限是 ±1.96 4% 或 ±7.8%, 相应的可信区间为 12.2%~27.8% 如果计数 200 个精子, 标准误是 20(100 20)/ 200 = (20 80)/ 200 = 1600/200 = 2.8% 95% 可信限是 ± % 或 ±5.5%, 相应的可信区间为 14.5%~25.5% 如果计数 400 个精子, 标准误是 20(100 20)/ 400 = (20 80)/ 400 = 1600/400 = 2.0% 95% 可信限是 ±1.96 2% 或 ±3.9%, 相应的可信区间为 16.1%~23.9% 如果超出 20%~80% 的范围, 使用角度转换 ( 反正弦平方根 )z = sin 1 p/100 则 更为合适 它的特点是 z 的标准差为 1/(2 N), 因此仅取决于计数的精子数目, 而 不是真正 ( 但未知 ) 的百分率 还可以选择的方法是应用一种广泛适用的统计软 件包计算二项式分布的精确可信限 A7.3.2 建议根据每个样本中的精子数 N 重复测量百分率 (p 1 和 p 2) 并进行比较 预 期差异 d[ 这里的 d =( p 1 p 2 ) 的极限是 1.96( 2p(100 p)/n ], 这里的 p = (p 1 + p 2)/2 两次独立测量值之间的差异预期为 0, 标准误取决于测得的百分率和 所计数的精子总数 图 A7-2 显示重复计数 和 400 个精子 ( 即计数总精子数为 和 800 个 ) 所得两个百分率之间一致性的精确的 95% 可信区间, 很显然如果每次 重复计数少于 200 个精子, 则由计数所造成的统计学误差就会较大 从图中还可 以看出平均百分率为 50% 误差最大, 且左右大致对称分布, 百分率为 0% 和 100% 时, 误差最小 A7-2 对应于真实百分率和所测精子总数的两次重复测量所得百分率之间的可接受差异曲线表示对 100( 总数 200: 最上面的实线 ) 200( 总数 400: 中间的点线 ) 和 400 个 ( 总数 800: 最下面的虚线 ) 精子重复测量所得百分率之间因随机误差所致的预期差异 (95% 可信限 )
246 附录 7 抽样误差和质量控制 223 从这张曲线图中可以读取重复测量值之间的可接受差异 在计数 200 个精子 ( 两次分别计数 100 个 ) 在实际百分率为 5%( 或 95%) 的情况下, 所得结果的 95% 可信限的差异上限为 6.6% 平均下来, 重复评测同一样本 20 次, 其百分率有 19 次应介于 2.42%~9.00% 之间, 只有 1 次会由于随机误差而超出界限 在计数 800 个精子 ( 两次分别计数 400 个 ; 最下面的虚线 ) 实际百分率为 5%( 或 95%) 的情况下, 所得结果差异的 95% 可信限的上限为 3.1%,95% 可信区间为 3.1%~ 7.6% 同理, 如果计数精子的总数为 400 个 ( 两次分别计数 200 个 ; 中间的点线 ), 在实际平均百分率为 20%( 或 80%) 的情况下, 两次计数百分率差异的 95% 可信限上限为 8.1%, 两次计数的百分率介于 16.2% 和 24.3% 之间 表 A7-2 A7-3 和 A7-4 列出的数据为对应于计数不同精子总数所得的一系列百分率, 重复测量值之间的可接受差异 ( 仅由偶然因素所致 ) 对于评估精子正常 A7-2 对应于重复计数 100 个 ( 总共 200 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 均值 % 差异 * 均值 % 差异 * ~ ~ ~ ~ ~90 9 5~6 7 91~93 8 7~9 8 94~ ~ ~ ~ ~ ~ ~66 14 * 基于 95% 可信区间的整数近似值 A7-3 对应于重复计数 200 个 ( 总共 400 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 均值 % 差异 * 均值 % 差异 * ~ ~ ~88 7 3~4 4 89~92 6 5~7 5 93~95 5 8~ ~ ~ ~ ~ ~65 10 * 基于 95% 可信区间的整数近似值
247 224 附录 形态学 活力 存活率或顶体反应等百分率的重复测量值之间的一致性, 这些表格 比曲线图 ( 图 A7-2) 更实用 A7-4 对应于重复计数 400 个 ( 总共 800 个 ) 精子所得到的平均百分率, 两次评估值之间的可接受差异 均值 % 差异 * 均值 % 差异 * ~81 6 1~3 2 82~88 5 4~6 3 89~93 4 7~ ~ ~ ~ ~ ~69 7 * 基于 95% 可信区间的整数近似值 A7.4 理想的质量控制样本应该是所在实验室检测的所有精液样本的典型代表 如 果仅对少数几个 QC 样本进行分析, 这些样本应该是与实验室的主要检测活动最具 相关性的 例如, 在不育症服务机构的实验室, 就应该选择那些有临床意义的 QC 样本 ( 精子浓度 ~ /ml, 前向运动 30%~50%, 正常形态学低于 5%) 将合并的精液样本分装后可以冻存或加防腐剂保存于 4, 用于定期分析精 子浓度 冷冻保存后的精子不能很好存活, 因此不能被用作活力分析和精子抗体试验 的内部和外部 QC 样本 录像带 CD 和 DVD 也可用于评估精子活力 照片 录像带 CD 和 DVD 都可用于评估精子形态学 视频录像可特别用于评估精子活力和精子形态学的培训, 但只是辅助而不能 替代对精液样本的重复评估 经过染色的精液涂片可用于精子形态学质量控制 固定过的涂片可贮存起来 用于监测染色情况 经过染色的涂片可能会随时间而褪色, 具体取决于固定 和染色的质量 但是, 按照本手册提供的方法进行巴氏染色并在室温避光贮 存的涂片, 其稳定性可持续长达数月, 甚至数年 抗精子抗体阳性的血清可以用于间接免疫珠试验的 QC, 但不推荐用于直接 免疫珠试验 A7.5 本方案描述了如何制作视频录像, 用于精子活力人工评估过程的质量控制 记录至少 5 个 最多 10 个视野, 用以模拟精液分析过程中活力分析时的多视野评估 至少需要有 400 个精子可供评估
248 附录 7 抽样误差和质量控制 225 视频录像应该包括来自几个不同精液样本的图像, 涵盖常规精液分析中所见 的各种活力类型 录像带中可以仅包括来自少数几个精液标本的 5 个视野 在有些情况下则可 能需要更复杂的记录, 例如用于实验室间或多中心研究的标准化 在这种情 况下, 要使用更多的精液样本, 并且在整个录像带中有些样本可能是随机反 复使用的 反复使用的样本可评估不同检测人员之间的检测准确性 A7.5.1 除了用于评估精子活力的常规设备, 用于质量控制的录像制作还需要 : 带有 CD-RW 或 DVD-RW 驱动器的录像机或计算机 ; 用于编码视频录像内容的标记设备, 例如表面刻有数字的定位玻片 (England A7.5.2 finder) 或时标器 (time generator) 如果可以得到多个精液样本, 整个视频录像可一次制作完成 ; 另外, 可以对得 到的样本分期录制 如果对精子活力的评估是在室温下进行的, 那么录制也应该在室温下进行 同理, 如果对精子活力的评估是在 37 进行的, 那么录制也应该在同样的温 度下进行 如果录制是在 37 进行的, 应该打开镜台加热器, 使之至少在使用前 10 分钟达到一个稳定的温度 制作录像时要录制足够的视野, 以确保记录了 400 个来自数份不同精液样本 的精子 对于精子浓度低的样本, 可能有必要记录 10 个以上视野才能有足够数量的 精子用于评价 视频录制 10 个视野将会耗费数分钟 无论是用有盖玻片的载玻片, 还是用固定深度为 20µm 的计数池进行分析, 均可制作视频录像 1 与带有盖玻片的载玻片相比, 使用一次性计数池的玻片能使精子活力 稳定更长时间 这样可允许记录同一制片的 10 个 ( 或更多 ) 视野 2 当所使用的是带有盖玻片的载玻片时, 在视频录制过程中可能有必要 用到多张玻片, 以避免活力随时间延长而显著下降 确定几份具有不同活力值的精液样本 在视频录像中每个样本都应该有自己特有的编码 编码可以是简单地标记每 个样本, 也可以标记每个样本的每个视野 例如, 第 1 个样本标记可以在第 1 个视野开始时进行, 在第 2 个样本出现之前不需要进行其他标记 也可以标 记每个独立视野, 例如将第 1 个样本的第 1 个视野标记为 01-01, 第 1 个样本 的第 2 个视野标记为 等等 这种更为细致的标记体系有助于检测人员
249 226 附录在分析时进行追踪定位 1 对不同的视野或不同的样本进行视频记录时, 期间留有短空白片段非常有用 有助于检测人员辨认新片段的开始 2 在记录当中获得空白片段最便捷的方法是遮蔽光源 3 留置空白片段也可以在暂停视频录像机前进行, 应当使用的是 暂停 键, 而不是 停止 键, 因为 停止 键可能使录像带产生噪音或静电干扰 在可用于录制样本的放大倍数下, 录制 10 秒镜台测微尺的影像 该放大倍 数下, 在监视器上显示的图像应该与在光学显微镜下分析时所见的相似 镜 台测微尺的图像是对该放大倍数的永久记录, 这样在录像带分析或 CASA 设 备校准时, 就可以对覆盖在屏幕上的醋酯膜栅格进行校准 对第 1 个样本的编码图像录制 5~7 秒 录制即将结束时遮蔽光源 3 秒, 留 下空白片段作为标记 ; 然后暂停录制 确定用于录制的第 1 个精液样本 将 10µl 充分均匀的精液置于一个载玻片 上, 覆盖 22mm 22mm 的盖玻片, 或将 7µl 充分均匀的精液加入一个计数池 静置样本几秒钟 ( 如果需要, 在 37 条件下进行操作 ), 直至液体停止流动 按照图 A7-3 所示的模式记录 10 个 ( 或更多 ) 视野 当用于 CASA 的质控时, 精子浓度不应超过 /ml; 必须使用同一份标本的精浆对精子浓度高的 样本进行稀释 ( 见 节 ) 选择靠近盖玻片或计数池左上角的区域为第一个视野, 边距至少 5mm 对该 视野录制 15 秒, 尽量保持显微镜和镜台稳定 15 秒后录制一个时长为 3 秒 的空白片段, 然后暂停录制 如果要对单个视野进行编码, 则改变编号并录 制仅含有该编码数字的图像 5~7 秒 按照图 A7-3 所示的模式, 在玻片上或计数池中定位第 2 个活动视野, 并录制 该视野 15 秒 同样,15 秒后录制一个时长为 3 秒的空白片段, 暂停录制 若 需要, 改变编号来标识第 3 个视野 以这样的方式继续录制, 直至采集到总 共至少 400 个精子 (10 个或更多视野, 取决于精子浓度 ) 最后一个视野和一 个时长为 3 秒的空白片段录制完毕后, 停止录制 A7-3 辅助评估精子活力按顺序扫描视野, 视频记录精子活力, 扫描视野距离盖玻片边缘至少 5mm
250 附录 7 抽样误差和质量控制 227 制备第 2 个样本 录制样本 2 的编码图像 5~7 秒, 然后录制一个时长为 3 秒的空白片段 根据上述步骤录制第 2 个样本, 记录 10 个或更多的视野, 每次 15 秒, 每个视 野录制完毕后录制一个空白片段, 最后一个视野录制结束后也要录制一段空 白片段 重复这一步骤进行视频录像, 直至达到所希望的样本数目 如果想要制作包括随机反复使用样本的较复杂 IQC 精子活力视频录像, 则需要第 2 台摄像机或配备特殊视频编辑软件的计算机 在这种情况下, 每个样本都应当单独进行视频记录, 且只对视野进行标记, 而不用记录样本号, 因为在录制过程中样本号可能会因为样本被反复使用而改变 如果有一台配备视频编辑软件的计算机, 可以在一台 DVD 上对各个样本的图像进行数字化及随意组合 A7.5.3 在分析视频录像时, 将一个醋酯膜栅格覆盖在视频监视器上, 如下所示 这 样可以模拟用显微镜分析时目镜中的栅格 ( 图 A7-4a) 将镜台测微尺安置在显微镜载物台上, 使用分析精子活力用的放大倍数 通 过带有网线的目镜观察 ( 图 A7-4), 用镜台测微尺测量栅格部分的尺寸 在这 个例子, 栅格为 125µm 125µm, 每个正方形为 25µm 25µm( 图 A7-4b) 记录 这些测量结果 A7-4 通过带有网线 ( 红色栅格 ) 的目镜观察 通过视频监视器放映录像, 在出现测微尺图像时暂停 ( 图 A7-5a) 将一张醋酸薄膜覆盖在屏幕上并绘制一个正方形, 大小如同上述目镜栅格中 的一个正方形 ( 图 7-5b) 完成整个目镜栅格图的绘制 (25 个正方形 )( 图 A7-5c)
251 228 附录 为了分析视频录像, 将醋酸栅格膜固定在视频监视器上 应该在栅格线覆盖 的标准化区域 ( 例如最上面两排或中间三排 ) 进行分析 每个录制区段重复评估 200 个精子, 对其进行评分 A7-5 监视器上显示的镜台测微尺录像和覆盖在监视器上的绘制栅格, 说明见文内 A7.6 A7.6.1 精子浓度测定程序中的一些步骤可以用实验室制备的稀释过的贮存精液样本 进行监测 IQC 样本应该代表实验室常规精液分析时所见到的各种精子浓度样本 用防腐剂稀释精液, 分装于贮存小瓶中冷藏, 用于以后的精子计数 制备悬液时应注意彻底混匀标本, 确保由同一标本制备的分装小瓶中精子浓 度完全相同 这样在计数 IQC 样本时所出现的差异就可以归咎于计数过程 的问题 在使用血细胞计数板评估精子浓度前需再次稀释冻存的 IQC 样本, 采用实验 室常规计数过程中的最终稀释倍数 这样可以确保背景中的杂质和其他非精 子细胞的浓度与常规评估中所见类似 例如, 如果最初用等体积的稀释液稀 释精液, 要额外进行 1 + 9(1 10) 的稀释, 最终得到 1 20 的终浓度 如果希望冻存低浓度的精子样本, 首选低浓度精液样本, 而不是用高浓度的 精液样本进行大量稀释 这样可以确保本底与常规精液分析时所见相似 上游精子制备物中不包含杂质 无尾精子头和细胞碎片等常规精液分析中所 见的污染物, 最好仅用于监测进行过类似筛选的精子悬液的计数 用于 IQC 的精子悬液的一次制备量取决于检测人员的人数和计量频度 冷藏的稀释精液, 其稳定性至少可保持 4 个月 A7.6.2 使用以下 3 种防腐剂的任一种 : 甲醛溶液 :10%(v/v) 甲醛 将 10ml 37%(v/v) 的甲醛加入到 27ml 纯水中 叠氮化物 (Jørgensen et al.,2001):3mol/l 叠氮钠 (NaN 3) 将 19.5g NaN 3 溶解 于 100ml 纯水中
252 附录 7 抽样误差和质量控制 229 抗凝液 (APSIS)(Brazil et al.,2004) 向 100ml 纯水中加入 1.0g 牛血清白蛋白 (BSA),2.0g 聚乙烯吡咯烷酮 (PVP),0.90g 氯化钠 (NaCl),0.1ml Triton X-100,0.004ml 有机硅消泡剂和 0.10g 叠氮钠 充分混匀后, 用孔径为 0.45µm 的滤器过滤消除杂质 贮存于 4 APSIS 中可以不加入杀菌剂叠氮钠, 以避免溶液毒性 但是, 这样的溶液一旦被污染, 必须废弃 A7.6.3 除了用于评估精子浓度的常规仪器以外, 制备 QC 样本还需要 : 冷冻管或其他利于贮存且管盖紧密的小管 用于标记试管的永久性标记笔 A 确定一些浓度与期望值近似的精液标本 所需保存精液的体积取决于实验室的需求 ; 可以冻存所得到的整份精液, 也可以稀释成 4ml 不同浓度的精子悬液 采集精液后尽可能用稀释液稀释 如果使用 APSIS 稀释和保存, 稀释前放置时间越长, 稀释后形成结晶的几率就越大 这些结晶可能干扰向计数池中加样和计数精子 将所需体积的精液移至 15ml 离心管中 每毫升精液加入 100µl 10%(v/v) 甲醛溶液,10µl 3mol/L 的叠氮化物或 1ml APSIS 在所有拟贮存样本的小瓶上标记明确的信息和制备日期 应该打开瓶盖或顶盖, 并将小瓶置于试管架上, 以便快速 便捷地分装 稀释保存的精液在整个分装过程中一定要充分混匀, 以确保所有小瓶中含有同样浓度的精子 混匀后即使耽搁很短时间也可能使精子重新沉淀, 从而改变分装样本中的精子浓度 确保持续混匀的一种方法是将装有稀释精液的离心管置于试管架上, 然后一手持塑料移液管不断混匀精液, 可用另一只手持移液管吸出等分精液 每个小瓶的容积应该为 0.5~1.0ml, 具体取决于实验室的需要 以 0.5ml 为单位贮存样本, 每个小瓶中的贮存样本可以用于计数多次 将拟保存的精子悬液分装到所有小瓶, 即刻拧紧瓶盖 可用实验室自封膜封住瓶盖, 这取决于所用小瓶的类型 如果使用的是冷冻管, 就不必了 重复上述整个过程制备其余的精液标本 将小瓶贮存于 4 应该在 IQC 溶液制备后测定其浓度, 而不应当根据原始的精子浓度推测 保存的精子悬液制备完成后, 在需要评估时取用 1 小瓶 ( 见 2.7 和 2.8 节 ) 可以按照 7.7 节描述的步骤将结果做成曲线图 所有计数均需使用该实验室常用的计数方法进行 以下部分介绍使用血细胞计数板进行计数的步骤
253 230 附录 A7.6.5 IQC 在计数前, 保存的溶液必须进一步稀释 ; 稀释倍数取决于已用的保存液 用甲醛溶液和叠氮化合物保存的精液, 初始稀释倍数小, 因此可以忽略不计 保存在 APSIS 中的精液初始稀释了 2 倍 [ 即 1 + 1(1 2)], 这在计算终浓度时 必须考虑进去 用 APSIS 稀释的精子悬液其原始精子浓度若超过 /ml, 计数的时候最 好进一步进行 1 + 9(1 10) 的稀释 可以通过向 450µl 纯水中加入 50µl 保存 的精子悬液来达到这一稀释度 这样可使得最终精液的稀释倍数为 1 20 不 要用 APSIS 作为稀释液, 因为那样会干扰精子在血细胞计数池的网格上沉降 为了进行下面步骤, 所有的移液器都应该预设到所需加样体积, 并装上一个 洁净的吸头, 以便于混匀后即刻快速吸取等分溶液 应在一个稀释小瓶中加入适量水备用 ( 如上所述, 加 450µl 水进行 1 10 稀释 ) 应将精液贮存瓶置于涡旋振荡器上, 以最大速度大约 30 秒充分混匀瓶中的 内容物, 然后每次吸出 50µl, 加入装有纯水的稀释瓶中 然后将稀释瓶置于 涡旋振荡器上 20 秒, 以最大速度混匀 向计数池中加入 10µl 悬液, 如 和 节所描述的方法计数精子 如果制备保存精液所使用的原始精液样本的精子浓度低, 应该对稀释倍数进 行相应调整 例如, 如果原始精子浓度为 4~ /ml, 要在实验室中达到 最终 1 5 的稀释倍数,APSIS 保存的精液进一步以 2 5 稀释 [2 + 3: 因为精液 已经用 APSIS 1 + 1(1 2) 稀释过了 ] 可以通过用 75µl 纯水稀释 50µl 冷藏 精液来达到上述稀释倍数 在冰箱中贮存的冷藏精子悬液至少可稳定 4 个月, 届时应制备新的精子悬液 最好有一个重叠期, 其间新旧制备物都可以使用, 用于对过渡期进行监测 A7.7 A7.7.1 可以在实验室里制备涂片用于形态学染色和分析时的内部质量控制 可以用几个不同的精液样本, 每个样本制备多张涂片, 代表实验室常规形态 学评估时所见的一系列精子形态 涂片可以固定并贮存以备监测染色和分析程序 用于形态学分析程序的 QC 时, 染色的涂片可单独使用或重复使用 重复使用可确定检测人员自身操作的准确性 这些 QC 涂片也可用于实验室 内部不同检测人员之间检测结果的比较, 或不同实验室之间分析结果的比较 经过巴氏染色并封片的涂片在室温条件下避光贮存, 其稳定性可以保持数 月, 甚至数年 在涂片制备的整个过程中必须充分混匀精液, 以确保从一个特定精液样本制 备所得的所有涂片是完全一致的 这样可以假设在分析过程中发现的任何较
254 附录 7 抽样误差和质量控制 231 A7.7.2 大变化都来自被监测的过程 ( 即形态学分析过程 ), 而不是由于在制片过程中 没有充分混匀精液所致 将精液从标本容器移入一个容量为 15ml 的离心管, 以便在制片过程中可以更容易也更彻底地混匀精液 用不掉屑的纸巾用力擦拭带磨砂端的玻片, 以清洁玻片的两面 用 HB(2 号 ) 铅笔在磨砂面上标记识别信息 ( 例如标号和日期 ) 用铅笔所做的标记在整个涂片固定和巴氏染色过程中都会完好保留, 而用钢笔和某些永久标记笔所做的墨水标记则会脱落 在移液器上安装一个洁净的吸头, 并将移液器定容为 10µl( 或实验室用于制备形态学涂片时使用的常规容量 ) 在整个过程中必须充分混匀精液, 以确保所有的涂片尽量一致 混匀后, 即使移液前的短暂耽搁也会使精子重新沉降, 而使加载在玻片上的精子数目发生改变 用大吸头 ( 直径约 1.5mm) 反复吹打样本 10 次, 使样本在离心管中充分混匀 吸头要预先平衡至样本温度 吹打要有力, 足以混匀精液, 但不要过于用力, 以免产生气泡 混匀后立即将 10µl 精液加至一张已清洁玻片的光滑端, 不要耽搁, 避免精子沉降 重要的是立即涂片, 不要让精液滴在玻片上停留超过数秒 采用拉片法 ( 见 节 ) 在玻片表面制成涂片 在此过程中, 用另一张玻片的边缘沿着玻片表面拖拉精液滴 确保这张玻片将精液 拉 至整个玻片表面, 不要用玻片从后面 推 精液 一定注意不要把涂片制得太厚, 否则精子会重叠或成团及背景染色太深 在玻片上精子分散开取决于精液量和精子浓度 拖动玻片的角度 ( 角度越小, 涂片越薄 )(Hotchkiss,1945) 和速度 ( 动作越快, 涂片越厚 )(Eliasson,1971) 重复步骤 6~8 完成其他玻片的制备 每次混匀后仅制备一张玻片, 确保在每次取样前精子不会沉降 如果混匀后停留超过数秒, 须再次混匀后取样 技术熟练后, 可以在每次混匀后制备 2 张或 3 张涂片 应当在混匀后立刻完成所有取样, 尽快在几秒钟内完成 2 张或 3 张涂片 A7.8 移液器 计数板和其他仪器应当每隔 6 个月或每年校准一次 A7.8.1 应该定期使用内部校准器校正天平, 以及在实验室定期维护时进行外部校准 通过称量外部标准砝码来校准天平 ( 例如,1 2 5 和 10g 砝码, 其范围涵盖一 系列精液重量 ) 重复测量 10 次, 并计算均值 SD 和变异系数 (CV)(= 100 SD/ 均值 )
255 232 附录 检查精确度 ( 确保标称重量处于测定所得均值的 2SD 之内 ) A7.8.2 通过吸取纯水至刻度线并将其加入扣除皮重的称量盘来校准 假设水的密度为 1g/ml, 根据吸取水的重量计算预期体积 水的密度会随着温度升高而下降 (Lentner,1981) 20 时为 g/ml, 30 时为 g/ml,40 时为 g/ml 但用于校准时, 假设为 1.0g/ml 就 可以了 重复测量 10 次, 并计算均值 SD 和 CV(= 100 SD/ 均值 ) 检查精确度 ( 确保标称体积处于测定所得均值的 2SD 之内 ) A7.8.3 使用显微镜细焦点游标尺 (Vernier scale) 测量计数池的深度 首先聚焦于计 数池的网格, 然后聚焦到盖玻片底面的墨水印上 计数两点之间刻度数 重复计数 10 次, 并计算均值 SD 和 CV(= 100 SD/ 均值 ) 检查精确度 ( 确保标称深度处于测定所得均值的 2SD 之内 ) A7.8.4 应当使用温度计来核查恒温箱和显微镜加温载物台的温度 温度计也要定期 校准 应当通过恒温箱的数字显示装置每天查看 CO 2 混合气体, 或通过其他气体分 A7.8.5 ph 析系统进行周检或月检, 以及在维护时进行气体采样检查 应当用已知 ph 的标准液进行检测 A7.8.6 其他实验室仪器 ( 如 ph 计等 ) 和试剂也应当根据标准每隔 3~6 个月核查一次
256 233
257
材料 方法
 生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
g ml 10% ph 色谱条件 kinetex C μm 100 A 4. 6 mm 150 mm 25 5 μl A B 10 mmol /L ml /min
 25 4 2013 8 监测技术 5 1 2 1 ( 1. 江苏省疾病预防控制中心, 江苏南京 210009; 2. 南京医科大学第二附属医院, 江苏南京 210029) 5 Phenomenex kinetex C 18 2. 6 μm 4. 6 mm 150 mm 10 mmol /L ph 2. 5 + 60 40 DAD 280 nm 5 20. 0 mg /L ~ 100 mg /L 0.
25 4 2013 8 监测技术 5 1 2 1 ( 1. 江苏省疾病预防控制中心, 江苏南京 210009; 2. 南京医科大学第二附属医院, 江苏南京 210029) 5 Phenomenex kinetex C 18 2. 6 μm 4. 6 mm 150 mm 10 mmol /L ph 2. 5 + 60 40 DAD 280 nm 5 20. 0 mg /L ~ 100 mg /L 0.
Fig1 Theforceappliedtothetrainwhenrunning :w = w j +w q (3) :w = w = w 0 +w j (4) w i 121 基本阻力 w r = 600 R ( N/kN) (8) :R : [2] w s [3] w s =0
![Fig1 Theforceappliedtothetrainwhenrunning :w = w j +w q (3) :w = w = w 0 +w j (4) w i 121 基本阻力 w r = 600 R ( N/kN) (8) :R : [2] w s [3] w s =0 Fig1 Theforceappliedtothetrainwhenrunning :w = w j +w q (3) :w = w = w 0 +w j (4) w i 121 基本阻力 w r = 600 R ( N/kN) (8) :R : [2] w s [3] w s =0](/thumbs/88/114838964.jpg) 31 4 2012 8 JournalofLanzhouJiaotongUniversity Vol31No4 Aug2012 :1001-4373(2012)04-0097-07 * 张友兵 张 波 ( 100073) : 分析了列车运行过程中的受力情况 给出了制动过程中减速度的计算方法 并采用正向 反向两种迭代方式计算列车制动曲线 两种方式计算出的制动曲线一致 证明了计算制动曲线的方法是正确的
31 4 2012 8 JournalofLanzhouJiaotongUniversity Vol31No4 Aug2012 :1001-4373(2012)04-0097-07 * 张友兵 张 波 ( 100073) : 分析了列车运行过程中的受力情况 给出了制动过程中减速度的计算方法 并采用正向 反向两种迭代方式计算列车制动曲线 两种方式计算出的制动曲线一致 证明了计算制动曲线的方法是正确的
图书在版编目穴 CIP 雪数据做事细节全书 / 赵彦锋编著郾 北京 : 企业管理出版社, ISBN Ⅰ 郾做... Ⅱ 郾赵... Ⅲ 郾工作方法 通俗读物 Ⅳ 郾 B 中国版本图书馆 CIP 数据核字 (2005) 第 号 书
 做事细节全书 赵彦锋著 企业管理出版社 图书在版编目穴 CIP 雪数据做事细节全书 / 赵彦锋编著郾 北京 : 企业管理出版社, 2005.11 ISBN 7-80197-338-0 Ⅰ 郾做... Ⅱ 郾赵... Ⅲ 郾工作方法 通俗读物 Ⅳ 郾 B026-49 中国版本图书馆 CIP 数据核字 (2005) 第 136676 号 书 名 : 做事细节全书 作 者 : 赵彦锋 责任编辑 : 吴太刚
做事细节全书 赵彦锋著 企业管理出版社 图书在版编目穴 CIP 雪数据做事细节全书 / 赵彦锋编著郾 北京 : 企业管理出版社, 2005.11 ISBN 7-80197-338-0 Ⅰ 郾做... Ⅱ 郾赵... Ⅲ 郾工作方法 通俗读物 Ⅳ 郾 B026-49 中国版本图书馆 CIP 数据核字 (2005) 第 136676 号 书 名 : 做事细节全书 作 者 : 赵彦锋 责任编辑 : 吴太刚
背景 1980 年出版第一版 人类精液及精子 宫颈精液实验实检验手册 ( 生育调节 ) 1987 年出版第二版 ( 生育调节 不育症的诊治 ) 1992 年出版第三版 ( 生育调节 不育症的诊治 环境污染 ) 1999 年出版第四版 ( 男用避孕病 辅助生育技术 -ICSI 环境污染 )
 WHO 人类精液检查与处理实验手册 ( 第五版 ) 修订要点及临床应用 背景 1980 年出版第一版 人类精液及精子 宫颈精液实验实检验手册 ( 生育调节 ) 1987 年出版第二版 ( 生育调节 不育症的诊治 ) 1992 年出版第三版 ( 生育调节 不育症的诊治 环境污染 ) 1999 年出版第四版 ( 男用避孕病 辅助生育技术 -ICSI 环境污染 ) 背景 以往精液分析存在问题 : 检测方法不一
WHO 人类精液检查与处理实验手册 ( 第五版 ) 修订要点及临床应用 背景 1980 年出版第一版 人类精液及精子 宫颈精液实验实检验手册 ( 生育调节 ) 1987 年出版第二版 ( 生育调节 不育症的诊治 ) 1992 年出版第三版 ( 生育调节 不育症的诊治 环境污染 ) 1999 年出版第四版 ( 男用避孕病 辅助生育技术 -ICSI 环境污染 ) 背景 以往精液分析存在问题 : 检测方法不一
3 4 5 1 1-20 4 2, 260mOsm/kg 320 mosm/kg HEPES ph 7.2-7.4 ph ph (7.4-7.7), ph (7.0-7.4) NaHCO 3 CO 2 CO 2 CO 2 5 2
 1 (1) (2) ( ) (3) (4) (5) (1) (2) (3) 2 (1) ( ) (2) (3) (4) 1 2 1 3 4 5 1 1-20 4 2, 260mOsm/kg 320 mosm/kg HEPES ph 7.2-7.4 ph ph (7.4-7.7), ph (7.0-7.4) NaHCO 3 CO 2 CO 2 CO 2 5 2 NaHCO 3 1.97g/L CO 2
1 (1) (2) ( ) (3) (4) (5) (1) (2) (3) 2 (1) ( ) (2) (3) (4) 1 2 1 3 4 5 1 1-20 4 2, 260mOsm/kg 320 mosm/kg HEPES ph 7.2-7.4 ph ph (7.4-7.7), ph (7.0-7.4) NaHCO 3 CO 2 CO 2 CO 2 5 2 NaHCO 3 1.97g/L CO 2
材料與方法
 10-12 250-350 Sprague-Dawley rat ( SD ) 12 ( AM 8 00-PM 8 00 ) (Control group) (HS) (Heat shock group) 15 0 4 6 16 24 (PAE) ( Pulmonary air embolism group) 20 40 (25 l/min) 40 17 20 (HS&PAE) 15 4 16 20
10-12 250-350 Sprague-Dawley rat ( SD ) 12 ( AM 8 00-PM 8 00 ) (Control group) (HS) (Heat shock group) 15 0 4 6 16 24 (PAE) ( Pulmonary air embolism group) 20 40 (25 l/min) 40 17 20 (HS&PAE) 15 4 16 20
男性不育患者精子形态与生育能力和血清生殖激素水平关系的研究 研究生唐文豪导师马潞林教授副导师姜辉教授北京大学第三医院外科学 ( 泌尿外 ) 中文摘要 目的研究男性不育患者精子形态与男性生育能力的关系, 探讨评估男性生育能力的最佳指标 ; 通过研究男性不育患者精子形态与生殖激素的关系, 探讨畸形精子症
 博士研究生学位论文 论文题目 : 男性不育患者精子形态与生育能力和血清生殖激素水平关系的研究 姓 名 : 唐文豪 学 号 : ZLB29035 学 院 : 北京大学第三临床医学院 专 业 : 外科学 ( 泌尿外 ) 导 师 : 马潞林教授 副导师 姜辉 教授 完成时间 : 二零一二年五月 - 1 - 男性不育患者精子形态与生育能力和血清生殖激素水平关系的研究 研究生唐文豪导师马潞林教授副导师姜辉教授北京大学第三医院外科学
博士研究生学位论文 论文题目 : 男性不育患者精子形态与生育能力和血清生殖激素水平关系的研究 姓 名 : 唐文豪 学 号 : ZLB29035 学 院 : 北京大学第三临床医学院 专 业 : 外科学 ( 泌尿外 ) 导 师 : 马潞林教授 副导师 姜辉 教授 完成时间 : 二零一二年五月 - 1 - 男性不育患者精子形态与生育能力和血清生殖激素水平关系的研究 研究生唐文豪导师马潞林教授副导师姜辉教授北京大学第三医院外科学
 张天时 孔 杰 刘 萍 王清印 张庆文 在中国对虾 家系建立过程中 我们采用定向交配对子代进行选育的方法 采用 种中国对虾人工授精方法 即整个精荚移植 精荚切块移植 输精管移植和精液移 植 共进行了 例雌虾的人工授精实验 有 尾雌虾成功产卵并孵化出仔虾 成功率为 建立了 个全同胞家系和 个半同胞家系 在受精卵孵化 育苗的基础上 同时进行了 不同家系幼体生长情况的研究 结果表明受精率 孵化率 存活率以及初期生长在
张天时 孔 杰 刘 萍 王清印 张庆文 在中国对虾 家系建立过程中 我们采用定向交配对子代进行选育的方法 采用 种中国对虾人工授精方法 即整个精荚移植 精荚切块移植 输精管移植和精液移 植 共进行了 例雌虾的人工授精实验 有 尾雌虾成功产卵并孵化出仔虾 成功率为 建立了 个全同胞家系和 个半同胞家系 在受精卵孵化 育苗的基础上 同时进行了 不同家系幼体生长情况的研究 结果表明受精率 孵化率 存活率以及初期生长在
/. : 2008.10 ISBN 978-7-81086-588-3 Ⅰ. Ⅱ. Ⅲ. - Ⅳ. R155 CIP (2008) 149577, 17 710032 029-84776765 029-84776764 2008 10 1 2008 1
 /. : 2008.10 ISBN 978-7-81086-588-3 Ⅰ. Ⅱ. Ⅲ. - Ⅳ. R155 CIP (2008) 149577, 17 710032 029-84776765 029-84776764 http://press.fmmu.sn.cn 2008 10 1 2008 10 1 787 1092 1/16 13.5 150 ISBN 978-7-81086-588-3/R
/. : 2008.10 ISBN 978-7-81086-588-3 Ⅰ. Ⅱ. Ⅲ. - Ⅳ. R155 CIP (2008) 149577, 17 710032 029-84776765 029-84776764 http://press.fmmu.sn.cn 2008 10 1 2008 10 1 787 1092 1/16 13.5 150 ISBN 978-7-81086-588-3/R
Ps22Pdf
 ( CIP) /,. :, 2003. 10 ISBN 7-5624- 2977-4............ :. G479 CIP ( 2003) 087438 : : : : * : : 174 ( A ) : 400030 : ( 023) 65102378 65105781 : ( 023) 65103686 65105565 : http: / /www. cqup. com. cn :
( CIP) /,. :, 2003. 10 ISBN 7-5624- 2977-4............ :. G479 CIP ( 2003) 087438 : : : : * : : 174 ( A ) : 400030 : ( 023) 65102378 65105781 : ( 023) 65103686 65105565 : http: / /www. cqup. com. cn :
图书在版编目 (CIP) 数据 满堂花醉 / 沈胜衣著. 南京 : 江苏教育出版社, ( 沈郎文字 ) ISBN Ⅰ. 满... Ⅱ. 沈... Ⅲ. 作家 - 人物研究 - 世界 Ⅳ.K815.6 中国版本图书馆 CIP 数据核字 (2005) 第 041
 图书在版编目 (CIP) 数据 满堂花醉 / 沈胜衣著. 南京 : 江苏教育出版社, 2005.4 ( 沈郎文字 ) ISBN 7-5343-6512-0 Ⅰ. 满... Ⅱ. 沈... Ⅲ. 作家 - 人物研究 - 世界 Ⅳ.K815.6 中国版本图书馆 CIP 数据核字 (2005) 第 041843 号 出版者社址网址出版人 南京市马家街 31 号邮编 :210009 http://www.1088.com.cn
图书在版编目 (CIP) 数据 满堂花醉 / 沈胜衣著. 南京 : 江苏教育出版社, 2005.4 ( 沈郎文字 ) ISBN 7-5343-6512-0 Ⅰ. 满... Ⅱ. 沈... Ⅲ. 作家 - 人物研究 - 世界 Ⅳ.K815.6 中国版本图书馆 CIP 数据核字 (2005) 第 041843 号 出版者社址网址出版人 南京市马家街 31 号邮编 :210009 http://www.1088.com.cn
医学院 系 课程教案记录本
 医 学 院 临 床 医 学 系 妇 产 科 学 课 程 教 案 记 录 本 课 程 名 称 妇 产 科 教 师 及 职 称 黄 荷 凤 教 授 授 课 内 容 生 殖 内 分 泌 相 关 疾 病 和 计 划 生 育 学 时 数 3 学 时 授 课 方 式 理 论 授 课 学 期 2007-2008 第 二 学 期 授 课 对 象 04 级 七 年 制 临 床 医 学 教 学 目 的 ( 教 学 大
医 学 院 临 床 医 学 系 妇 产 科 学 课 程 教 案 记 录 本 课 程 名 称 妇 产 科 教 师 及 职 称 黄 荷 凤 教 授 授 课 内 容 生 殖 内 分 泌 相 关 疾 病 和 计 划 生 育 学 时 数 3 学 时 授 课 方 式 理 论 授 课 学 期 2007-2008 第 二 学 期 授 课 对 象 04 级 七 年 制 临 床 医 学 教 学 目 的 ( 教 学 大
2 3 4 5 22 22 23 25 35 38 39 45 46 1
 97017626 O O 2 3 4 5 22 22 23 25 35 38 39 45 46 1 intrauterine insemination IUI 202 IUI a 24 IUI b 24 IUI c hcg 36 IUI d hcg 24 48 IUI 202 262 30 2 1 27 1 14.9% 11.5% a 122 151 13.9%, 11.3% b 42 46 2.38%,
97017626 O O 2 3 4 5 22 22 23 25 35 38 39 45 46 1 intrauterine insemination IUI 202 IUI a 24 IUI b 24 IUI c hcg 36 IUI d hcg 24 48 IUI 202 262 30 2 1 27 1 14.9% 11.5% a 122 151 13.9%, 11.3% b 42 46 2.38%,
 社 心 版 中 出 版 学 科 术出 k.cn 技 boo 教.a 职 ww w 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 社 心 版 中 出 版 学 n 出 c 科 术 k. o 技 o b 教 a 职 ww. w 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学
社 心 版 中 出 版 学 科 术出 k.cn 技 boo 教.a 职 ww w 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 社 心 版 中 出 版 学 n 出 c 科 术 k. o 技 o b 教 a 职 ww. w 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学
<4D F736F F D20312D3120D5D0B9C9CBB5C3F7CAE9A3A8C9EAB1A8B8E5A3A92E646F63>
 创 业 板 风 险 提 示 本 次 股 票 发 行 后 拟 在 创 业 板 市 场 上 市, 该 市 场 具 有 较 高 的 投 资 风 险 创 业 板 公 司 具 有 业 绩 不 稳 定 经 营 风 险 高 退 市 风 险 大 等 特 点, 投 资 者 面 临 较 大 的 市 场 风 险 投 资 者 应 充 分 了 解 创 业 板 市 场 的 投 资 风 险 及 本 公 司 所 披 露 的 风 险
创 业 板 风 险 提 示 本 次 股 票 发 行 后 拟 在 创 业 板 市 场 上 市, 该 市 场 具 有 较 高 的 投 资 风 险 创 业 板 公 司 具 有 业 绩 不 稳 定 经 营 风 险 高 退 市 风 险 大 等 特 点, 投 资 者 面 临 较 大 的 市 场 风 险 投 资 者 应 充 分 了 解 创 业 板 市 场 的 投 资 风 险 及 本 公 司 所 披 露 的 风 险
 黄寿松等 儿种植物中的过氧化物酶同工酶分析 图版 两种不同凝胶系统同工酶谱的比较 7 凝胶系统分离的酶谱 V 0 凝胶系统分离的酶谱 材料 一高梁 亨加利 发芽 3天的全苗 V一水稻 银坊 发芽 4天的全苗 2 正极向电泳时过硫酸 按 澳 酚蓝 和过氧化物 酶同工酶 带的位置 a 同工酶带 b 澳酚蓝 c 过硫酸按 材料 高梁 亨加利 发芽 6天的全苗 3 预电泳和未预电泳凝胶分离的酶谱比较 一未预电泳凝胶分离的同工酶谱
黄寿松等 儿种植物中的过氧化物酶同工酶分析 图版 两种不同凝胶系统同工酶谱的比较 7 凝胶系统分离的酶谱 V 0 凝胶系统分离的酶谱 材料 一高梁 亨加利 发芽 3天的全苗 V一水稻 银坊 发芽 4天的全苗 2 正极向电泳时过硫酸 按 澳 酚蓝 和过氧化物 酶同工酶 带的位置 a 同工酶带 b 澳酚蓝 c 过硫酸按 材料 高梁 亨加利 发芽 6天的全苗 3 预电泳和未预电泳凝胶分离的酶谱比较 一未预电泳凝胶分离的同工酶谱
CIP / ISBN Ⅰ. Ⅱ. Ⅲ. - Ⅳ. E CIP ISBN 7-8
 2004 CIP /. - 1996. 3 ISBN 7-80023-968-3 Ⅰ. Ⅱ. Ⅲ. - Ⅳ. E297. 4 CIP 96 03988 8796 100080 6 1 18 010 82517246 880 1230 32 14 305 1996 4 1 2004 4 2 1 ISBN 7-80023-968-3 /K888 28. 00 1 1945 8 11 2 1932 1840
2004 CIP /. - 1996. 3 ISBN 7-80023-968-3 Ⅰ. Ⅱ. Ⅲ. - Ⅳ. E297. 4 CIP 96 03988 8796 100080 6 1 18 010 82517246 880 1230 32 14 305 1996 4 1 2004 4 2 1 ISBN 7-80023-968-3 /K888 28. 00 1 1945 8 11 2 1932 1840
兩願離婚之研究
 裂 不 1 女 女 不 sol-sol-sol-mi 令 不 女 不 念 力 沈 異 諾 不 來 倫理 律 兩 Paganini 靈 不 來 了 靈 羅 靈 1 年 62 1 2 La campanella 律 若 說 3 不理 2 說 女 律 理 不 不 了 不 類 律 類 理 歷 3 1860 年 chromosome 葉 1944 年 DNA 良 了 類 2 1 40 3 理 錄 諾 年 4
裂 不 1 女 女 不 sol-sol-sol-mi 令 不 女 不 念 力 沈 異 諾 不 來 倫理 律 兩 Paganini 靈 不 來 了 靈 羅 靈 1 年 62 1 2 La campanella 律 若 說 3 不理 2 說 女 律 理 不 不 了 不 類 律 類 理 歷 3 1860 年 chromosome 葉 1944 年 DNA 良 了 類 2 1 40 3 理 錄 諾 年 4
 张成思 本文运用向量系统下的协整分析方法 针对 年不同生产和消 费阶段的上中下游价格的动态传导特征以及货币因素对不同价格的驱动机制进行分析 研究结果表明 我国上中下游价格存在长期均衡关系 并且上中游价格对下游价格具有显 著动态传递效应 而下游价格对中游价格以及中游价格对上游价格分别存在反向传导的 倒逼机制 另外 货币因素对上游价格的动态驱动效果最为显著 但并没有直接作用于下 游价格 因此 虽然货币政策的现时变化可能在一段时间内不会直接反映在下游居民消费价格的变化上
张成思 本文运用向量系统下的协整分析方法 针对 年不同生产和消 费阶段的上中下游价格的动态传导特征以及货币因素对不同价格的驱动机制进行分析 研究结果表明 我国上中下游价格存在长期均衡关系 并且上中游价格对下游价格具有显 著动态传递效应 而下游价格对中游价格以及中游价格对上游价格分别存在反向传导的 倒逼机制 另外 货币因素对上游价格的动态驱动效果最为显著 但并没有直接作用于下 游价格 因此 虽然货币政策的现时变化可能在一段时间内不会直接反映在下游居民消费价格的变化上
第一章 化学反应中的质量关系和能量关系
 第 章酸碱反应和沉淀反应习题参考答案 解 :(1)pHlg (H )1.00 ()0.050mol HOA 溶液中, HOA H OA 平 /(mol ) 0.050 (H ) (OA ) a 1.8 (HOA ) 0.050 (H ) 9.5 mol ph lg (H ).0. 解 :(1)pH 1.00 (H ) 0.mol ph.00 (H ) 0.0mol 等体积混合后 :(H ) (0.mol
第 章酸碱反应和沉淀反应习题参考答案 解 :(1)pHlg (H )1.00 ()0.050mol HOA 溶液中, HOA H OA 平 /(mol ) 0.050 (H ) (OA ) a 1.8 (HOA ) 0.050 (H ) 9.5 mol ph lg (H ).0. 解 :(1)pH 1.00 (H ) 0.mol ph.00 (H ) 0.0mol 等体积混合后 :(H ) (0.mol
未命名-1
 1 2 3 4 5 6 7 8 9 10 11 12 ss a c y e vg 13 14 15 16 17 18 19 H 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 发现生命的螺旋 克里克在提出 中心法则 时曾指出 遗传信息是沿 D N A - R N A - 蛋白质的方向流动的 遗传信息不可能从 R N A 回到 D N
1 2 3 4 5 6 7 8 9 10 11 12 ss a c y e vg 13 14 15 16 17 18 19 H 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 发现生命的螺旋 克里克在提出 中心法则 时曾指出 遗传信息是沿 D N A - R N A - 蛋白质的方向流动的 遗传信息不可能从 R N A 回到 D N
1 产品说明 1 产品说明 1.1 规定 所述法兰是带有密封条的螺纹法兰, 可以交付带 G 1 或 G 1½ 内螺纹 (ISO 228 T1) 的法兰 在本附加说明书中的说明针对用材料 316L 制成的法兰 材料 316L 相当于 或 所有距离值以毫米为单位 提供多种不同
 附加说明书 符合 DIN - EN - ASME - JIS - GOST 的法兰 技术参数 Document ID: 31088 1 产品说明 1 产品说明 1.1 规定 所述法兰是带有密封条的螺纹法兰, 可以交付带 G 1 或 G 1½ 内螺纹 (ISO 228 T1) 的法兰 在本附加说明书中的说明针对用材料 316L 制成的法兰 材料 316L 相当于 1.4404 或 1.4435 所有距离值以毫米为单位
附加说明书 符合 DIN - EN - ASME - JIS - GOST 的法兰 技术参数 Document ID: 31088 1 产品说明 1 产品说明 1.1 规定 所述法兰是带有密封条的螺纹法兰, 可以交付带 G 1 或 G 1½ 内螺纹 (ISO 228 T1) 的法兰 在本附加说明书中的说明针对用材料 316L 制成的法兰 材料 316L 相当于 1.4404 或 1.4435 所有距离值以毫米为单位
Outlook. Preventing cervical cancer: Unprecedented opportunities for improving women's health.
 Volume 23 Number 1 June 2007 23 1 2007 8 1 40 HPV HPV HPV 50 15 1 80-85% 1. 71,862 Globocan 2002
Volume 23 Number 1 June 2007 23 1 2007 8 1 40 HPV HPV HPV 50 15 1 80-85% 1. 71,862 Globocan 2002
1 2 6 9 12 15 20 1 i 2 ii 3 iii 4 ix 5 x 6 A xi B xvi C xvi D xvii E xviii F xviii
 1 2 6 9 12 15 20 1 i 2 ii 3 iii 4 ix 5 x 6 A xi B xvi C xvi D xvii E xviii F xviii -1 - 455-2 - 3.5-3 - -4 - -5 - -6 - -7 - -8 - -9 - - 10 - -11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19
1 2 6 9 12 15 20 1 i 2 ii 3 iii 4 ix 5 x 6 A xi B xvi C xvi D xvii E xviii F xviii -1 - 455-2 - 3.5-3 - -4 - -5 - -6 - -7 - -8 - -9 - - 10 - -11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19
 避孕方法的医控模式和自控模式有变化吗 郑晓瑛 任 强 避孕节育是生殖健康极为重要的内容 文章利用国家人口和计划生育委员会 年至 年全国生育节育抽样调查和全国计划生育 生殖健康调查数据 分析了已婚育龄人口在避孕模式上的 时空变化特征 在此基础上进一步研究了在已婚育龄人口的年龄 子女数和生活的不同区域环境等方 面避孕模式的时空变化 结果表明 在我国人口转变的过程中 低生育水平下的避孕模式以及推行避 孕节育知情选择后已婚育龄人口的避孕模式
避孕方法的医控模式和自控模式有变化吗 郑晓瑛 任 强 避孕节育是生殖健康极为重要的内容 文章利用国家人口和计划生育委员会 年至 年全国生育节育抽样调查和全国计划生育 生殖健康调查数据 分析了已婚育龄人口在避孕模式上的 时空变化特征 在此基础上进一步研究了在已婚育龄人口的年龄 子女数和生活的不同区域环境等方 面避孕模式的时空变化 结果表明 在我国人口转变的过程中 低生育水平下的避孕模式以及推行避 孕节育知情选择后已婚育龄人口的避孕模式
图书在版编目 (CIP) 数据 文学与现代性批判 / 邵建著. 南京 : 江苏教育出版社, ISBN Ⅰ. 文... Ⅱ. 邵... Ⅲ. 当代文学 - 文学研究 - 中国 Ⅳ.I206.7 中国版本图书馆 CIP 数据核字 ( 2005 ) 第 04185
 图书在版编目 (CIP) 数据 文学与现代性批判 / 邵建著. 南京 : 江苏教育出版社, 2005.4 ISBN 7-5343-6528-7 Ⅰ. 文... Ⅱ. 邵... Ⅲ. 当代文学 - 文学研究 - 中国 Ⅳ.I206.7 中国版本图书馆 CIP 数据核字 ( 2005 ) 第 041850 号 出版者社址网址出版人 南京市马家街 31 号邮编 :210009 http://www.1088.com.cn
图书在版编目 (CIP) 数据 文学与现代性批判 / 邵建著. 南京 : 江苏教育出版社, 2005.4 ISBN 7-5343-6528-7 Ⅰ. 文... Ⅱ. 邵... Ⅲ. 当代文学 - 文学研究 - 中国 Ⅳ.I206.7 中国版本图书馆 CIP 数据核字 ( 2005 ) 第 041850 号 出版者社址网址出版人 南京市马家街 31 号邮编 :210009 http://www.1088.com.cn
 第一章 图 1 1 传染病的特征 9 T h1 T h2 细胞调节机制简图 正调节 负调节 细胞因子与细菌的相互作用机制目前尚未完全明了 有实验表明 细胞因子与细菌之间 存在有互利和互抑双重效应 例如 T N Fα 和 IFNγ 可抑制放线菌的生长而 IL 6 的作用则 反之 IL 1 2 和 GM CSF 可促进某些致病性大肠杆菌生长而 IL 1ra 可抑制之 研究表 明 某些致病性大肠杆菌有与
第一章 图 1 1 传染病的特征 9 T h1 T h2 细胞调节机制简图 正调节 负调节 细胞因子与细菌的相互作用机制目前尚未完全明了 有实验表明 细胞因子与细菌之间 存在有互利和互抑双重效应 例如 T N Fα 和 IFNγ 可抑制放线菌的生长而 IL 6 的作用则 反之 IL 1 2 和 GM CSF 可促进某些致病性大肠杆菌生长而 IL 1ra 可抑制之 研究表 明 某些致病性大肠杆菌有与
<4D6963726F736F667420576F7264202D20CFB8B0FBC5E0D1F8BCBCCAF5B3A3BCFBCECACCE2BDE2B4F02D66726F6DCDF8C2E7>
 细 胞 培 养 技 术 常 见 问 题 解 答 一 细 胞 培 养 基 础 问 答 1.BHK 细 胞 就 是 指 BHK21 吗? 答 :BHK 细 胞 是 指 幼 年 叙 利 亚 地 鼠 肾 细 胞 (Baby Hamster Syrian Kidney),1961 年 建 株 原 始 的 细 胞 株 是 成 纤 维 细 胞, 贴 壁 依 赖 性 1963 年 获 得 单 细 胞 克 隆 细 胞
细 胞 培 养 技 术 常 见 问 题 解 答 一 细 胞 培 养 基 础 问 答 1.BHK 细 胞 就 是 指 BHK21 吗? 答 :BHK 细 胞 是 指 幼 年 叙 利 亚 地 鼠 肾 细 胞 (Baby Hamster Syrian Kidney),1961 年 建 株 原 始 的 细 胞 株 是 成 纤 维 细 胞, 贴 壁 依 赖 性 1963 年 获 得 单 细 胞 克 隆 细 胞
( CIP) /. :, 2003 ISBN 7 81010 776 3.......... R24 65 CIP ( 2003) 102280 ( 2 ) 1200 ( 201203) 850 mm 1168 mm 1 /16 30. 5 881 5 301 10 400 2003 12 2 20
 2 ) ( CIP) /. :, 2003 ISBN 7 81010 776 3.......... R24 65 CIP ( 2003) 102280 ( 2 ) 1200 ( 201203) 850 mm 1168 mm 1 /16 30. 5 881 5 301 10 400 2003 12 2 2003 12 3 ISBN 7 81010 776 3 / R 739 64. 00 ( ) )
2 ) ( CIP) /. :, 2003 ISBN 7 81010 776 3.......... R24 65 CIP ( 2003) 102280 ( 2 ) 1200 ( 201203) 850 mm 1168 mm 1 /16 30. 5 881 5 301 10 400 2003 12 2 2003 12 3 ISBN 7 81010 776 3 / R 739 64. 00 ( ) )
1 2 / 3 1 A (2-1) (2-2) A4 6 A4 7 A4 8 A4 9 A ( () 4 A4, A4 7 ) 1 (2-1) (2-2) ()
 (39mm E-Mail ( )( ), : : 1 1 ( ) 2 2 ( ) 29mm) WSK ( 1 2 / 3 1 A4 2 1 3 (2-1) 2-1 4 (2-2) 2-2 5 A4 6 A4 7 A4 8 A4 9 A4 10 11 ( () 4 A4, 5 6 7 8 A4 7 ) 1 (2-1) (2-2) () 1 2 (2-1) 3 (2-2) 4 5 6 7 (8 ) 9
(39mm E-Mail ( )( ), : : 1 1 ( ) 2 2 ( ) 29mm) WSK ( 1 2 / 3 1 A4 2 1 3 (2-1) 2-1 4 (2-2) 2-2 5 A4 6 A4 7 A4 8 A4 9 A4 10 11 ( () 4 A4, 5 6 7 8 A4 7 ) 1 (2-1) (2-2) () 1 2 (2-1) 3 (2-2) 4 5 6 7 (8 ) 9
去 中 和 ; [3] 消 化 最 好 在 37 培 养 箱 或 室 温 25 以 上 的 环 境 下 进 行 消 化, 消 化 2--5 min 后, 把 培 养 瓶 放 在 显 微 镜 下 观 察, 发 现 胞 质 回 缩 细 胞 间 隙 增 大, 细 胞 变 圆 后, 立 即 将 培 养 瓶
![去 中 和 ; [3] 消 化 最 好 在 37 培 养 箱 或 室 温 25 以 上 的 环 境 下 进 行 消 化, 消 化 2--5 min 后, 把 培 养 瓶 放 在 显 微 镜 下 观 察, 发 现 胞 质 回 缩 细 胞 间 隙 增 大, 细 胞 变 圆 后, 立 即 将 培 养 瓶 去 中 和 ; [3] 消 化 最 好 在 37 培 养 箱 或 室 温 25 以 上 的 环 境 下 进 行 消 化, 消 化 2--5 min 后, 把 培 养 瓶 放 在 显 微 镜 下 观 察, 发 现 胞 质 回 缩 细 胞 间 隙 增 大, 细 胞 变 圆 后, 立 即 将 培 养 瓶](/thumbs/42/23090277.jpg) 第 一 节 细 胞 培 养 的 相 关 技 术 1 细 胞 的 复 苏 概 述 复 苏 细 胞 要 求 快 速 融 化 的 手 段, 这 样 可 以 保 证 细 胞 外 结 晶 在 很 短 的 时 间 内 即 融 化 避 免 由 于 缓 慢 融 化 使 水 分 渗 入 细 胞 内 形 成 胞 内 再 结 晶 对 细 胞 造 成 损 害 用 品 培 养 液 吸 管 离 心 管 培 养 瓶 步 骤 [1]
第 一 节 细 胞 培 养 的 相 关 技 术 1 细 胞 的 复 苏 概 述 复 苏 细 胞 要 求 快 速 融 化 的 手 段, 这 样 可 以 保 证 细 胞 外 结 晶 在 很 短 的 时 间 内 即 融 化 避 免 由 于 缓 慢 融 化 使 水 分 渗 入 细 胞 内 形 成 胞 内 再 结 晶 对 细 胞 造 成 损 害 用 品 培 养 液 吸 管 离 心 管 培 养 瓶 步 骤 [1]
军事十万个为什么 军事约章
 (CIP) /,.- :,2002.7 ( ) ISBN7-80641-489-4 Ⅰ. Ⅱ.1 2 Ⅲ.1 - - 2 - - 3 - - Ⅳ.1E163-492D995-49 CIP (2001)077241 : ( : 66 :0371 5751257 :450002) : : :890mm 1240mm A5 :11.5 :1 :254 :1-3000 :20027 1 :20027 1 :ISBN7-80641-489-4/E
(CIP) /,.- :,2002.7 ( ) ISBN7-80641-489-4 Ⅰ. Ⅱ.1 2 Ⅲ.1 - - 2 - - 3 - - Ⅳ.1E163-492D995-49 CIP (2001)077241 : ( : 66 :0371 5751257 :450002) : : :890mm 1240mm A5 :11.5 :1 :254 :1-3000 :20027 1 :20027 1 :ISBN7-80641-489-4/E
 高 云 钟良军 张源明 周晓欢 梁 平 徐 隽 探讨兔牙周炎对动脉粥样硬化炎性因子的影响及抗生素对其的作用 将 只雄性新西兰大白兔随机分为 组 组为对照组 组为牙周炎组 组为动脉粥样硬化组 组为牙周炎 动脉粥样硬化组 组为干预组 牙周炎 动脉粥样硬化 替硝唑组 各组分别按照实验设计进行相应干预处理 周末处死动物 检测牙周指标 血清中总胆固醇 三酰甘油 高密度脂蛋白胆固醇 低密度脂蛋白胆固醇 反应蛋白
高 云 钟良军 张源明 周晓欢 梁 平 徐 隽 探讨兔牙周炎对动脉粥样硬化炎性因子的影响及抗生素对其的作用 将 只雄性新西兰大白兔随机分为 组 组为对照组 组为牙周炎组 组为动脉粥样硬化组 组为牙周炎 动脉粥样硬化组 组为干预组 牙周炎 动脉粥样硬化 替硝唑组 各组分别按照实验设计进行相应干预处理 周末处死动物 检测牙周指标 血清中总胆固醇 三酰甘油 高密度脂蛋白胆固醇 低密度脂蛋白胆固醇 反应蛋白
 第四章 102 图 4唱16 基于图像渲染的理论基础 三张拍摄图像以及它们投影到球面上生成的球面图像 拼图的圆心是相同的 而拼图是由球面图像上的弧线图像组成的 因此我 们称之为同心球拼图 如图 4唱18 所示 这些拼图中半径最大的是圆 Ck 最小的是圆 C0 设圆 Ck 的半径为 r 虚拟相机水平视域为 θ 有 r R sin θ 2 4畅11 由此可见 构造同心球拼图的过程实际上就是对投影图像中的弧线图像
第四章 102 图 4唱16 基于图像渲染的理论基础 三张拍摄图像以及它们投影到球面上生成的球面图像 拼图的圆心是相同的 而拼图是由球面图像上的弧线图像组成的 因此我 们称之为同心球拼图 如图 4唱18 所示 这些拼图中半径最大的是圆 Ck 最小的是圆 C0 设圆 Ck 的半径为 r 虚拟相机水平视域为 θ 有 r R sin θ 2 4畅11 由此可见 构造同心球拼图的过程实际上就是对投影图像中的弧线图像
( CIP) /,. :, 2004 ISBN K828.2 CI P ( 2004 ) ( ) : : :890mm 1240mm 1/ 32 : 5.5 : 16 :
 ( CIP) /,. :, 2004 ISBN 7-313 - 03771-6............. K828.2 CI P ( 2004 ) 057767 ( 877 200030 ) : 64071208 : :890mm 1240mm 1/ 32 : 5.5 : 16 :157 2004 6 1 2004 6 1 :1-20 000 ISBN7-313 - 03771-6/ K 021 :15.00
( CIP) /,. :, 2004 ISBN 7-313 - 03771-6............. K828.2 CI P ( 2004 ) 057767 ( 877 200030 ) : 64071208 : :890mm 1240mm 1/ 32 : 5.5 : 16 :157 2004 6 1 2004 6 1 :1-20 000 ISBN7-313 - 03771-6/ K 021 :15.00
4 / ( / / 5 / / ( / 6 ( / / 7 1 2 / 3 ( 4 ( 2003 8 ( 2
 : / ( 6 (2003 8 : ( 1 ( ( / / (,, ( ( - ( - (39mm 29mm 2 ( 1 2 3-6 3 6-24 6-48 12-24 8-12 WSK / WSK WSK 1 4 / ( / / 5 / / ( / 6 ( / / 7 1 2 / 3 ( 4 ( 2003 8 ( 2 9 5 ( 10 3 11 / (600 4 5 AA 710 AB 720 730
: / ( 6 (2003 8 : ( 1 ( ( / / (,, ( ( - ( - (39mm 29mm 2 ( 1 2 3-6 3 6-24 6-48 12-24 8-12 WSK / WSK WSK 1 4 / ( / / 5 / / ( / 6 ( / / 7 1 2 / 3 ( 4 ( 2003 8 ( 2 9 5 ( 10 3 11 / (600 4 5 AA 710 AB 720 730
Really Good Antibodies Bethyl 二抗产品册 超过 670 种抗小鼠 兔子 山羊和大鼠的二抗 bethyl.com
 Really Good Antibodies Bethyl 二抗产品册 超过 670 种抗小鼠 兔子 山羊和大鼠的二抗 bethyl.com Bethyl 公司 Bethyl Laboratories, Inc. ) 成立于1972年 一直秉承改善生活的理念致力于科学研究的理念 提供高质量的抗体产品 和抗体定制服务 Bethyl所销售的每一个抗体都是在德克萨斯州的蒙哥马利的唯一工厂生产 并且都经过Bethyl
Really Good Antibodies Bethyl 二抗产品册 超过 670 种抗小鼠 兔子 山羊和大鼠的二抗 bethyl.com Bethyl 公司 Bethyl Laboratories, Inc. ) 成立于1972年 一直秉承改善生活的理念致力于科学研究的理念 提供高质量的抗体产品 和抗体定制服务 Bethyl所销售的每一个抗体都是在德克萨斯州的蒙哥马利的唯一工厂生产 并且都经过Bethyl
PowerPoint Presentation
 规 模 化 猪 场 种 公 猪 健 康 养 殖 及 人 工 授 精 技 术 安 徽 科 技 学 院 闻 爱 友 重 要 性 认 识!! 种 猪 是 猪 场 生 产 的 命 脉 母 猪 好 好 一 窝, 公 猪 好 好 一 坡 重 要 性 认 识!! 种 公 猪 质 量 直 接 关 系 到 猪 场 生 产 效 益 种 猪 的 健 康 是 猪 群 健 康 的 源 头 加 强 种 公 猪 饲 养 管 理,
规 模 化 猪 场 种 公 猪 健 康 养 殖 及 人 工 授 精 技 术 安 徽 科 技 学 院 闻 爱 友 重 要 性 认 识!! 种 猪 是 猪 场 生 产 的 命 脉 母 猪 好 好 一 窝, 公 猪 好 好 一 坡 重 要 性 认 识!! 种 公 猪 质 量 直 接 关 系 到 猪 场 生 产 效 益 种 猪 的 健 康 是 猪 群 健 康 的 源 头 加 强 种 公 猪 饲 养 管 理,
军事十万个为什么 兵书集粹
 (CIP) /.- : 2002.7 ( ) ISBN7-80641-482-7 Ⅰ. Ⅱ.1 2 Ⅲ. - - Ⅳ.E89 CIP (2001)077248 : ( : 66 :0371 5751257 :450002) : : :890mm 1240mm A5 :12.25 :1 :278 :20027 1 :1-3000 :20027 1 :ISBN7-80641-482-7/E 017 :22.00
(CIP) /.- : 2002.7 ( ) ISBN7-80641-482-7 Ⅰ. Ⅱ.1 2 Ⅲ. - - Ⅳ.E89 CIP (2001)077248 : ( : 66 :0371 5751257 :450002) : : :890mm 1240mm A5 :12.25 :1 :278 :20027 1 :1-3000 :20027 1 :ISBN7-80641-482-7/E 017 :22.00
國民健康狀況是分配醫療資源及訂定全國健康目標之主要依據,更是衡量一個國家發展概況的重要指標之一
 89 5 1 212 312 412~19 520~65 1 30 CDC, 1998 1957 1994 89 1 2 3 1994 3,814 15,000 1995 1989 4,049 60 1997 2 1980 1998 1956 2000 2000 3 (computer-assisted telephone interviewing, CATI) (computer-assisted
89 5 1 212 312 412~19 520~65 1 30 CDC, 1998 1957 1994 89 1 2 3 1994 3,814 15,000 1995 1989 4,049 60 1997 2 1980 1998 1956 2000 2000 3 (computer-assisted telephone interviewing, CATI) (computer-assisted
新英格兰杂志封面
 Avian Influenza A (H5N1) Infection in Humans The Writing Committee of the World Health Organization (WHO) Consultation on Human Influenza A/H5 The writing committee consisted of the following: John H.
Avian Influenza A (H5N1) Infection in Humans The Writing Committee of the World Health Organization (WHO) Consultation on Human Influenza A/H5 The writing committee consisted of the following: John H.
 劳动保护与医疗保健 第 二 章 止标志共 23 个 劳 动 安 全 技 术 22 2 警告标志 由于三角形引人注目 故用作 警告 标志 警告人们注意可能发生的多种危险 三角的背景使用黄色 三角图形和三角内的图像均用黑色描 绘 黄色是有警告含义的颜色 在对比色黑色的衬托下 绘成的 警告标志 就更引人注目 3 指令标志 在圆形内配上指令含义的颜色 蓝 色 并用白色绘制必须执行的图形符号 构成 指令标志
劳动保护与医疗保健 第 二 章 止标志共 23 个 劳 动 安 全 技 术 22 2 警告标志 由于三角形引人注目 故用作 警告 标志 警告人们注意可能发生的多种危险 三角的背景使用黄色 三角图形和三角内的图像均用黑色描 绘 黄色是有警告含义的颜色 在对比色黑色的衬托下 绘成的 警告标志 就更引人注目 3 指令标志 在圆形内配上指令含义的颜色 蓝 色 并用白色绘制必须执行的图形符号 构成 指令标志
 ! " # $ % CIP. / 2006. 6 ISBN 7-80664 - 222-6 Ⅰ.... Ⅱ.... Ⅲ. - - Ⅳ. G624. 246 CIP 2006 049794 0431-8563443 0431-8561180 0431-8561177 1377 130061 www. cccbs. net 880 1230 32 310 11. 125 2006 7 1 2006 7
! " # $ % CIP. / 2006. 6 ISBN 7-80664 - 222-6 Ⅰ.... Ⅱ.... Ⅲ. - - Ⅳ. G624. 246 CIP 2006 049794 0431-8563443 0431-8561180 0431-8561177 1377 130061 www. cccbs. net 880 1230 32 310 11. 125 2006 7 1 2006 7
untitled
 图书在版编目 (CIP) 数据 家居美化中的巧 / 陈赞等编著. 北京 : 中国林业出版社,2003.4 ISBN 7-5038-3399-8 I. 家 II. 陈 III. 住宅 室内装饰 基本知识 IV.TU241 中国版本图书馆 CIP 数据核字 (2003) 第 022376 号 版权所有翻印必究 1 2002.10 1 ...1...1...2...2...3...4...5...6...7...8...8...10...10...11...12...12...13...13...15...15...16...17...18...19...20...20...20...21...22
图书在版编目 (CIP) 数据 家居美化中的巧 / 陈赞等编著. 北京 : 中国林业出版社,2003.4 ISBN 7-5038-3399-8 I. 家 II. 陈 III. 住宅 室内装饰 基本知识 IV.TU241 中国版本图书馆 CIP 数据核字 (2003) 第 022376 号 版权所有翻印必究 1 2002.10 1 ...1...1...2...2...3...4...5...6...7...8...8...10...10...11...12...12...13...13...15...15...16...17...18...19...20...20...20...21...22
結婚多年,一直都沒有消息-不孕症(Infertility)
 結 婚 多 年, 一 直 都 沒 有 消 息 - 不 孕 症 (20) What is infertility 所 謂 不 孕 症 (Infertility) 是 指 一 對 夫 婦, 他 們 結 婚 ( 也 有 些 未 結 婚 者 ) 一 年 內, 有 正 常 之 性 行 為, 也 就 是 有 做 人 之 動 作. 如 固 定 每 週 內 有 2~3 次 性 交, 且 每 次 性 交 先 生 陰
結 婚 多 年, 一 直 都 沒 有 消 息 - 不 孕 症 (20) What is infertility 所 謂 不 孕 症 (Infertility) 是 指 一 對 夫 婦, 他 們 結 婚 ( 也 有 些 未 結 婚 者 ) 一 年 內, 有 正 常 之 性 行 為, 也 就 是 有 做 人 之 動 作. 如 固 定 每 週 內 有 2~3 次 性 交, 且 每 次 性 交 先 生 陰
安全注意事项 2. 设置对焦模式 3. 变焦 1. 安装和卸下镜头 4. 固定变焦环 1 2 CHI-2
 CHI EF 镜头使用说明书 EF24-70mm f/4l IS USM 感谢您购买佳能产品! 使用注意事项 如果将镜头从寒冷的环境拿到温暖的环境中, 镜头表面和内部零件可能会发生结露 高温可能导致镜头故障 特点 安全注意事项 安全注意事项 请勿透过镜头或相机观看太阳或明亮的光源 无论镜头是否装在相机上, 请勿将没有盖上镜头盖的镜头置于太阳下 本说明中使用的符号 CHI-1 安全注意事项 2. 设置对焦模式
CHI EF 镜头使用说明书 EF24-70mm f/4l IS USM 感谢您购买佳能产品! 使用注意事项 如果将镜头从寒冷的环境拿到温暖的环境中, 镜头表面和内部零件可能会发生结露 高温可能导致镜头故障 特点 安全注意事项 安全注意事项 请勿透过镜头或相机观看太阳或明亮的光源 无论镜头是否装在相机上, 请勿将没有盖上镜头盖的镜头置于太阳下 本说明中使用的符号 CHI-1 安全注意事项 2. 设置对焦模式
Chin J Blood Transfusion Nov 2013 Vol. 26 No LIMS electronic issue EI and Healthcare Products Regulatory Agency MHRA 2. 1
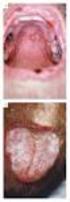 2013 11 26 11 Chin J Blood Transfusion Nov 2013 Vol. 26 No. 11 郭永建 1161 BCSH 英国血液学标准委员会 2012 年 赵国华赵维齐 100021 BCSH R457. 1 A 1004-549X 2013 11-1161-12 British Committee for Standards in Haematology BCSH
2013 11 26 11 Chin J Blood Transfusion Nov 2013 Vol. 26 No. 11 郭永建 1161 BCSH 英国血液学标准委员会 2012 年 赵国华赵维齐 100021 BCSH R457. 1 A 1004-549X 2013 11-1161-12 British Committee for Standards in Haematology BCSH
材料导报 研究篇 年 月 下 第 卷第 期 种球的制备 单步溶胀法制备分子印迹聚合物微球 洗脱处理 种子溶胀聚合机理 种球用量的影响
 水相中 组氨酸单分散分子印迹聚合物微球的合成 表征及其识别性能研究 李思平等 李思平 徐伟箭 较佳工艺条件下 在水性体系中选用无皂乳液聚合法制得的单分散微米级聚苯乙烯微球为种球 分别以组氨酸 甲基丙烯酸 或丙烯酸胺 乙二醇二甲基丙烯酸酯 为模板分子 功能单体和交联剂 合成了 组氨酸分子印迹聚合物微球 研究了形貌 粒径及其分布以及模板分子与功能单体之间的相互作用 分别以 激光粒度分析仪紫外分光光度法和红外光谱表征功能单体与交联剂之间的共聚情况
水相中 组氨酸单分散分子印迹聚合物微球的合成 表征及其识别性能研究 李思平等 李思平 徐伟箭 较佳工艺条件下 在水性体系中选用无皂乳液聚合法制得的单分散微米级聚苯乙烯微球为种球 分别以组氨酸 甲基丙烯酸 或丙烯酸胺 乙二醇二甲基丙烯酸酯 为模板分子 功能单体和交联剂 合成了 组氨酸分子印迹聚合物微球 研究了形貌 粒径及其分布以及模板分子与功能单体之间的相互作用 分别以 激光粒度分析仪紫外分光光度法和红外光谱表征功能单体与交联剂之间的共聚情况
 流式细胞术临床应用的建议 作者 : 中华医学会检验医学分会, 卫生部临床检验中心, 中华检验医学杂志编辑委员会 作者单位 : 刊名 : 中华检验医学杂志 英文刊名 : Chinese Journal of Laboratory Medicine 年, 卷 ( 期 ): 2013,36(12) 本文链接 :http://d.g.wanfangdata.com.cn/periodical_zhyxjy201312003.aspx
流式细胞术临床应用的建议 作者 : 中华医学会检验医学分会, 卫生部临床检验中心, 中华检验医学杂志编辑委员会 作者单位 : 刊名 : 中华检验医学杂志 英文刊名 : Chinese Journal of Laboratory Medicine 年, 卷 ( 期 ): 2013,36(12) 本文链接 :http://d.g.wanfangdata.com.cn/periodical_zhyxjy201312003.aspx
33 5 Vol.33,No JournalofHebeiUniversityofScienceandTechnology Oct.2012 : (2012) /,, ( 河北科技大学机械工程学院, 河北石家庄 ) : 利用计算流体
 33 5 Vol.33,No.5 2012 10 JournalofHebeiUniversityofScienceandTechnology Oct.2012 :1008-1542(2012)05-0453-06 /,, ( 河北科技大学机械工程学院, 河北石家庄 050018) : 利用计算流体力学软件 FLUENT 的凝固 / 熔化模型, 对双层壁圆筒内填充的铝硅合金相变材料的熔化 / 凝固过程进行了数值模拟,
33 5 Vol.33,No.5 2012 10 JournalofHebeiUniversityofScienceandTechnology Oct.2012 :1008-1542(2012)05-0453-06 /,, ( 河北科技大学机械工程学院, 河北石家庄 050018) : 利用计算流体力学软件 FLUENT 的凝固 / 熔化模型, 对双层壁圆筒内填充的铝硅合金相变材料的熔化 / 凝固过程进行了数值模拟,
FJXBQ
 高等医学院校选用教材 ( 供成人教育中医药专业 中西医结合专业使用 ) 方剂学 闫润红 主编 2 0 0 1 内容简介本书是供成人教育中医药专业 中西医结合专业使用的教材 全书分总论和各论两部分, 总论部分对中医方剂的基本理论, 如治法 君臣佐使 剂型 剂量等及其现代研究进展进行了介绍 各论部分对常用方剂的主治病证 配伍意义 临床应用 加减变化规律及现代研究概况等内容, 按分类进行了系统阐述 在保证方剂学学科知识结构完整性的前提下,
高等医学院校选用教材 ( 供成人教育中医药专业 中西医结合专业使用 ) 方剂学 闫润红 主编 2 0 0 1 内容简介本书是供成人教育中医药专业 中西医结合专业使用的教材 全书分总论和各论两部分, 总论部分对中医方剂的基本理论, 如治法 君臣佐使 剂型 剂量等及其现代研究进展进行了介绍 各论部分对常用方剂的主治病证 配伍意义 临床应用 加减变化规律及现代研究概况等内容, 按分类进行了系统阐述 在保证方剂学学科知识结构完整性的前提下,
尊 敬 的 客 户 : 欢 迎 您 ( 指 被 保 险 人, 以 下 简 称 您 ) 加 入 中 美 联 泰 大 都 会 人 寿 保 险 有 限 公 司 ( 以 下 简 称 大 都 会 人 寿 )MetHealth 360 健 康 呵 护 管 理 服 务 计 划 MetHealth 360 健 康
 MetHealth 360 健 康 呵 护 管 理 服 务 计 划 服 务 手 册 目 录 服 务 说 明 3 服 务 有 效 期 4 服 务 时 间 4 服 务 热 线 4 健 康 一 点 通 服 务 流 程 5 二 次 诊 疗 咨 询 服 务 流 程 6 客 户 权 益 7 客 户 义 务 7 客 户 隐 私 保 护 条 款 7 免 责 条 款 7 内 容 所 有 权.8 注 意 事 项 8 附
MetHealth 360 健 康 呵 护 管 理 服 务 计 划 服 务 手 册 目 录 服 务 说 明 3 服 务 有 效 期 4 服 务 时 间 4 服 务 热 线 4 健 康 一 点 通 服 务 流 程 5 二 次 诊 疗 咨 询 服 务 流 程 6 客 户 权 益 7 客 户 义 务 7 客 户 隐 私 保 护 条 款 7 免 责 条 款 7 内 容 所 有 权.8 注 意 事 项 8 附
煤 炭 学 报 仪器与药品 黏土矿物的提纯 黏土样品的制备 红外光谱 分析 射线衍射 分析 射线光电子能谱 分析
 张明青 刘炯天 单爱琴 刘汉湖 为了深刻认识煤泥水中 同黏土矿物颗粒之间的相互作用 笔者用 溶液在不同 值条件下分别同高岭土和蒙脱土作用 测定黏土作用前后的 射线衍射 红外光谱和 射线光电子能谱 实验证实了在 溶液中 在黏土表面以静电形式吸附 在 溶液中 以 沉淀和静电形式吸附 此外 在 以上的溶液中还可能存在一 羟基络合吸附形式 提出了 沉淀吸附和一羟基络合吸附的吸附过程模式 黏土颗粒表面的 沉淀使颗粒间形成的非选择性
张明青 刘炯天 单爱琴 刘汉湖 为了深刻认识煤泥水中 同黏土矿物颗粒之间的相互作用 笔者用 溶液在不同 值条件下分别同高岭土和蒙脱土作用 测定黏土作用前后的 射线衍射 红外光谱和 射线光电子能谱 实验证实了在 溶液中 在黏土表面以静电形式吸附 在 溶液中 以 沉淀和静电形式吸附 此外 在 以上的溶液中还可能存在一 羟基络合吸附形式 提出了 沉淀吸附和一羟基络合吸附的吸附过程模式 黏土颗粒表面的 沉淀使颗粒间形成的非选择性
IDEO_HCD_0716
 IDEO HCD Toolkit Tencent CDC ...? Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC
IDEO HCD Toolkit Tencent CDC ...? Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC Tencent CDC
-2- katugomi2014_c.indd katugomi2015_c :55:18 PM
 5-1- katugomi2015_c 1 -2- katugomi2014_c.indd katugomi2015_c 2 2 14.3.3 1:55:18 PM -3- katugomi2014_c.indd katugomi2015_c 3 3 14.3.3 1:55:19 PM 塑料容器包装 塑料标识的收集日 每周一次 星期 所谓 塑料制容器包装 ( 塑料标识 ) 厖 指的是装入或包裹商品并附有
5-1- katugomi2015_c 1 -2- katugomi2014_c.indd katugomi2015_c 2 2 14.3.3 1:55:18 PM -3- katugomi2014_c.indd katugomi2015_c 3 3 14.3.3 1:55:19 PM 塑料容器包装 塑料标识的收集日 每周一次 星期 所谓 塑料制容器包装 ( 塑料标识 ) 厖 指的是装入或包裹商品并附有
 Protocol 1. 2. 3. 4. / ~ / 1. 2. 3. 1 Genetic modified organisms 1. 2. 3. 4. 5. 6. 7. / 2 / / Good Laboratory Practice, GLP / / / ~ / 1. 2. 3. 4. 5. 6. 3 1. 2. 3. 4. 5. 4 European Plant Protection Organization,
Protocol 1. 2. 3. 4. / ~ / 1. 2. 3. 1 Genetic modified organisms 1. 2. 3. 4. 5. 6. 7. / 2 / / Good Laboratory Practice, GLP / / / ~ / 1. 2. 3. 4. 5. 6. 3 1. 2. 3. 4. 5. 4 European Plant Protection Organization,
 . ,,,,,,,,,, 20 70,, : 1. ; 2. ( ) ; 3. ; 4. ( ) ; 5. ( ) ; 6. ; 7. ; 8. ; 9. ; 10. ; 11. ( ) ; 12. ( ) ; 13. ; 14. ; 15. ; 16. ; 17. ; 18. ; 19. ; 20. ; 21. ; 22. ; 23. ;,, 20 80,,,,,,,, 3 ,,,,,,, ;,
. ,,,,,,,,,, 20 70,, : 1. ; 2. ( ) ; 3. ; 4. ( ) ; 5. ( ) ; 6. ; 7. ; 8. ; 9. ; 10. ; 11. ( ) ; 12. ( ) ; 13. ; 14. ; 15. ; 16. ; 17. ; 18. ; 19. ; 20. ; 21. ; 22. ; 23. ;,, 20 80,,,,,,,, 3 ,,,,,,, ;,
Microsoft Word - KDIGO Transplant in Chinese 2010-2-15 _1_.doc
 KDIGO 临 床 实 践 指 南 : 肾 移 植 受 者 的 诊 治 执 行 概 要 American Journal of Transplantation 2009; 9 (Suppl 3): Siv Siv Bertram L. Kasiske, MD Hennepin County Medical Center Minneapolis, MN 工 作 组 共 同 主 席 Martin G.
KDIGO 临 床 实 践 指 南 : 肾 移 植 受 者 的 诊 治 执 行 概 要 American Journal of Transplantation 2009; 9 (Suppl 3): Siv Siv Bertram L. Kasiske, MD Hennepin County Medical Center Minneapolis, MN 工 作 组 共 同 主 席 Martin G.
 吉林大学学报 工学版 244 第 4 卷 复杂 鉴于本文篇幅所限 具体公式可详见参考文 献 7 每帧的动力学方程建立及其解算方法如图 3 所示 图4 滚转角速度与输入量 η 随时间的变化波形 Fig 4 Waveform of roll rate and input η with time changing 图5 Fig 5 滚转角随时间的变化波形 Waveform of roll angle with
吉林大学学报 工学版 244 第 4 卷 复杂 鉴于本文篇幅所限 具体公式可详见参考文 献 7 每帧的动力学方程建立及其解算方法如图 3 所示 图4 滚转角速度与输入量 η 随时间的变化波形 Fig 4 Waveform of roll rate and input η with time changing 图5 Fig 5 滚转角随时间的变化波形 Waveform of roll angle with
RW Salary Survey 2015 - China A4
 2015 中国 2014年 中国政府实施从纯制造业和基础设施行业向高科 技行业的转型 加强专业服务和消费者领域发展 以出口 刺激经济增长 由于政府的投资政策重新定位 我们看到越来越多的研发 中心在国内成立 更多国际专业服务公司进入中国市场 奢侈品及零售品牌进驻苏州 杭州 南京和成都等二线城 市 带动了当地市场的招聘需求 纵观总体经济 经济普遍增长 就业市场前景乐观 雇员 与雇主信心增强 2014年前三季度GDP增长率达7.4%
2015 中国 2014年 中国政府实施从纯制造业和基础设施行业向高科 技行业的转型 加强专业服务和消费者领域发展 以出口 刺激经济增长 由于政府的投资政策重新定位 我们看到越来越多的研发 中心在国内成立 更多国际专业服务公司进入中国市场 奢侈品及零售品牌进驻苏州 杭州 南京和成都等二线城 市 带动了当地市场的招聘需求 纵观总体经济 经济普遍增长 就业市场前景乐观 雇员 与雇主信心增强 2014年前三季度GDP增长率达7.4%
臨床實驗室生物安全指引
 臨 床 實 驗 室 生 物 安 全 指 引 2008 年 2 月 ( 修 訂 本 ) 香 港 特 別 行 政 區 衞 生 署 衞 生 防 護 中 心 公 共 衞 生 化 驗 服 務 處 衞 生 署 衞 生 防 護 中 心 公 共 衞 生 化 驗 服 務 處 第 1 頁 ( 共 16 頁 ) 目 錄 頁 碼 1. 範 圍 3 2. 安 全 組 織 4 3. 生 物 安 全 規 劃 5 3.1 培 訓
臨 床 實 驗 室 生 物 安 全 指 引 2008 年 2 月 ( 修 訂 本 ) 香 港 特 別 行 政 區 衞 生 署 衞 生 防 護 中 心 公 共 衞 生 化 驗 服 務 處 衞 生 署 衞 生 防 護 中 心 公 共 衞 生 化 驗 服 務 處 第 1 頁 ( 共 16 頁 ) 目 錄 頁 碼 1. 範 圍 3 2. 安 全 組 織 4 3. 生 物 安 全 規 劃 5 3.1 培 訓
<4D6963726F736F667420576F7264202D20312D3120D5D0B9C9CBB5C3F7CAE9A3A8C9EAB1A8B8E5A3A92E646F63>
 吉 林 省 西 点 药 业 科 技 发 展 股 份 有 限 公 司 Jilin Province Xidian Pharmaceutical SciTech Development Co., Ltd ( 吉 林 省 磐 石 经 济 开 发 区 ) 首 次 公 开 发 行 股 票 招 股 说 明 书 ( 申 报 稿 ) 保 荐 机 构 ( 主 承 销 商 ) ( 北 京 市 西 城 区 金 融 大 街
吉 林 省 西 点 药 业 科 技 发 展 股 份 有 限 公 司 Jilin Province Xidian Pharmaceutical SciTech Development Co., Ltd ( 吉 林 省 磐 石 经 济 开 发 区 ) 首 次 公 开 发 行 股 票 招 股 说 明 书 ( 申 报 稿 ) 保 荐 机 构 ( 主 承 销 商 ) ( 北 京 市 西 城 区 金 融 大 街
2002 2013 Vitrolife Sweden AB 版 权 所 有 本 操 作 指 南 的 复 印 件 仅 供 内 部 使 用, 不 得 出 版 Vitrolife 标 识 是 Vitrolife Sweden AB 的 商 标 已 在 欧 洲 美 国 和 其 他 国 家 注 册 Vitro
 G-SERIES 操 作 指 南 David K. Gardner 教 授 权 威 推 荐 的 G-Series 产 品 使 用 方 法 2013 年 1 月 第 7 版 2002 2013 Vitrolife Sweden AB 版 权 所 有 本 操 作 指 南 的 复 印 件 仅 供 内 部 使 用, 不 得 出 版 Vitrolife 标 识 是 Vitrolife Sweden AB 的
G-SERIES 操 作 指 南 David K. Gardner 教 授 权 威 推 荐 的 G-Series 产 品 使 用 方 法 2013 年 1 月 第 7 版 2002 2013 Vitrolife Sweden AB 版 权 所 有 本 操 作 指 南 的 复 印 件 仅 供 内 部 使 用, 不 得 出 版 Vitrolife 标 识 是 Vitrolife Sweden AB 的
 李俊新 崔 敏 刘艳春 姚艳君 周广芬 孙 宝 河北科技大学理学院 河北石家庄 滦南县职业教育中心基础部 河北滦南 在物理化学实验的基础上 对一级反应的 种不同数据处理模型进行比较和分析 通过对 实验数据处理模型进行系统的比较 来改善传统实验数据处理中存在的一些问题 从而简化数据处 理 减小作图工作量与作图误差 提升实验水平 提高数据处理结果的准确性 一级反应 数据处理模型 过氧化氢 图 过氧化氢分解实验装置图
李俊新 崔 敏 刘艳春 姚艳君 周广芬 孙 宝 河北科技大学理学院 河北石家庄 滦南县职业教育中心基础部 河北滦南 在物理化学实验的基础上 对一级反应的 种不同数据处理模型进行比较和分析 通过对 实验数据处理模型进行系统的比较 来改善传统实验数据处理中存在的一些问题 从而简化数据处 理 减小作图工作量与作图误差 提升实验水平 提高数据处理结果的准确性 一级反应 数据处理模型 过氧化氢 图 过氧化氢分解实验装置图
乙型肝炎”两对半“及病毒核酸、抗-HCV检测的应用
 乙 型 肝 炎 两 对 半 及 病 毒 核 酸 抗 -HCV 检 测 的 应 用 李 金 明 卫 生 部 临 床 检 验 中 心 锦 州 2011.3.23 亚 洲 是 乙 肝 病 毒 肆 虐 的 重 灾 区, 全 球 2/3 以 上 的 慢 性 乙 肝 患 者 生 活 在 亚 洲 而 根 据 1992 年 全 国 乙 肝 血 清 流 行 病 学 调 查 的 结 果, 中 国 的 乙 肝 病 毒
乙 型 肝 炎 两 对 半 及 病 毒 核 酸 抗 -HCV 检 测 的 应 用 李 金 明 卫 生 部 临 床 检 验 中 心 锦 州 2011.3.23 亚 洲 是 乙 肝 病 毒 肆 虐 的 重 灾 区, 全 球 2/3 以 上 的 慢 性 乙 肝 患 者 生 活 在 亚 洲 而 根 据 1992 年 全 国 乙 肝 血 清 流 行 病 学 调 查 的 结 果, 中 国 的 乙 肝 病 毒
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 40 94 88 82 77 72 67 62 57 53 48 44 40 37 33 29 26 23 20 17 14 11 8 39 94 88 82 77 71 66 61 57 52 48 44 40 36 32 28 25 22 18 15 12 9 7 38 94 88
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 40 94 88 82 77 72 67 62 57 53 48 44 40 37 33 29 26 23 20 17 14 11 8 39 94 88 82 77 71 66 61 57 52 48 44 40 36 32 28 25 22 18 15 12 9 7 38 94 88
Microsoft Word - 前頁(總).doc
 骨 有 明 訊 肌 動 蛋 白 絲 與 細 胞 形 態 關 係 之 研 究 科 別 : 生 物 科 第 48 屆 科 學 展 覽 北 二 區 佳 作 作 者 : 呂 苹 瑋 范 競 勻 指 導 老 師 : 陳 季 瑄 老 師 壹 摘 要 本 研 究 以 人 類 的 子 宮 頸 癌 細 胞 (HeLa cell) 為 細 胞 骨 架 的 觀 察 對 象, 經 過 培 養 與 繼 代, 利 用 免 疫
骨 有 明 訊 肌 動 蛋 白 絲 與 細 胞 形 態 關 係 之 研 究 科 別 : 生 物 科 第 48 屆 科 學 展 覽 北 二 區 佳 作 作 者 : 呂 苹 瑋 范 競 勻 指 導 老 師 : 陳 季 瑄 老 師 壹 摘 要 本 研 究 以 人 類 的 子 宮 頸 癌 細 胞 (HeLa cell) 為 細 胞 骨 架 的 觀 察 對 象, 經 過 培 養 與 繼 代, 利 用 免 疫
Microsoft Word - Z8I11A0-102.doc
 自 然 考 科 學 測 試 題 關 鍵 解 析 前 言 物 理 科 今 年 自 然 科 考 題 共 68 題, 其 中 物 理 科 占 了 17 題, 今 年 的 題 目 難 度 屬 中 偏 易, 考 題 分 配 十 分 平 均 由 於 是 新 課 綱 第 一 次 學 測, 所 以 新 的 內 容 大 致 上 均 入 題, 大 都 為 物 理 科 普 知 識 就 算 是 第 二 部 分 的 考 題,
自 然 考 科 學 測 試 題 關 鍵 解 析 前 言 物 理 科 今 年 自 然 科 考 題 共 68 題, 其 中 物 理 科 占 了 17 題, 今 年 的 題 目 難 度 屬 中 偏 易, 考 題 分 配 十 分 平 均 由 於 是 新 課 綱 第 一 次 學 測, 所 以 新 的 內 容 大 致 上 均 入 題, 大 都 為 物 理 科 普 知 識 就 算 是 第 二 部 分 的 考 題,
第 期 甘金华等 强力霉素人工抗原的合成与抗体制备 材料与方法 试剂及溶液
 第 卷第 期 年 月 食品与生物技术学报 强力霉素人工抗原的合成与抗体制备 甘金华 邓薇 李进平 艾晓辉 中国水产科学研究院长江水产研究所 湖北荆州 武汉纺织大学环境与城建学院 湖北武汉 采用改进的碳二亚胺两步法将强力霉素半抗原与载体蛋白 连接制备强力霉素 牛血清白蛋白 人工免疫抗原 并用同样方法将强力霉素与载体蛋白 连接制备人强力霉素 卵清白蛋白 人工包被抗原 经紫外扫描分析和动物免疫试验证实 强力霉素人工抗原合成成功
第 卷第 期 年 月 食品与生物技术学报 强力霉素人工抗原的合成与抗体制备 甘金华 邓薇 李进平 艾晓辉 中国水产科学研究院长江水产研究所 湖北荆州 武汉纺织大学环境与城建学院 湖北武汉 采用改进的碳二亚胺两步法将强力霉素半抗原与载体蛋白 连接制备强力霉素 牛血清白蛋白 人工免疫抗原 并用同样方法将强力霉素与载体蛋白 连接制备人强力霉素 卵清白蛋白 人工包被抗原 经紫外扫描分析和动物免疫试验证实 强力霉素人工抗原合成成功
Microsoft Word - 24.doc
 閱 讀 (1) 楊 桃 毒 素 過 去 有 許 多 糖 尿 病 或 高 血 壓 患 者 吃 過 新 鮮 楊 桃 或 楊 桃 汁 後, 出 現 嘔 吐 頭 暈 意 識 不 清 等 症 狀, 研 判 因 為 他 們 腎 功 能 不 佳, 無 法 排 出 楊 桃 中 不 明 的 中 毒 成 分 楊 桃 中 的 不 明 成 分 可 能 導 致 部 分 特 殊 體 質 的 尿 毒 症 病 患, 出 現 神 經
閱 讀 (1) 楊 桃 毒 素 過 去 有 許 多 糖 尿 病 或 高 血 壓 患 者 吃 過 新 鮮 楊 桃 或 楊 桃 汁 後, 出 現 嘔 吐 頭 暈 意 識 不 清 等 症 狀, 研 判 因 為 他 們 腎 功 能 不 佳, 無 法 排 出 楊 桃 中 不 明 的 中 毒 成 分 楊 桃 中 的 不 明 成 分 可 能 導 致 部 分 特 殊 體 質 的 尿 毒 症 病 患, 出 現 神 經
C I P ) ISBN 7-5308-3914-4 / :, 2005......... - -.R339.2 CIP ( 2005 ) 013415 : : : : 35 300051 (022) 23332393 : www.tjkjcbs.com.cn 850 1168 1/ 32 7.75
 C I P ) ISBN 7-5308-3914-4 / :, 2005......... - -.R339.2 CIP ( 2005 ) 013415 : : : : 35 300051 (022) 23332393 : www.tjkjcbs.com.cn 850 1168 1/ 32 7.75 191 000 2005 1 1 1 : 17.60 ,,, 1994,,,,,,,,,,,, 1999,,,,,
C I P ) ISBN 7-5308-3914-4 / :, 2005......... - -.R339.2 CIP ( 2005 ) 013415 : : : : 35 300051 (022) 23332393 : www.tjkjcbs.com.cn 850 1168 1/ 32 7.75 191 000 2005 1 1 1 : 17.60 ,,, 1994,,,,,,,,,,,, 1999,,,,,
中国现代医学杂志 第 28 卷 progressive motility and normal morphology, which in turn can be served as prognostic predictor for nucleoprotein maturity. Keywords:
 第 28 卷第 15 期中国现代医学杂志 Vol. 28 No.15 218 年 5 月 China Journal of Modern Medicine May 218 DOI: 1.3969/j.issn.15-8982.218.15.16 文章编号 : 15-8982(218)15-75-5 精子核蛋白成熟度与精液常规参数的相关性分析 * 杨雪梅, 李俊, 谭宇哲, 王新雪, 宋亚曼 ( 河北医科大学第一医院生殖医学科,
第 28 卷第 15 期中国现代医学杂志 Vol. 28 No.15 218 年 5 月 China Journal of Modern Medicine May 218 DOI: 1.3969/j.issn.15-8982.218.15.16 文章编号 : 15-8982(218)15-75-5 精子核蛋白成熟度与精液常规参数的相关性分析 * 杨雪梅, 李俊, 谭宇哲, 王新雪, 宋亚曼 ( 河北医科大学第一医院生殖医学科,
 CIP /. 2004. 3 ISBN 7-210 - 03261-4 Ⅰ.... Ⅱ. 1... 2... Ⅲ. - Ⅳ. K826. 2 CIP 2004 007681 2005 10 1 2005 10 1 850 1168 1 /32 4. 5 100 1-5000 ISBN 7-210 - 03261-4 /K 409 10. 00 47 1 330006 6898827 6898893
CIP /. 2004. 3 ISBN 7-210 - 03261-4 Ⅰ.... Ⅱ. 1... 2... Ⅲ. - Ⅳ. K826. 2 CIP 2004 007681 2005 10 1 2005 10 1 850 1168 1 /32 4. 5 100 1-5000 ISBN 7-210 - 03261-4 /K 409 10. 00 47 1 330006 6898827 6898893
论文,,, ( &, ), 1 ( -, : - ), ; (, ), ; ;, ( &, ),,,,,, (, ),,,, (, ) (, ),,, :. : ( ), ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ), ( ),,,, 1 原译作 修补者, 但在英译版本中, 被译作
 * 夏传玲 : 本文简要回顾了国内外定性研究在最近 多年的发展概况, 总结 了定性研究的六个发展趋势和分析策略上的三种流派 在上述两种背景下, 本文探讨了计算机辅助的定性分析给定性研究带来的机遇和挑战, 特别是它和手工操作对比时的优势和劣势, 以及应用这种定性分析技术所可能面临的困难 : 定性研究定性分析 文化差异,, (, ),,,, ( - ) ( - ) ( - ) ( - ) ( - ) (
* 夏传玲 : 本文简要回顾了国内外定性研究在最近 多年的发展概况, 总结 了定性研究的六个发展趋势和分析策略上的三种流派 在上述两种背景下, 本文探讨了计算机辅助的定性分析给定性研究带来的机遇和挑战, 特别是它和手工操作对比时的优势和劣势, 以及应用这种定性分析技术所可能面临的困难 : 定性研究定性分析 文化差异,, (, ),,,, ( - ) ( - ) ( - ) ( - ) ( - ) (
65期.indd
 行政院新聞局出版事業登記證局版北市誌字第1633號 臺灣郵政台北雜字第1184 號執照登記為雜誌交寄 第六十五期 發行人 尹祚芊 總編輯 廖美南 國 內 郵資已付 板橋郵局許可證 板橋字第1120號 中華民國九十七年十月出版 主編 林俐伶 楊勤熒 編輯 呂月榮 曾修儀 潘碧雲 發行所 中華民國護理師護士公會全國聯合會 The National Union of Nurses Associations,
行政院新聞局出版事業登記證局版北市誌字第1633號 臺灣郵政台北雜字第1184 號執照登記為雜誌交寄 第六十五期 發行人 尹祚芊 總編輯 廖美南 國 內 郵資已付 板橋郵局許可證 板橋字第1120號 中華民國九十七年十月出版 主編 林俐伶 楊勤熒 編輯 呂月榮 曾修儀 潘碧雲 發行所 中華民國護理師護士公會全國聯合會 The National Union of Nurses Associations,
<4D6963726F736F667420576F7264202D20C4CFBEA9BDA1D3D1C9FABBAFD6C6D2A9B9C9B7DDD3D0CFDEB9ABCBBECAD7B4CEB9ABBFAAB7A2D0D041B9C9B9C9C6B1B2A2C9CFCAD0D5D0B9C9CBB5C3F7CAE9A3A8C9EAB1A8B8E532303136C4EA33D4C238C8D5B1A8CBCDA3A92E646F63>
 南 京 健 友 生 化 制 药 股 份 有 限 公 司 ( 南 京 高 新 开 发 区 MA010-1 号 地 ) ( 申 报 稿 ) 保 荐 人 ( 主 承 销 商 ) ( 四 川 省 成 都 市 东 城 根 上 街 95 号 ) 1-1-1 声 明 : 本 公 司 的 发 行 申 请 尚 未 得 到 中 国 证 券 监 督 管 理 委 员 会 核 准 本 招 股 说 明 书 ( 申 报 稿 )
南 京 健 友 生 化 制 药 股 份 有 限 公 司 ( 南 京 高 新 开 发 区 MA010-1 号 地 ) ( 申 报 稿 ) 保 荐 人 ( 主 承 销 商 ) ( 四 川 省 成 都 市 东 城 根 上 街 95 号 ) 1-1-1 声 明 : 本 公 司 的 发 行 申 请 尚 未 得 到 中 国 证 券 监 督 管 理 委 员 会 核 准 本 招 股 说 明 书 ( 申 报 稿 )
 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版
科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版 中 心 www.aboo 科 学 出 版 社 职 教 技 术 出 版
(CIP) : /. :, 2004 ISBN T S CIP (2004) (1 : ) : * : : :
 (CIP) : /. :, 2004 ISBN 7 5045 4510 4.... T S974. 2 CIP (2004) 044759 (1 : 100029 ) : * 787 1092 16 8. 25 176 2004 6 1 2004 6 1 : : 15. 00 : 010 64929211 : 010 64911190 : http: / / www. class. com. cn
(CIP) : /. :, 2004 ISBN 7 5045 4510 4.... T S974. 2 CIP (2004) 044759 (1 : 100029 ) : * 787 1092 16 8. 25 176 2004 6 1 2004 6 1 : : 15. 00 : 010 64929211 : 010 64911190 : http: / / www. class. com. cn
ttian
 T = l g = a - b a ϕ ϕ ϕ ϕ ϕ ϕ SiO SiO 65% SiO 52% SiO 52 45% SiO 45% 20 45% 10% 50% 95% 2.5 2.7 2.7 2.8 2.9 3.1 3.1 3.5 S0=1.94
T = l g = a - b a ϕ ϕ ϕ ϕ ϕ ϕ SiO SiO 65% SiO 52% SiO 52 45% SiO 45% 20 45% 10% 50% 95% 2.5 2.7 2.7 2.8 2.9 3.1 3.1 3.5 S0=1.94
32507-ch2.tpf
 公 共 衛 生 公 共 衛 生 和 我 們 的 生 活 息 息 相 關, 其 目 標 在 預 防 傳 染 性 疾 病, 提 升 生 活 的 水 準 人 類 早 期 由 於 疾 病 流 行 而 體 驗 到 公 共 衛 生 的 重 要, 並 致 力 於 改 善 環 境, 消 滅 病 源 病 媒 ; 近 代 則 逐 漸 兼 顧 環 境 衛 生 與 環 境 保 護, 以 期 提 高 生 活 環 境 的 品
公 共 衛 生 公 共 衛 生 和 我 們 的 生 活 息 息 相 關, 其 目 標 在 預 防 傳 染 性 疾 病, 提 升 生 活 的 水 準 人 類 早 期 由 於 疾 病 流 行 而 體 驗 到 公 共 衛 生 的 重 要, 並 致 力 於 改 善 環 境, 消 滅 病 源 病 媒 ; 近 代 則 逐 漸 兼 顧 環 境 衛 生 與 環 境 保 護, 以 期 提 高 生 活 環 境 的 品
<4D F736F F D BAC3A6FCA867A4FCAF66B0CAAAABA7ECAB72B6CBC17BA7C9B342B86DABFCA4DE28A977BD5A29>
 疑 似 狂 犬 病 動 物 抓 咬 傷 臨 床 處 置 指 引 衛 生 福 利 部 疾 病 管 制 署 2015 年 1 月 13 日 1 一 傷 口 清 潔 : 立 即 及 徹 底 的 以 肥 皂 及 大 量 水 清 洗 沖 洗 傷 口 15 分 鐘, 再 以 優 碘 或 70% 酒 精 消 毒 二 傷 口 處 理 : ( 一 ) 如 果 可 能 的 話, 避 免 縫 合 傷 口, 如 須 縫 合,
疑 似 狂 犬 病 動 物 抓 咬 傷 臨 床 處 置 指 引 衛 生 福 利 部 疾 病 管 制 署 2015 年 1 月 13 日 1 一 傷 口 清 潔 : 立 即 及 徹 底 的 以 肥 皂 及 大 量 水 清 洗 沖 洗 傷 口 15 分 鐘, 再 以 優 碘 或 70% 酒 精 消 毒 二 傷 口 處 理 : ( 一 ) 如 果 可 能 的 話, 避 免 縫 合 傷 口, 如 須 縫 合,
臺灣性教育學會2013年度工作計畫表
 大 學 生 需 要 怎 樣 的 性 教 育? 大 學 性 教 育 現 況 與 前 瞻 壹 活 動 緣 起 與 目 的 學 術 研 討 會 實 施 計 畫 本 會 自 1991 年 成 立 以 來,20 餘 年 致 力 於 結 合 國 內 性 教 育 性 諮 商 與 性 治 療 等 專 業 人 才, 積 極 主 動 推 動 國 內 學 校 家 庭 與 社 會 性 教 育, 經 常 舉 辦 各 類 專
大 學 生 需 要 怎 樣 的 性 教 育? 大 學 性 教 育 現 況 與 前 瞻 壹 活 動 緣 起 與 目 的 學 術 研 討 會 實 施 計 畫 本 會 自 1991 年 成 立 以 來,20 餘 年 致 力 於 結 合 國 內 性 教 育 性 諮 商 與 性 治 療 等 專 業 人 才, 積 極 主 動 推 動 國 內 學 校 家 庭 與 社 會 性 教 育, 經 常 舉 辦 各 類 專
Ps22Pdf
 ( ) ( CIP).. :, 2002.10 ISBN 7-5045 - 3693-8... - -. R151 CIP (2002) 085225 ( 1 : 100029) : * 787 1092 16 14.25 329 2003 4 1 2003 4 1 : : 34.00 : 64929211 : 64911190 : http: www.class.com.cn ( ) ( ) (
( ) ( CIP).. :, 2002.10 ISBN 7-5045 - 3693-8... - -. R151 CIP (2002) 085225 ( 1 : 100029) : * 787 1092 16 14.25 329 2003 4 1 2003 4 1 : : 34.00 : 64929211 : 64911190 : http: www.class.com.cn ( ) ( ) (
( ) 001 ( CIP ). :,2004 ISBN K CIP (2004) : : : ( 147 :710003) : : 787mm 1092mm : 441 :
 ( ) 001 ( CIP ). :,2004 ISBN 7-224 - 07041-6... - - -.K872.411-53 CIP (2004) 102277 : : : ( 147 :710003) : : 787mm 1092mm 16 28.5 10 : 441 : 2004 11 1 2004 11 1 : 1-1000 : ISBN 7-224 - 07041-6/ K 1171
( ) 001 ( CIP ). :,2004 ISBN 7-224 - 07041-6... - - -.K872.411-53 CIP (2004) 102277 : : : ( 147 :710003) : : 787mm 1092mm 16 28.5 10 : 441 : 2004 11 1 2004 11 1 : 1-1000 : ISBN 7-224 - 07041-6/ K 1171
892213E006146
 Modular Design of Quality Control Systems NSC89-2213-E006-146 89 8 1 90 7 31 ( ) ISO14000, and OHSAS18000. Keywords: ISO9000; ISO14000; OHSAS18000; Quality ISO9000 ISO14000 OHSAS18000 Management; Environment
Modular Design of Quality Control Systems NSC89-2213-E006-146 89 8 1 90 7 31 ( ) ISO14000, and OHSAS18000. Keywords: ISO9000; ISO14000; OHSAS18000; Quality ISO9000 ISO14000 OHSAS18000 Management; Environment
 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
递, 激 素 神 经 递 质 药 物 需 通 过 细 胞 膜 外 表 面 上 的 相 应 受 体 的 作 用 细 胞 壁 植 物 细 胞 所 特 有 细 胞 器 内 质 网 : 膜 性 管 道 系 统, 核 糖 体 附 着 于 粗 面 内 质 网 上, 滑 面 内 质 网 高 尔 基 复 合 体 :
 前 言 这 门 课 要 讲 的 内 容 学 什 么? 这 门 课 的 重 要 性 有 什 么 用 处? 1 与 我 们 的 专 业 密 切 相 关 2 与 我 们 的 生 活 息 息 相 关 学 习 方 法 怎 样 学? 1 理 论 联 系 实 际 2 局 部 与 整 体 的 关 系 生 命 系 统 的 层 次 : 生 物 圈 : 地 球 上 有 生 命 存 在 的 环 境 的 总 和 地 球 表
前 言 这 门 课 要 讲 的 内 容 学 什 么? 这 门 课 的 重 要 性 有 什 么 用 处? 1 与 我 们 的 专 业 密 切 相 关 2 与 我 们 的 生 活 息 息 相 关 学 习 方 法 怎 样 学? 1 理 论 联 系 实 际 2 局 部 与 整 体 的 关 系 生 命 系 统 的 层 次 : 生 物 圈 : 地 球 上 有 生 命 存 在 的 环 境 的 总 和 地 球 表
标题
 ,, 10,,,, (CIP) /. :,2014. 1 ISBN 978-7-5624-7897-3 Ⅰ. 1 Ⅱ. 1 Ⅲ. 1 2 Ⅳ. 1TU986. 3 CIP (2013) 301057 : : : : : : 21 :401331 :(023) 88617190 88617185( ) :(023) 88617186 88617166 :http: / / www. cqup. com.
,, 10,,,, (CIP) /. :,2014. 1 ISBN 978-7-5624-7897-3 Ⅰ. 1 Ⅱ. 1 Ⅲ. 1 2 Ⅳ. 1TU986. 3 CIP (2013) 301057 : : : : : : 21 :401331 :(023) 88617190 88617185( ) :(023) 88617186 88617166 :http: / / www. cqup. com.
PowerPoint Presentation
 男性不育诊疗进展 陈振文 国家人口计生委科研所 2014/9/19 1 男性不育诊疗的新进展 : 诊断 常规治疗 辅助生殖技术 2014/9/19 2 男性不育诊疗的基本规范 : 病史 体格检查 ( 一般检查和专科检查 ) 实验室检查及其他辅助检查 药物治疗 手术治疗 辅助生殖技术 WHO 男性不育标准化检查和诊疗手册 ( 英文版 2000, 中文版 2007) 2014/9/19 3 男性不育的诊断
男性不育诊疗进展 陈振文 国家人口计生委科研所 2014/9/19 1 男性不育诊疗的新进展 : 诊断 常规治疗 辅助生殖技术 2014/9/19 2 男性不育诊疗的基本规范 : 病史 体格检查 ( 一般检查和专科检查 ) 实验室检查及其他辅助检查 药物治疗 手术治疗 辅助生殖技术 WHO 男性不育标准化检查和诊疗手册 ( 英文版 2000, 中文版 2007) 2014/9/19 3 男性不育的诊断
檢 舉 獎 金, 分 別 於 檢 察 官 提 起 公 訴 不 起 訴 處 分 緩 起 訴 處 分 或 經 法 院 判 決 有 罪 確 定 後, 由 受 理 檢 舉 機 關 通 知 檢 舉 人 親 自 具 名 領 取 檢 舉 人 有 數 人 時, 獎 金 平 均 分 配 ; 其 有 先 後 者, 獎
 農 業 環 保 篇 法 規 行 政 院 農 業 委 員 會 令 中 華 民 國 100 年 9 月 15 日 農 防 字 第 1001479569 號 修 正 檢 舉 走 私 進 口 動 植 物 及 其 產 品 獎 勵 辦 法 第 七 條 第 七 條 之 一 第 九 條 之 一 附 修 正 檢 舉 走 私 進 口 動 植 物 及 其 產 品 獎 勵 辦 法 第 七 條 第 七 條 之 一 第 九 條
農 業 環 保 篇 法 規 行 政 院 農 業 委 員 會 令 中 華 民 國 100 年 9 月 15 日 農 防 字 第 1001479569 號 修 正 檢 舉 走 私 進 口 動 植 物 及 其 產 品 獎 勵 辦 法 第 七 條 第 七 條 之 一 第 九 條 之 一 附 修 正 檢 舉 走 私 進 口 動 植 物 及 其 產 品 獎 勵 辦 法 第 七 條 第 七 條 之 一 第 九 條
20110420
 愛 滋 病 與 結 核 病 防 治 台 北 榮 民 總 醫 院 感 染 科 國 立 陽 明 大 學 醫 學 系 王 永 衛 醫 師 它 是 什 麼? 愛 滋 病 毒 (HIV) 後 天 免 疫 缺 乏 病 毒 愛 滋 病 (AIDS) 後 天 免 疫 缺 乏 症 候 群 愛 滋 病 1980 年 迄 今 Million 50 45 40 35 30 25 20 15 1 First cases of
愛 滋 病 與 結 核 病 防 治 台 北 榮 民 總 醫 院 感 染 科 國 立 陽 明 大 學 醫 學 系 王 永 衛 醫 師 它 是 什 麼? 愛 滋 病 毒 (HIV) 後 天 免 疫 缺 乏 病 毒 愛 滋 病 (AIDS) 後 天 免 疫 缺 乏 症 候 群 愛 滋 病 1980 年 迄 今 Million 50 45 40 35 30 25 20 15 1 First cases of
三坐标重复性和再现性分析
 四 绘制极差图 五 绘制均值图 六 评价原则测量系统可接受性的通用比例原则 : %GRR 低于 10% 的误差 可接受的测量系统 %GRR 在 10% 到 30% 的误差 根据应用的重要性 测量装置的成本 维修费用等, 可能是可接受的 %GRR 大于 30% 的误差 不可接受, 应尽各种力量以改进这测量系统 区别分类数 (ndc) 要大于或等于 5 极差图评价 : 若所有的极差均受控, 则说明所有评价人都进行了相同的工作
四 绘制极差图 五 绘制均值图 六 评价原则测量系统可接受性的通用比例原则 : %GRR 低于 10% 的误差 可接受的测量系统 %GRR 在 10% 到 30% 的误差 根据应用的重要性 测量装置的成本 维修费用等, 可能是可接受的 %GRR 大于 30% 的误差 不可接受, 应尽各种力量以改进这测量系统 区别分类数 (ndc) 要大于或等于 5 极差图评价 : 若所有的极差均受控, 则说明所有评价人都进行了相同的工作
标准名称
 司法鉴定技术规范 SF/Z JD0103011 2018 男性生育功能障碍法医学鉴定 Forensic Assessment for Male Reproductive Dysfunction 2018-11-08 发布 2019-01-01 实施 中华人民共和国司法部公共法律服务管理局 发布 目 次 前言... II 1 范围... 1 2 规范性引用文件... 1 3 术语和定义... 1 4
司法鉴定技术规范 SF/Z JD0103011 2018 男性生育功能障碍法医学鉴定 Forensic Assessment for Male Reproductive Dysfunction 2018-11-08 发布 2019-01-01 实施 中华人民共和国司法部公共法律服务管理局 发布 目 次 前言... II 1 范围... 1 2 规范性引用文件... 1 3 术语和定义... 1 4
美 国 传 染 病 学 会 发 热 和 中 性 粒 细 胞 减 少 指 南 旨 在 为 不 断 发 展 的 流 程 提 供 合 理 的 总 结 下 面 是 2010 年 指 南 更 新 的 总 结 有 关 方 法 背 景 和 支 持 各 个 的 证 据 总 结, 详 细 描 述 见 指 南 全 文
 IDSA 指 南 中 性 粒 细 胞 减 少 肿 瘤 患 者 抗 菌 药 物 应 用 临 床 实 践 指 南 : 美 国 传 染 病 学 会 2010 年 更 新 Alison G. Freifeld, 1 Eric J. Bow, 9 Kent A. Sepkowitz, 2 Michael J. Boeckh, 4 James I. Ito, 5 Craig A. Mullen, 3 Issam
IDSA 指 南 中 性 粒 细 胞 减 少 肿 瘤 患 者 抗 菌 药 物 应 用 临 床 实 践 指 南 : 美 国 传 染 病 学 会 2010 年 更 新 Alison G. Freifeld, 1 Eric J. Bow, 9 Kent A. Sepkowitz, 2 Michael J. Boeckh, 4 James I. Ito, 5 Craig A. Mullen, 3 Issam
WHO/NMH/NVI/ WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland book
 概要 道路安全全球现状报告 2015 WHO/NMH/NVI/15.6 2015 www.who.int WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland+41 22 791 3264+41 22 791 4857bookorders@who.int http://www.who.int/about/licensing/
概要 道路安全全球现状报告 2015 WHO/NMH/NVI/15.6 2015 www.who.int WHO Press, World Health Organization, 20 Avenue Appia, 1211 Geneva 27, Switzerland+41 22 791 3264+41 22 791 4857bookorders@who.int http://www.who.int/about/licensing/
(CIP) : / :,, :,2000.5 ISBN 7-04 - 008822-3 - - N - 42 CIP (2000)60397 55 100009 010-64054588 010-64014048 / 8501168 1/ 32 7.875
 ( ) (CIP) : / :,, :,2000.5 ISBN 7-04 - 008822-3 - - N - 42 CIP (2000)60397 55 100009 010-64054588 010-64014048 http:/ / www.hep.edu.cn 8501168 1/ 32 7.875 190 000 8.40, ( ) 1 16 16 16 18 21 22 24 24 24
( ) (CIP) : / :,, :,2000.5 ISBN 7-04 - 008822-3 - - N - 42 CIP (2000)60397 55 100009 010-64054588 010-64014048 http:/ / www.hep.edu.cn 8501168 1/ 32 7.875 190 000 8.40, ( ) 1 16 16 16 18 21 22 24 24 24
校园之星
 x x x x x x C H N O V x B x x x x S S x mm cm cm cm cm x x x x x x x x A A B X B B ml x x B
x x x x x x C H N O V x B x x x x S S x mm cm cm cm cm x x x x x x x x A A B X B B ml x x B
20 世 纪 80 年 代 国 际 社 会 提 出 流 产 后 保 健 (post abortion care,pac) 理 念,1991 年 国 际 项 目 支 持 与 服 务 组 织 (IPAS) 首 次 把 流 产 后 保 健 服 务 定 位 为 一 种 重 要 的 生 殖 保 健 服 务,
 中 国 流 产 后 保 健 服 务 (PAC) 的 实 施 与 效 果 1 杨 薇, 李 阳, 梁 霁 2, 钱 序 复 旦 大 学 公 共 卫 生 学 院, 卫 生 部 卫 生 技 术 评 估 重 点 实 验 室 ( 上 海 ) 200032 摘 要 : 流 产 后 保 健 服 务 (PAC) 是 国 际 社 会 倡 导 的 改 善 妇 女 生 殖 健 康 以 及 生 活 质 量 的 一 种 服
中 国 流 产 后 保 健 服 务 (PAC) 的 实 施 与 效 果 1 杨 薇, 李 阳, 梁 霁 2, 钱 序 复 旦 大 学 公 共 卫 生 学 院, 卫 生 部 卫 生 技 术 评 估 重 点 实 验 室 ( 上 海 ) 200032 摘 要 : 流 产 后 保 健 服 务 (PAC) 是 国 际 社 会 倡 导 的 改 善 妇 女 生 殖 健 康 以 及 生 活 质 量 的 一 种 服

