关于进一步加强临床试验质量管理规定及临床试验质量承诺书 2015 年 7 月 22 日晚国家食品药品监督管理总局发布了 117 号文, 要求对 1622 个品种展开药物临床试验的自查 核查工作 此后, 国家食品药品监督管理总局发布了一系列公告, 对药物临床试验质量提出了更高的要求 在国家新政策 新法
|
|
|
- 倪 雷
- 5 years ago
- Views:
Transcription
1 关于进一步加强临床试验质量管理规定及临床试验质量承诺书 2015 年 7 月 22 日晚国家食品药品监督管理总局发布了 117 号文, 要求对 1622 个品种展开药物临床试验的自查 核查工作 此后, 国家食品药品监督管理总局发布了一系列公告, 对药物临床试验质量提出了更高的要求 在国家新政策 新法规 新临床试验标准的高要求下, 为了提高临床试验质量, 试验数据符合国家的要求, 我院增加了新的临床试验质量管理规定 具体内容如下 : 一 凡是通过药理基地接的临床试验项目,PI 必须组织人员按照 CFDA 发布的 228 号文的要求开展项目 在专业科室召开的启动会, 必须由 PI 组织, 申办者实施 二 专业科室项目负责人 (PI) 必须按照 CFDA 发布的 230 号文的规定承担责任及 GCP 规定的职责 三 PI 必须授权一名主治及主治以上的临床医生 ( 可以兼职 ) 具体负责整个项目的开展 四 PI 必须授权一名临床医生 ( 独立项目之外 具有 GCP 培训证书 ) 具体负责整个项目的科室质量控制工作 五 CRC 必须通过 PI 及机构的面试才能进入医院开展工作 工作期间必须遵守本院的相关制度及规定 六 CRA 必须履行 GCP 规定的监查员职责 如果不能尽职的, 要求申办方更换 CRA 附件 :1. 科室启动会的要求 2. 专业科室负责人 (PI) 的要求 3. 临床试验负责医生的要求 4. 临床试验经费的要求 5. 临床试验科室质控医生的要求 6. 研究者的要求 7.CRC 的要求 8.CRA 的要求 9. 对于本临床试验质量的承诺 项目名称 : 申办方 : CRO: 科室 : PI: 项目信息 山东大学齐鲁医院 1 国家药物临床试验机构办公室 二零一六年元月五日制定 ( 日执行 )
2 附件一 : 科室启动会的要求 凡通过药理基地进行的临床试验, 必须有 PI 组织, 申办者实施在专业科室内召开启动会, 其内容至少涵盖 : 1 对试验方案的培训 有关试验操作类的培训和相关 GCP 内容培训 2 对 CRF 及原始病历的填写要求逐页试填写培训 3 药理基地办公室负责质控人员参加启动会讲解注意事项, 核实文件夹中 CFDA 批件 伦理批件 合同 药检报告 药物发放回收表是否规范等等 4 科室专门的医生记录启动会的情况, 和科主任共同签字后存入文件夹与原始资料一起保存 5 授权分工需在启动会之前落实, 会上仅仅是再确认和签日期 6 对药品管理员和资料管理员进行专门培训 7 知情过程 过程记录及知情同意书的签署 8 受试者日记卡的发放 填写 回收 核对 修正等 对病历书写的培训要求 1 对住院病历按照住院病历规范记录和书写 2 对于门诊病历 PI 签名 : 日期 : 具体负责医生签名 : 日期 : 2
3 附件二 : 专业科室负责人 (PI) 的要求 1. 专业科室负责人 (PI), 接项目前必须认真学习国家食品药品监督管理局批件发布的 2015 年 CFDA 第 228 号公告 确认所接受的临床试验项目项目能够完全按照 228 号文的要求组织实施 2. 专业科室负责人 (PI), 接项目前必须认真学习国家食品药品监督管理局批件发布的 2015 年 CFDA 第 230 号公告 按照本公告要求,PI 要勇于承担是否遵循临床试验方案的责任和 GCP 规定的研究者的职责的责任 3. 专业科室负责人 (PI), 在临床试验项目资料签字前一定要认真审核, 确保所签署资料的真实性 完整性及科学可靠性后再签字 4. 专业科室负责人 (PI), 必须授权一名主治及主治以上的临床医生, 专门负责本项目的实施 ( 可兼职 ) 5. 专业科室负责人 (PI), 每个项目必须组织一团队全权负责本项目的临床试验的实施 团队外的人员不能参与 如果人员调动, 必须有新的培训及新的 PI 授权 PI 签名 : 日期 : 3
4 附件三 : 临床试验负责医生的要求 1. 临床试验负责医生, 必须由 PI 授权, 职称为主治及主治以上 2. 临床试验负责医生, 对整个项目的组织实施及实施过程中的质量负责 签字 : 日期 : 3. 在入选受试者前 1~3 例期间, 务必于机构办公室质量人员联系, 分析筛选 入选及存在问题的解决情况 签字 : 日期 : 4. 不能与 PI 同时出差亦即科室内要保证总有一名专门医生处理临床试验的事情 签字 : 日期 : 5. 每筛选一位受试者需要保留其身份证复印件 签字 : 日期 : 6. 上一年度发票报销截止日期为本年度 2 月 15 日, 当年发票要及时报销, 逾期发票不予报销 签字 : 日期 : 7. 观察费领取说明 : 临床试验结束, 经费核算后, 才能由 PI 指定本科室人员到机构办公室计算并领取相关表格 签字 : 日期 : 负责医生签名 : 日期 : 4
5 附件四 : 临床试验经费的要求 研究者经费承诺 因我院临床试验中, 受试者检查费和交通补偿费属于由 CRA 或 CRC 直接支付给受试者 专业科室的 PI 和具体负责医生是否承诺监督和督促 CRA 或 CRC 每次随访为受试者支付检查费和交通补偿费, 直接关系到受试者相关权益的保护是否到位 为了更好的保护受试者权益, 在此, 我承诺 : 1 PI 负责督促签字 : 日期 : 2 负责医生负责直接监督签字 : 日期 : 3 科室质控人员质控时必须查看签字 : 日期 : 5
6 附件五 : 临床试验科室质控医生的要求科室质控医生 (QA) 应是独立于项目之外的我院医生, 并已取得 GCP 培训证书 : 1 科室 QA 在本项目入组 2 例前必须进行质控 2 在试验过程中每完成 5-6 例病例时, 科室质控人员进行一次质控 如果随访周期超过 1 年, 应每 3 个月质控一次 3 每次质控应来机构办公室进行必要溯源, 由 CRA 或机构人员共同质控, 每次利用至少完整的半天时间进行 4 需书面记录发现的问题, 并督促研究者修改 改进和反馈机构办公室主任 5 研究结束, 临床资料递送机构办公室质控前, 所有未进行质控的病例及资料必须全部进行质控 6 科室质控应包含研究者文件夹 病历资料 CRF 药物/ 器械等所有本项目产生的资料 数据等 7 与机构办人员联系填写科室质控劳务费信息表, 按照合同规定领取质控费 8 科室质控医生被授权后可联系 并发送邮件至 : qljgbgs@126.com 索取科室质控样表及注意事项 我保证按照以上八条严格执行, 并已得到本签字的电子版 / 拍照留存 科室质控医生签名 : 日期 : 6
7 附件六 : 研究者的要求 1. 研究者必须在本医疗机构中具有专业技术职称及行医资格 经过 GCP 培训合格 并得到主要研究者的授权 2. 研究者专门负责谈知情 筛选 入选 随访观察 评价 处理 AE 和 SAE 等临床试验的事情为主 3. 原始资料必须由 PI 授权的研究者填写, 并签名及日期 如需修改必须按照 GCP 要求进行修改, 写明修改理由并签名及日期 不能由 CRC 或学生填写 4. 必须由研究者进行知情同意及知情同意书的签署 1 必须由研究者与受试者亲笔填写, 日期统一 ;2 知情日期必须在其他一切工作之前 ;3 必须给予受试者一份 ;4 如有见证人, 必须与研究者及受试者均无关系 ;5 知情过程必须记录在病程或门诊病历中 5. 必须授权两位护理人员作为药物的管理 1 必须及时记录温 湿度, 如有异常及时按照药物管理标准操作规程处理 ;2 发放及回收及时记录, 精确到最小单位并记录每次访视剂量, 杜绝回忆性记录 ; 3 严格执行药品保管 SOP;4 专人管理, 两人不能参与该项目其他工作 ;5 药物接收需联系机构共同核对药物 6. 研究者必须对每次随访所做的实验室检查结果进行审阅, 并签名及日期进行确认 如有异常及时处理 记录 复查 7. 研究者必须全部记录不良事件, 无论与药物是否相关 8. 研究者必须记录所有的合并用药, 不能遗漏 7
8 9. 如有量表, 不能随意修改 10.ECG 需复印 11. 研究者每次随访时必须对受试者日记卡进行仔细核对, 存在疑问应及时与受试者沟通如需要修改, 让受试者修改签名确认并记录沟通过程 12. 生物样本采集的护士与药物管理员不能为同一个人 对生物样本采集 预处理 保存 转运过程的各环节均有原始记录, 并能追溯各环节记录的完整性和原始性 被授权研究者签名及日期 : 8
9 9
10 附件七 :CRC 的要求 1.CRC 经面试合格后进入医院, 必须遵守医院的相关规章制度 如果违反医院的相关规章制度, 或者研究者 质控人员, 认为该 CRC 不能胜任工作, 会提出更换 2.CRC 必须在第 1 例入选时间之后的每隔四周的周末向质量人员汇报项目的情况 ( 包括 AE SAE 违背方案 知情和方案修正案及其他发生的情 ) 2.CRC 不能参与的工作包括 :1 不准管理临床试验用药物 ;2 不准参与一切医疗行为及医疗解释 ;3 不能在非工作需要的区域内活动 ;4 不能参与知情过程及知情同意书的签署 ;5 不能填写原始资料 ; 6 不能采集血液样本 ;7 不能私自复印 拍照受试者的住院病历 ; 3.CRC 能参与的工作 :1 转录 CRF 填写 EDC;2 协助研究者随访受试者 ;3 协助研究者上报 递交 传真 SAE;4 提醒研究者每次随访相关检查的开单 收集相关检查报告, 并提醒研究者关注异常结果 ;5 协助研究者发放 回收 核对受试者日记卡 CRC 签名 : 日期 : 10
11 附件八 :CRA 的要求 1.CRA 必须要经过培训, 熟悉 GCP 及现行管理法律法规 经过研究者认可, 如果研究者认为此 CRA 不能很好的履行职责, 则提出更换监查员 2.CRA 必须保证每次访视发现的问题记录, 交给齐鲁医院机构质量人员保存 并保证下次访视时把上次发现的问题解决落实情况以书面方式公司盖章 CRA 签字交机构质控人员 3.CRA 每次访视时查看文件夹是否完整, 发药记录是否完整, 药品保存条件是否合格等等 4.CRA 必须对临床试验质量 数量 费用 时限进行评估, 以保证试验数据可靠以及受试者的安全 5.CRA 必须履行 GCP 中规定的监查员的职责 CRA 签名 : 日期 : 11
12 附件九 : 对于药物临床试验质量的承诺 作为本临床试验的主要研究者 / 具体负责人 / 研究者 / 科室 QA/CRA/CRC 本人在此承诺 : 1 本人将会严格按照国家食品药品监督管理局批件发布的 2015 年 CFDA 第 228 号公告 药物临床试验数据现场核查要点 的要求开展临床试验工作 2 对于本临床试验按照讲严格按照 国家食品药品监督管理总局关于药品注册审评审批若干政策的公告 (2015 年第 230 号 ) 承担应当承担的责任 3 本人已充分阅读理解 最高人民法院 最高人民检察院关于办理药品 医疗器械注册申请材料造假刑事案件适用法律若干问题的解释 文件, 承诺杜绝 解释 中涉及问题并承担相应责任 PI 签名 : 日期 : 具体负责医生签名 : 日期 : CRA: 日期 : CRC: 日期 : 12
13 附 : 号文 两高文件 PI 签字 : 日期 : 序号 药物临床试验数据现场核查要点 现场核查要点 一 Ⅱ Ⅲ 期临床试验 人体生物等效性 (BE)/ 人体药代动力学 (PK) 试验 疫苗临床试验数据现场核查要点 通用内容 1. 临床试验条件与合规性 ( 含各方在临床试验项目中职责落实 ) 1.1* 临床试验单位承担药物临床试验的条件与合规性 : 临床试验须在具有药物临床试验机构资格的医院内进行 ( 含具有一次性临床试验机构资格认定的批件 ), 落实临床试验条件是否支持试验项目实际的实施过程 具有合法的 药物临床试验批件 核对项目开始实施时间与国家食品药品监督管理总局 药物临床试验批件 时间相符性 1.2 伦理审查批件及记录的原始性及完整性 : 有出席伦理审查会议的签到表和委员讨论的原始记录 委员表决票及审查结论保存完整且与伦理审批件一致 1.3 临床试验合同经费必须覆盖临床试验所有开支 ( 含检测 受试者营养 / 交通费补贴 研究者观察费等 ) 1.4 申办者 / 合同研究组织 (CRO) 按照药物临床试验管理规范 (GCP) 原则 方案及合同承担相应职责的文件和记录 ( 如合同或方案中规定的项目质量管理责任及监查 稽查相关记录等 ) 2. 临床试验部分 ( 以研究数据的真实完整性为关注点 ) 2.1 受试者的筛选 / 入组相关数据链的完整性 : 2.1.1* 申报资料的总结报告中筛选 入选和完成临床试验的例数与分中心小结表及实际临床试验例数一致, 若不一致须追查例数修改的环节 13
14 2.1.2* 方案执行的入选 排除标准符合技术规范 ( 如实记录体检 血尿常规 血生化 心电图等详细内容 ), 其筛选成功率为多少?( 含有证据的初筛受试者例数 ) 2.1.3* 受试者代码鉴认表或筛选 体检等原始记录涵盖受试者身份鉴别信息 ( 如姓名 住院号 / 门诊就诊号 身份证号 联系地址和联系方式等 ), 由此核查参加临床试验受试者的真实性 对受试者的相关医学判断和处理必须由本机构具有执业资格的医护人员执行并记录, 核查医护人员执业许可证及其参与临床试验的实际情况 受试者在方案规定的时间内不得重复参加临床试验 2.2 知情同意书的签署与试验过程的真实完整性 : 已签署的知情同意书数量与总结报告中的筛选和入选病例数一致 所有知情同意书签署的内容完整 规范 ( 含研究者电话号码, 签署日期等 ) 知情同意签署时间不得早于伦理批准时间, 记录违规例数 2.2.4* 知情同意书按规定由受试者本人或其法定代理人签署 ( 必要时, 多方核实受试者参加该项试验的实际情况 ) 2.3 临床试验过程记录及临床检查 化验等数据的溯源 : 临床试验的原始记录, 如执行方案 病例报告表 (CRF) 采血记录 接种记录 观察记录 受试者日记卡等保存完整 ; 核查任何一项不完整 不真实的数据 核查 CRF 记录的临床试验过程 ( 如访视点 接种时间 采血点 观察时间等 ) 与执行方案的一致性 ; 核查任何一项不一致 不真实的数据 2.3.3* 核查 CRF 中的检查数据与检验科 影像科 心电图室 内镜室 (LIS PACS 等信息系统 )/ 等检查数据一致 ; 核实任何一项不一致 / 不能溯源的数据 核查 CRF 中的数据和信息与住院病历 (HIS) 中入组 知情同意 用药医嘱 访视 病情记录等关联性记录 ; 核实完全不能关联的受试者临床试验的实际过程 核查门诊受试者的 CRF 中入组 访视 病情记录等信息与 14
15 门诊病历 ( 研究病历 ) 的关联性 ( 必要时, 可通过医院 HIS 系统核查门诊就诊信息 ) 受试者用药应有原始记录, 如受试者日记卡或医嘱或原始病历 ( 住院 / 门诊 / 研究病历 ) 等 ; 核查记录的完整性 ( 用药时间 用药量等 ) 及其原始性 2.3.7* CRF/ 研究病历中的临床检查数据与总结报告一致 (2.3.3 款继续核查 ); 落实任何一项不一致数据发生的原由 核查 CRF 的不良事件 (AE) 的记录及判断与原始病历 / 总结报告一致, 核实并记录漏填的 AE 例数 2.4 CRF 中违背方案和严重不良事件 (SAE) 例数等关键数据 : 核查 CRF 中合并用药记录与门诊 / 住院病历记载是否一致, 核实并记录漏填的合并用药例数 ; 若一致则核实其与总结报告是否一致 核查 CRF 中违背方案的合并禁用药的记录与门诊 / 住院病历记载是否一致, 核实并记录漏填合并方案禁用药的例数 ; 若一致则核实其与总结报告是否一致 CRF 中偏离和 / 或违背方案相关记录和处理与实际发生例数 ( 门诊 / 住院病历 ) 及总结报告一致 ; 核实并记录漏填的例数 2.4.4*CRF 中发生的 SAE 处理和报告记录, 与原始病历 ( 住院病历 门诊 / 研究病历 ) 总结报告一致 ; 核实并记录瞒填的例数 2.5 试验用药品 / 疫苗的管理过程与记录 : 2.5.1* 试验用药品 / 疫苗的来源和药检具有合法性 ( 参比制剂的合法来源证明为药检报告 药品说明书等 ) 2.5.2* 试验用药品 / 疫苗的接收 保存 发放 使用和回收有原始记录 ; 核实原始记录各环节的完整性和原始性 2.5.3* 试验用药品 / 疫苗接收 保存 发放 使用 回收原始记录的数量一致, 核实并记录各环节数量的误差 试验用药品 / 疫苗运输和储存过程中的温度均符合要求 试验用药品 / 疫苗批号与药检报告 总结报告等资料一致 15
16 2.6 临床试验的生物样本采集 保存 运送与交接记录 : 3. 委托研究 2.6.1* 生物样本采集 预处理 保存 转运过程的各环节均有原始记录 ; 追溯各环节记录的完整性和原始性 血样采集时间与计划时间的变化与总结报告一致 根据化学药品性质需进行特殊处理的生物样本采集 预处理应在方案中有规定, 且原始记录与方案要求一致 3.1 其他部门或单位进行的研究 检测等工作, 是否有委托证明材 4. 其他 料 委托证明材料反映的委托单位 时间 项目及方案等是否与申报资料记载一致 被委托机构出具的报告书或图谱是否为加盖其公章的原件 对被委托机构进行现场核查, 以确证其研究条件和研究情况 4.1* 出现下列情况, 视为拒绝或逃避检查 : 拖延 限制 拒绝检查人员进入被检查场所或者区域的, 或者限制检查时间的 ; 无正当理由不提供或者规定时间内未提供与检查相关的文件 记录 票据 凭证 电子数据等材料的 ; 以声称相关人员不在, 故意停止经营等方式欺骗 误导 逃避检查的 ; 拒绝或者限制拍摄 复印 抽样等取证工作的 ; 其他不配合检查的情形 二 人体生物等效性 (BE)/ 人体药代动力学 (PK) 试验数据现场核查要点 专有内容 4.BE PK 生物样本检测部分 ( 检测数据的真实完整性为重点 ) 5.1 具备与试验项目相适应实验室检测设备与条件 : 16
17 5.1.1 分析测试的关键实验设备 仪器应有相关维护记录 5.1.2* 遵循 药物 I 期临床试验管理指导原则 ( 试行 ), 2011 年 12 月 2 日以后的试验项目须开启源计算机 ( 采集原始数据的计算机 ) 和工作站的稽查系统 5.2 生物样本检测实验过程记录的真实完整性 : 生物样本检测实验须有完整的原始记录 ( 包括实验单位 人员 日期 条件及实验结果等 ); 核实记录的完整和原始性 5.2.2* 生物样本分析方法学确证的原始数据与总结报告一致 5.2.3* 核查血药浓度数据与对应标准曲线计算的一致性 ; 现场重新计算用以核实试验数据的真实性 5.3 生物样本的管理轨迹可溯源 : 5.3.1* 生物样本有接收 入库 存放的原始记录, 且记录完整 ( 含样本标识 数量 来源 转运方式和条件 到达日期和到达时样本状态等信息 ) 贮存的生物样本有领取 存入的原始记录 在规定期限内, 该项目保存的生物样本留样及其原始记录 ; 核查留存生物样本的实际数量及记录的原始性 5.4 分析测试图谱的可溯源性 : 5.4.1* 图谱上的文件编码 / 测试样本编码与受试者生物样本编码的对应关系能够追溯 ; 核实和记录不可追溯的环节 所有纸质图谱包含完整的信息 ( 进样时间 峰高 / 峰面积 血药浓度等 ); 核实和记录不完整的信息 5.4.3* 核查未知样本 方法学验证样本及随行标准曲线 QC 样本的图谱, 并在源计算机溯源, 核对其与工作站电子图谱的一致性 ; 记录检查数量以及不一致和不可溯源的数量 5.4.4* 核查未知样本 随行标曲 QC 样本图谱其进样 / 采集时间与文件编码顺序 试验时间顺序的对应一致性 ; 追踪和记录所有不一致的数据 5.4.5* 纸质图谱数据与总结报告一致性, 记录不一致数量 5.5* 核查并记录影响 Cmax AUC 等 BE 评价数据手动积分 17
18 5.6 复测生物样本应有复测数量 复测原因 采用数据的说明 5.7* 血药浓度 / 药代动力学 / 生物等效性的分析计算数据及结果在相应的软件上可重现, 且与总结报告一致 三 Ⅱ Ⅲ 期临床试验数据和疫苗临床试验数据现场核查要点 专有内容 4. Ⅱ Ⅲ 期临床试验 / 疫苗临床试验部分 ( 以数据库的真实性为重点 ) 6.1 核查原始数据 统计分析和总结报告与锁定的数据库一致性 : 6.1.1* 数据库锁定后是否有修改及修改说明 ; 核实和记录无说明擅自修改的数据 6.1.2* 锁定数据库的入组 完成例数与实际发生的入组 完成例数对应一致 ; 核实和记录不一致的例数 6.1.3* 核查锁定数据库与 CRF 和原始病历记录的主要疗效指标及安全性指标一致性 ( 如有修改需进一步核查疑问表的修改记录 ); 记录检查例数和擅自修改的数据 核对统计报告例数与锁定数据库的一致性 核对总结报告例数与锁定数据库的一致性 18
19 PI 签字 : 日期 : 国家食品药品监督管理总局关于药品注册审评审批若干政策的公告 (2015 年第 230 号 ) 2015 年 11 月 11 日 根据 中华人民共和国药品管理法 国务院关于改革药品医疗器械审评审批制度的 意见 ( 国发 号 ) 等有关规定, 为解决药品注册申请积压问题, 提高药品审评 审批质量和效率, 经国务院同意, 实行如下药品注册审评审批政策 现予以公告 : 一 提高仿制药审批标准 仿制药按与原研药质量和疗效一致的原则受理和审评审批 其中, 对已在中国境外上市 但尚未在境内上市药品的仿制药注册申请, 应与原研药进行生物等效性研究并按国际通行技 术要求开展临床试验, 所使用的原研药由企业自行采购, 向国家食品药品监督管理总局申请 一次性进口 ; 未能与原研药进行对比研究的, 应按照创新药的技术要求开展研究 已经受理的仿制药注册申请, 实行分类处理 : ( 一 ) 中国境内已有批准上市原研药, 申请注册的仿制药没有达到与原研药质量和疗效 一致的, 不予批准 ( 二 ) 中国境外已上市但境内没有批准上市原研药, 申请仿制药注册的企业可以选择按 原规定进行审评审批, 但在药品批准上市 3 年内需按照国发 号文件规定进行质 量和疗效一致性评价, 未通过一致性评价的注销药品批准文号 ; 企业也可以选择撤回已申报 的注册申请, 改按与原研药质量和疗效一致的标准完善后重新申报 对上述重新申报的注册 申请实行优先审评审批, 批准上市后免于进行质量和疗效一致性评价 对申报上市的仿制药注册申请, 首先审查药学研究的一致性, 药学研究未达到要求的, 19
20 不再对其他研究资料进行审查, 直接作出不予批准决定 二 规范改良型新药的审评审批 对改变原研药剂型 酸根 碱基和给药途径等的药品注册申请, 申请人需证明其技术创 新性且临床价值与原品种比较具有明显优势 ; 无法证明具备上述优势的, 不予批准 改变剂 型和规格的儿童用药注册申请除外 三 优化临床试验申请的审评审批 对新药的临床试验申请, 实行一次性批准, 不再采取分期申报 分期审评审批的方式 ; 审评时重点审查临床试验方案的科学性和对安全性风险的控制, 保障受试者的安全 加强临 床试验申请前及过程中审评人员与申请人的沟通交流, 及时解决注册申请和临床试验过程中 的问题 申请人需按要求及时补报最新研究资料 在 Ⅰ 期 Ⅱ 期临床试验完成后, 申请人应 及时提交试验结果及下一期临床试验方案 未发现安全性问题的, 可在与药审中心沟通后转 入下一期临床试验 申请人应如实报告临床试验中发生的严重不良事件, 按时提交研究年度 报告 ; 对不能控制临床试验安全性风险的, 应立即停止临床试验 药审中心与申请人当面沟 通, 应当场形成会议纪要列明议定事项 自 2015 年 12 月 1 日起, 仿制药生物等效性试验由审批制改为备案制 申请人应按照国 家食品药品监督管理总局发布的相关指导原则和国际通行技术要求与原研药进行全面的质 量对比研究, 保证与原研药质量的一致性 ; 生物等效性试验用样品的处方 工艺 生产线应 与商业化生产保持一致 申请人开展生物等效性试验前, 应按国家食品药品监督管理总局制 定的管理规定与技术要求于试验前 30 天向国家食品药品监督管理总局提交备案资料 试验 过程中, 国家食品药品监督管理总局发现不符合相关规定的, 可随时要求申请人暂停试验 20
21 四 实行同品种集中审评 对本公告公布之日前已经受理的相同品种, 按照统一的审评标准和尺度组织力量进行集 中审评 对不符合规定的, 及时作出不予批准的决定 ; 符合规定的, 按申报顺序依次作出审 批决定并制发批准证明文件 五 允许申请人主动撤回不符合条件的药品注册申请 对已经受理的存在研究资料缺项 数据不全 试验未完成 未与原研药进行全面比对研 究 未对杂质和毒性物质进行全面评价 处方工艺试验不完整等重大缺陷的药品注册申请, 允许申请人主动撤回, 完善后重新申报 技术审评过程中发现上述问题之一的, 直接作出不 予批准的决定 对申报资料不完整但具备审评条件的药品注册申请, 由国家食品药品监督管 理总局药品审评中心一次性告知申请人补充资料 ; 补充资料提交后, 原则上不再要求申请人 补充资料, 只作出批准或不予批准的决定 六 严格审查药品的安全性和有效性 发现有下列情形的, 国家食品药品监督管理总局及时公布相关品种名单 :(1) 活性成 分不明确 结构不清楚或疗效可能不确切的 ;(2) 安全性可能存在风险的 自名单公布之日起, 对列入上述名单的品种作以下处理 : ( 一 ) 国家食品药品监督管理总局药品评价中心将其纳入安全风险重点监测范围 凡有 证据证明该药品疗效不确切 不良反应大或者其他原因危害人体健康的, 立即撤销药品批准 文号 ( 二 ) 相关生产企业应及时开展相关产品再评价, 并于 3 年内向国家食品药品监督管理 总局提交再评价结果 逾期未提交再评价结果或未通过再评价的, 撤销药品批准文号 ( 三 ) 仿制上述品种的注册申请, 不予受理 ; 已经受理的, 不予批准 21
22 对 2008 年集中审评遗留的未批准的药品注册申请, 目前申请人仍未解决安全性 有效 性和质量可控性问题的, 以及难以确认研制资料真实性的, 一律作出不予批准的决定 七 加快临床急需等药品的审批 符合下列条件之一的, 实行单独排队, 加快审评审批 ( 一 ) 防治艾滋病 恶性肿瘤 重大传染病和罕见病等疾病的创新药注册申请 ; ( 二 ) 儿童用药注册申请 ; ( 三 ) 老年人特有和多发疾病用药注册申请 ; ( 四 ) 列入国家科技重大专项和国家重点研发计划的药品注册申请 ; ( 五 ) 使用先进技术 创新治疗手段 具有明显治疗优势的临床急需用药注册申请 ; ( 六 ) 转移到中国境内生产的创新药注册申请 ; ( 七 ) 申请人在欧盟 美国同步申请并获准开展药物临床试验的新药临床试验申请, 或 在中国境内用同一生产线生产并在欧盟 美国同步申请上市且已通过其药品审批机构现场检 查的药品注册申请 ; ( 八 ) 临床急需且专利到期前 3 年的药品临床试验申请和专利到期前 1 年的药品生产申 请 自 2015 年 12 月 1 日起, 申请人可向国家食品药品监督管理总局药品审评中心提出加快 审评的申请 国家食品药品监督管理总局会同有关部门制定和发布药品注册申请优先审评审批的有 关政策, 鼓励市场短缺和创新药品的研发和生产 国家卫生计生委 工业和信息化部根据药 品采购情况和生产供应情况建立短缺药品定期沟通机制, 提出加快审批的建议, 国家食品药 品监督管理总局会同有关部门确定纳入加快审批的范围 22
23 八 严惩临床试验数据造假行为 对已经受理的完成临床试验申报生产或进口的药品注册申请, 申请人已按要求完成自查 并报告结果的, 国家食品药品监督管理总局将根据审评进度, 逐一进行临床试验数据核查 ; 发现存在弄虚作假问题的即立案调查, 相应注册申请不予批准 对参与临床试验数据弄虚作假的申请人 临床试验机构 合同研究组织及其直接责任人, 依据 中华人民共和国药品管理法 第七十八条以及国家食品药品监督管理总局关于临床试 验数据自查核查的有关规定查处, 并将其列入黑名单, 向社会公布相关组织机构代码 人员 身份证号码等信息 涉嫌犯罪的, 移交公安机关调查处理 对临床试验数据弄虚作假的申请人, 依据 中华人民共和国药品管理法实施条例 第七 十条和 药品注册管理办法 第一百六十七条的规定, 自发现之日起,3 年内不受理其申报 该品种的药品注册申请,1 年内不受理其所有药品注册申请, 已经受理的不予批准 食品药 品监管部门将组织对该申请人此前获得的药品批准证明文件进行追溯检查, 发现弄虚作假行 为的, 依据 中华人民共和国药品管理法 第八十二条的规定, 撤销相关药品批准证明文件, 5 年内不受理其所有药品注册申请 对参与临床试验数据弄虚作假的临床试验机构, 责令限期整改, 整改完成前不接受其参 与研究的申报资料, 经整改仍不符合要求的, 取消其相关试验资格 对弄虚作假主要研究者 参与研究并已受理的所有注册申请不予批准 对同一专业出现两个及以上临床试验数据弄虚 作假行为的, 其专业内已受理的所有注册申请不予批准 ; 对临床试验机构出现三个及以上临 床试验数据弄虚作假行为的, 涉及该机构已受理的所有注册申请不予批准 对参与临床试验 数据弄虚作假的主要研究者, 食品药品监管部门将有关信息通报卫生行政部门, 由卫生行政 部门依照 中华人民共和国执业医师法 等有关规定, 追究临床试验机构直接责任人的责 23
24 任 申请人在国家食品药品监督管理总局核查前主动申请撤回的, 国家食品药品监督管理总 局公布撤回的申请人和品种名单, 不予核查及立案调查 九 引导申请人理性申报 发布 限制类药品审批目录, 对已有多个药品批准文号且有多家企业生产, 生产供应 能力已远超临床使用需求的药品注册申请予以限制 ; 限制类目录将定期更新 及时向社会公 开药品注册受理及审评信息, 引导企业有序研发和理性申报 十 规范药品注册复审工作 国家食品药品监督管理总局药品审评中心应将技术审评不予通过的审评意见告知申请 人 ; 申请人持有异议的, 可提出复审申请, 由药品审评中心组织相关领域的临床专家 药理 学家 毒理学家 统计学家 法律专家 患者代表等, 听取审评专家和申请人的意见, 公开 论证, 按少数服从多数的原则形成最终复审意见 本公告自发布之日起实施 此前发布的 药品注册管理办法 ( 原国家食品药品监管管 理局令第 28 号 ) 等相关规定, 与本公告不一致的, 以本公告为准 特此公告 食品药品监管总局 2015 年 11 月 11 日 24
25 PI 签字 : 日期 : 最高人民法院 最高人民检察院关于办理药品 医疗器械注 册申请材料造假刑事案件适用法律若干问题的解释 (2017 年 4 月 10 日最高人民法院审判委员会第 1714 次会议 2017 年 6 月 8 日最高人民检察院第十二届检察委员会第 65 次会议通过, 自 2017 年 9 月 1 日起施行 ) 为依法惩治药品 医疗器械注册申请材料造假的犯罪行为, 维护人民群众生命健康权益, 根据 中华人民共和国刑法 中华人民共和国刑事诉讼法 的有关规定, 现就办理此类刑事案件适用法律的若干问题解释如下 : 第一条药物非临床研究机构 药物临床试验机构 合同研究组织的工作人员, 故意提供虚假的药物非临床研究报告 药物临床试验报告及相关材料的, 应当认定为刑法第二百二十九条规定的 故意提供虚假证明文件 实施前款规定的行为, 具有下列情形之一的, 应当认定为刑法第二百二十九条规定的 情节严重, 以提供虚假证明文件罪处五年以下有期徒刑或者拘役, 并处罚金 : ( 一 ) 在药物非临床研究或者药物临床试验过程中故意使用虚假试验用药品的 ; ( 二 ) 瞒报与药物临床试验用药品相关的严重不良事件的 ; ( 三 ) 故意损毁原始药物非临床研究数据或者药物临床试验数据的 ; ( 四 ) 编造受试动物信息 受试者信息 主要试验过程记录 研究数据 检测数据等药物非临床研究数据或者药物临床试验数据, 影响药品安全性 有效性评价结果的 ; ( 五 ) 曾因在申请药品 医疗器械注册过程中提供虚假证明材料受过刑事处罚或者二年内受过行政处罚, 又提供虚假证明材料的 ; ( 六 ) 其他情节严重的情形 第二条实施本解释第一条规定的行为, 索取或者非法收受他人财物的, 应当依照刑法第二百二十九条第二款规定, 以提供虚假证明文件罪处五年以上十年以下有期徒刑, 并处罚金 ; 同时构成提供虚假证明文件罪和受贿罪 非国家工作人员受贿罪的, 依照处罚较重的规定定罪处罚 25
26 第三条药品注册申请单位的工作人员, 故意使用符合本解释第一条第二款规定的虚假药物非临床研究报告 药物临床试验报告及相关材料, 骗取药品批准证明文件生产 销售药品的, 应当依照刑法第一百四十一条规定, 以生产 销售假药罪定罪处罚 第四条药品注册申请单位的工作人员指使药物非临床研究机构 药物临床试验机构 合同研究组织的工作人员提供本解释第一条第二款规定的虚假药物非临床研究报告 药物临床试验报告及相关材料的, 以提供虚假证明文件罪的共同犯罪论处 具有下列情形之一的, 可以认定为前款规定的 指使, 但有相反证据的除外 : ( 一 ) 明知有关机构 组织不具备相应条件或者能力, 仍委托其进行药物非临床研究 药物临床试验的 ; ( 二 ) 支付的价款明显异于正常费用的 药品注册申请单位的工作人员和药物非临床研究机构 药物临床试验机构 合同研究组织的工作人员共同实施第一款规定的行为, 骗取药品批准证明文件生产 销售药品, 同时构成提供虚假证明文件罪和生产 销售假药罪的, 依照处罚较重的规定定罪处罚 第五条在医疗器械注册申请中, 故意提供 使用虚假的医疗器械临床试验报告及相关材料的, 参照适用本解释第一条至第四条规定 第六条单位犯本解释第一条至第五条规定之罪的, 对单位判处罚金, 并依照本解释规定的相应自然人犯罪的定罪量刑标准对直接负责的主管人员和其他直接责任人员定罪处罚 第七条对药品 医疗器械注册申请负有核查职责的国家机关工作人员, 滥用职权或者玩忽职守, 导致使用虚假证明材料的药品 医疗器械获得注册, 致使公共财产 国家和人民利益遭受重大损失的, 应当依照刑法第三百九十七条规定, 以滥用职权罪或者玩忽职守罪追究刑事责任 第八条对是否属于虚假的药物非临床研究报告 药物或者医疗器械临床试验报告及相关材料, 是否影响药品或者医疗器械安全性 有效性评价结果, 以及是否属于严重不良事件等专门性问题难以确定的, 可以根据国家药品监督管理部门设置或者指定的药品 医疗器械审评等机构出具的意见, 结合其他证据作出认定 第九条本解释所称 合同研究组织, 是指受药品或者医疗器械注册申请单位 药物非临床研究机构 药物或者医疗器械临床试验机构的委托, 从事试验方案设计 数据统计 分析测试 监查稽查等与非临床研究或者临床试验相关活动的单位 第十条本解释自 2017 年 9 月 1 日起施行 26
有证据的初筛受试者例数 ) 2.1.3* 受试者代码鉴认表或筛选 体检等原始记录涵盖受试者身份鉴别信息 ( 如姓名 住院号 / 门诊就诊号 身份证号 联系地址和联系方式等 ), 由此核查参加临床试验受试者的真实性 对受试者的相关医学判断和处理必须由本机构具有执业资格的医护人员执行并记录,
 附件 序号 药物临床试验数据现场核查要点 现场核查要点 一 Ⅱ Ⅲ 期临床试验 人体生物等效性 (BE)/ 人体药代动力学 (PK) 试验 疫苗临床试验数据现场核查要点 通用内容 1. 临床试验条件与合规性 ( 含各方在临床试验项目中职责落实 ) 1.1* 临床试验单位承担药物临床试验的条件与合规性 : 1.1.1 临床试验须在具有药物临床试验机构资格的医院内进行 ( 含具有一次性临床试验机构资格认定的批件
附件 序号 药物临床试验数据现场核查要点 现场核查要点 一 Ⅱ Ⅲ 期临床试验 人体生物等效性 (BE)/ 人体药代动力学 (PK) 试验 疫苗临床试验数据现场核查要点 通用内容 1. 临床试验条件与合规性 ( 含各方在临床试验项目中职责落实 ) 1.1* 临床试验单位承担药物临床试验的条件与合规性 : 1.1.1 临床试验须在具有药物临床试验机构资格的医院内进行 ( 含具有一次性临床试验机构资格认定的批件
公司深度研究报告
 行业点评报告 医药生物行业 2015 年 11 月 16 日 CFDA 关于药品注册审评审批若干政策的公告政策点评 核心观点 : 一 事件 近日, 国家食品药品监督管理局下发 国家食品药品监督管理总局关于 药品注册审评审批若干政策的公告 (2015 年第 230 号 ) 二 我们的观点 : 药审大趋势就是利好真正在用心投入认真做研发的企业, 以恒瑞医药为代表 ( 一 ) 一脉相承 140 号文件精神,
行业点评报告 医药生物行业 2015 年 11 月 16 日 CFDA 关于药品注册审评审批若干政策的公告政策点评 核心观点 : 一 事件 近日, 国家食品药品监督管理局下发 国家食品药品监督管理总局关于 药品注册审评审批若干政策的公告 (2015 年第 230 号 ) 二 我们的观点 : 药审大趋势就是利好真正在用心投入认真做研发的企业, 以恒瑞医药为代表 ( 一 ) 一脉相承 140 号文件精神,
国家食品药品监督管理总局关于征求《关于解决药品注册申请积压实行优先审评审批的意见(征求意见稿)》意见的公告(2015年第227号)
 国家食品药品监督管理总局关于征求 关于解决药品注册申请积压实行优先审评审批的意 见 ( 征求意见稿 ) 意见的公告 (2015 年第 227 号 ) 为加强药品注册管理, 解决当前药品注册申请积压的矛盾, 充分利用审评资源, 加快具有临床价值的新药和临床急需仿制药的研发上市, 根据 国务院关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ) 要求, 食品药品监管总局起草了 关于解决药品注册申请积压实行优先审评审批的意见
国家食品药品监督管理总局关于征求 关于解决药品注册申请积压实行优先审评审批的意 见 ( 征求意见稿 ) 意见的公告 (2015 年第 227 号 ) 为加强药品注册管理, 解决当前药品注册申请积压的矛盾, 充分利用审评资源, 加快具有临床价值的新药和临床急需仿制药的研发上市, 根据 国务院关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ) 要求, 食品药品监管总局起草了 关于解决药品注册申请积压实行优先审评审批的意见
广发报告
 行业跟踪 医药生物证券研究报告 医药生物行业 核心观点 : 最严药品审评令, 压力与机遇并存 事件 : 药监局近期发布加强药品审评的公告 7 月 31 日, 国家食品药品监督管理总局 (CFDA) 发布 关于征求加快解决药品注册申请积压问题的若干政策意见的公告 (140 号文 ), 为解决药品注册申请积压的问题向公众征求意见 此前,7 月 22 日 CFDA 还发布过 关于开展药物临床试验数据自查核查工作的公告
行业跟踪 医药生物证券研究报告 医药生物行业 核心观点 : 最严药品审评令, 压力与机遇并存 事件 : 药监局近期发布加强药品审评的公告 7 月 31 日, 国家食品药品监督管理总局 (CFDA) 发布 关于征求加快解决药品注册申请积压问题的若干政策意见的公告 (140 号文 ), 为解决药品注册申请积压的问题向公众征求意见 此前,7 月 22 日 CFDA 还发布过 关于开展药物临床试验数据自查核查工作的公告
年检查品种数量
 生物等效性试验数据核查 发现的主要问题及分析 王佳楠 食品药品审核查验中心,CFDA wangjn@cfdi.org.cn 2017.2, 北京 1 内容 生物等效性试验的核查依据 生物等效性试验核查要点 核查中的常见问题 2 核查依据 药物临床试验数据现场核查要点 药物 Ⅰ 期临床试验管理指导原则 ( 试行 ) 药物临床试验生物样本分析实验室管理指南 ( 试行 ) 生物样本定量分析方法验证指导原则
生物等效性试验数据核查 发现的主要问题及分析 王佳楠 食品药品审核查验中心,CFDA wangjn@cfdi.org.cn 2017.2, 北京 1 内容 生物等效性试验的核查依据 生物等效性试验核查要点 核查中的常见问题 2 核查依据 药物临床试验数据现场核查要点 药物 Ⅰ 期临床试验管理指导原则 ( 试行 ) 药物临床试验生物样本分析实验室管理指南 ( 试行 ) 生物样本定量分析方法验证指导原则
2015年江苏省药品注册管理工作年度报告
 药品审评审批改革中的注册管理 2017 年 2 月. 南京 A 药品审评审批改革目标 B 药品审评审批改革措施 1 药品审评审批改革目标 国务院关于改革药品医疗器械审评审批制度的意见 国发 2015 44 号 总体要求 : 围绕保障公众健康和促进医药产业转型升级, 以提高药品质量为核心, 以解决注册申请积压为重点, 以鼓励研究和创制新药为导向, 加快建立更加科学的审评审批体系 主要目标 : 提高审评审批质量
药品审评审批改革中的注册管理 2017 年 2 月. 南京 A 药品审评审批改革目标 B 药品审评审批改革措施 1 药品审评审批改革目标 国务院关于改革药品医疗器械审评审批制度的意见 国发 2015 44 号 总体要求 : 围绕保障公众健康和促进医药产业转型升级, 以提高药品质量为核心, 以解决注册申请积压为重点, 以鼓励研究和创制新药为导向, 加快建立更加科学的审评审批体系 主要目标 : 提高审评审批质量
总经理工作报告
 关于广东华南药业集团有限公司胶囊剂药品铬限量检验合格的公示 按照国家食品药品监督管理局要求, 我公司已完成 2012 年 6 月 19 日前生产的 9 个品种,330 批次胶囊剂药品的铬限量检验, 我 公司产品全部符合规定 现将检验结果公示如下 : 序号 药品名称 批准文号 产品批号 铬含量检验结果 检验报告书编号 检验机构 1 利福平胶囊 国药准字 H44020771 100302 符合规定 12051527(S)
关于广东华南药业集团有限公司胶囊剂药品铬限量检验合格的公示 按照国家食品药品监督管理局要求, 我公司已完成 2012 年 6 月 19 日前生产的 9 个品种,330 批次胶囊剂药品的铬限量检验, 我 公司产品全部符合规定 现将检验结果公示如下 : 序号 药品名称 批准文号 产品批号 铬含量检验结果 检验报告书编号 检验机构 1 利福平胶囊 国药准字 H44020771 100302 符合规定 12051527(S)
Microsoft Word - GCP
 附 件 1 疫 苗 临 床 试 验 质 量 管 理 指 导 原 则 ( 试 行 ) 第 一 章 总 则 第 一 条 为 加 强 疫 苗 临 床 试 验 的 管 理, 提 高 疫 苗 临 床 试 验 的 质 量, 根 据 药 品 注 册 管 理 办 法 药 物 临 床 试 验 质 量 管 理 规 范 (GCP) 等, 制 定 本 指 导 原 则 第 二 条 本 指 导 原 则 适 用 于 国 家 药
附 件 1 疫 苗 临 床 试 验 质 量 管 理 指 导 原 则 ( 试 行 ) 第 一 章 总 则 第 一 条 为 加 强 疫 苗 临 床 试 验 的 管 理, 提 高 疫 苗 临 床 试 验 的 质 量, 根 据 药 品 注 册 管 理 办 法 药 物 临 床 试 验 质 量 管 理 规 范 (GCP) 等, 制 定 本 指 导 原 则 第 二 条 本 指 导 原 则 适 用 于 国 家 药
,,,,, 5,,, :,,,,,, ( ), 6,,,,,,,,, 7,, ( ),,,,,,,,,, 8,,,,,,,,,,,,,,,,, 9,,,,, :, :, :, :,,,,,
 :. /..... 死刑复核法律监督制度研究 * 万春 检察机关对死刑复核实行法律监督, 符合人大制度关于权力监督制约的原理, 不影响最高人民法院应有的诉讼地位和独立性 权威性, 体现了检察官客观性义务的要求, 具有基本法律依据 开展死刑复核法律监督应遵循严格限制并减少死刑 切实保障人权 维护公共利益 公平 及时 突出重点等原则 检察机关在死刑复核中的诉讼地位不是公诉人, 而是法律监督者 检察机关可以通过备案审查
:. /..... 死刑复核法律监督制度研究 * 万春 检察机关对死刑复核实行法律监督, 符合人大制度关于权力监督制约的原理, 不影响最高人民法院应有的诉讼地位和独立性 权威性, 体现了检察官客观性义务的要求, 具有基本法律依据 开展死刑复核法律监督应遵循严格限制并减少死刑 切实保障人权 维护公共利益 公平 及时 突出重点等原则 检察机关在死刑复核中的诉讼地位不是公诉人, 而是法律监督者 检察机关可以通过备案审查
2015 年 9 月 24 日 2015 年 10 月 15 日 2015 年 11 月 6 日 2015 年 11 月 10 日 2015 年 11 月 11 日 2015 年 11 月 26 日 2015 年 12 月 3 日 2015 年 12 月 7 日 2015 年 12 月 14 日 2
 药物临床试验数据核查阶段性报告 (2015 年 7 月 -2017 年 6 月 ) 为落实国务院 关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ) 要求, 国家食品药品监督管理总局 ( 以下 简称总局 ) 于 2015 年 7 月发布了 关于开展药物临床试验数据 自查核查工作的公告 (2015 年第 117 号 ) 两年来, 在总局的坚 强领导下, 国家食品药品监督管理总局食品药品审核查验中心
药物临床试验数据核查阶段性报告 (2015 年 7 月 -2017 年 6 月 ) 为落实国务院 关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ) 要求, 国家食品药品监督管理总局 ( 以下 简称总局 ) 于 2015 年 7 月发布了 关于开展药物临床试验数据 自查核查工作的公告 (2015 年第 117 号 ) 两年来, 在总局的坚 强领导下, 国家食品药品监督管理总局食品药品审核查验中心
Ñ Ö Ö
 Ö Ö Ö Ñ Ö Ö Ö Ö Ö Ö Ñ Ö Ö Ù Ñ Ö Ö Ñ Ö Ö Ö Ö Ö Ö 中国药典 年版药用辅料标准起草工作交流会 月 日于西宁召开 国家药典委员会于 年 月 日组织承担药用辅料标准起草任务的 个药品检验所在青海省西宁市召开辅料 标准起草工作交流会 国家局药品注册司派员参加了会议 青海省食品药品监督管理局魏富财副局长到会致欢迎词 中国药 品生物制品检定所和上海市食品药品检验所就药用辅料标准起草工作进行了大会经验交流
Ö Ö Ö Ñ Ö Ö Ö Ö Ö Ö Ñ Ö Ö Ù Ñ Ö Ö Ñ Ö Ö Ö Ö Ö Ö 中国药典 年版药用辅料标准起草工作交流会 月 日于西宁召开 国家药典委员会于 年 月 日组织承担药用辅料标准起草任务的 个药品检验所在青海省西宁市召开辅料 标准起草工作交流会 国家局药品注册司派员参加了会议 青海省食品药品监督管理局魏富财副局长到会致欢迎词 中国药 品生物制品检定所和上海市食品药品检验所就药用辅料标准起草工作进行了大会经验交流
<4D F736F F D20D2A9CEEFC1D9B4B2CAD4D1E9CEC4B5B5C4BFC2BC3FB9E3B6ABB9B2CAB62E646F6378>
 药物临床试验文档目录 广东共识 ( 广东省药学会 2017 年 12 月 22 日印发 ) 药物临床试验资料是试验全过程的记录及体现, 规范统一的试验资料有利于促进临床试验的顺利进行 但目前各机构及各伦理委员会对试验资料的要求迥异, 试验递交的资料也形式不一, 造成相关资料管理混乱, 影响临床试验的进行 迄今, 在试验资料规范化操作和管理领域尚缺乏共识 指南或标准供借鉴与遵循, 因此, 在研究资料递交的实施过程中,
药物临床试验文档目录 广东共识 ( 广东省药学会 2017 年 12 月 22 日印发 ) 药物临床试验资料是试验全过程的记录及体现, 规范统一的试验资料有利于促进临床试验的顺利进行 但目前各机构及各伦理委员会对试验资料的要求迥异, 试验递交的资料也形式不一, 造成相关资料管理混乱, 影响临床试验的进行 迄今, 在试验资料规范化操作和管理领域尚缺乏共识 指南或标准供借鉴与遵循, 因此, 在研究资料递交的实施过程中,
药物临床试验机构资格认定和夊核检查要点
 药物临床试验相关法规 曹彩 2013 年 4 月 12 日 药物临床试验相关法规 中华人民共和国药品管理法 中华人民共和国药品管理法实施条例 药品注册管理办法 药物临床试验质量管理规范 药物临床试验机构资格认定办法 药品注册现场核查管理规定 药物临床试验伦理审查工作指导原则 药物 Ⅰ 期临床试验管理指导原则 ( 试行 ) 药物临床试验生物样本分析实验室管理指南 ( 试行 ) 药物临床试验机构资格认定复核检查标准
药物临床试验相关法规 曹彩 2013 年 4 月 12 日 药物临床试验相关法规 中华人民共和国药品管理法 中华人民共和国药品管理法实施条例 药品注册管理办法 药物临床试验质量管理规范 药物临床试验机构资格认定办法 药品注册现场核查管理规定 药物临床试验伦理审查工作指导原则 药物 Ⅰ 期临床试验管理指导原则 ( 试行 ) 药物临床试验生物样本分析实验室管理指南 ( 试行 ) 药物临床试验机构资格认定复核检查标准
( 二 ) 负责所受理已上市药品改变剂型 改变给药途径注册申请的生产现场检查 ; ( 三 ) 负责所受理仿制药注册申请的生产现场检查 ; ( 四 ) 负责所受理药品生产技术转让 变更处方和生产工艺可能影响产品质量等补充申请的生产现场检查 ; ( 五 ) 负责本行政区域内的有因核查 研制工作跨省进行的
 关于印发药品注册现场核查管理规定的通知 国食药监注 [2008]255 号 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总后卫生部药品监督管理局 : 为规范药品研制秩序, 保证药品注册现场核查工作质量, 根据 药品注册管理办法 的有关规定, 国家局组织制定了 药品注册现场核查管理规定, 现予印发, 请遵照执行 药品注册现场核查管理规定 第一章总则 国家食品药品监督管理局 二 八年五月二十三日
关于印发药品注册现场核查管理规定的通知 国食药监注 [2008]255 号 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总后卫生部药品监督管理局 : 为规范药品研制秩序, 保证药品注册现场核查工作质量, 根据 药品注册管理办法 的有关规定, 国家局组织制定了 药品注册现场核查管理规定, 现予印发, 请遵照执行 药品注册现场核查管理规定 第一章总则 国家食品药品监督管理局 二 八年五月二十三日
三 自 2004 年 8 月 1 日起, 对原国家药品临床研究基地将进行复核检查 国家药品临床研究基地应总结药物临床试验的经验, 完善药物临床试验的管理和质量保证体系, 参照 药物临床试验机构资格认定标准 进行自查, 提出资格认定的复核检查申请 国家药品临床研究基地增补专业资格认定的申请亦可同时进行
 关于印发 药物临床试验机构资格认定办法 ( 试行 ) 的通知国食药监安 [2004]44 号 2004 年 02 月 19 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 卫生厅 ( 局 ), 解放军总后卫生部 : 为贯彻执行 中华人民共和国药品管理法 及 中华人民共和国药品管理法实施条例, 加强药物临床试验的监督管理, 确保药物临床试验在具有药物临床试验资格的机构中进行,
关于印发 药物临床试验机构资格认定办法 ( 试行 ) 的通知国食药监安 [2004]44 号 2004 年 02 月 19 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 卫生厅 ( 局 ), 解放军总后卫生部 : 为贯彻执行 中华人民共和国药品管理法 及 中华人民共和国药品管理法实施条例, 加强药物临床试验的监督管理, 确保药物临床试验在具有药物临床试验资格的机构中进行,
中医类 (E) 高密市井沟镇卫生院 针灸推拿 中医类 (E) 高密市井沟镇卫生院 针灸推拿 中医类 (E) 高密市井沟镇卫生院 中药 中医类 (E) 高密市井沟镇卫生院 中药
 现将 2018 年高密市卫生计生事业单位公开招聘工作人员进入面试人员名单公示如下 : 注 : 现场资格审查时间另行公告, 请考生及时关注中国高密网站发布的相关信息, 因本人原因错过重要信息而影响考试聘用的, 责任自负 高密市卫生和计划生育局 2018 年 8 月 24 日 考号 报考专业 报考单位 报考岗位 成绩 名次 3707270818 综合类 (A) 高密市爱国卫生运动委员会办公室 法律 73.5
现将 2018 年高密市卫生计生事业单位公开招聘工作人员进入面试人员名单公示如下 : 注 : 现场资格审查时间另行公告, 请考生及时关注中国高密网站发布的相关信息, 因本人原因错过重要信息而影响考试聘用的, 责任自负 高密市卫生和计划生育局 2018 年 8 月 24 日 考号 报考专业 报考单位 报考岗位 成绩 名次 3707270818 综合类 (A) 高密市爱国卫生运动委员会办公室 法律 73.5
行业跟踪 医药生物 附 : 国务院关于改革药品医疗器械审评审批制度的意见 各省 自治区 直辖市人民政府, 国务院各部委 各直属机构 : 近年来, 我国医药产业快速发展, 药品医疗器械质量和标准不断提高, 较好地满足了公众用药需要 与此同时, 药品医疗器械审评审批中存在的问题也日益突出, 注册申请资料
 行业跟踪 医药生物证券研究报告 医药生物行业 核心观点 : 药 械审评改革, 创新药企最为受益 国务院近日发布 关于改革药品医疗器械审评审批制度的意见 国务院近日发布关于改革药品医疗器械审评审批制度的意见, 提出了改革的主要目标 主要任务以及保障措施 我们认为, 本次以国务院名义发布意见, 体现出国家层面高度重视药品器械审评, 未来新药审评有望提速 注册申请积压的问题有望缓解, 利于医药整体行业 新产品审批缓慢,
行业跟踪 医药生物证券研究报告 医药生物行业 核心观点 : 药 械审评改革, 创新药企最为受益 国务院近日发布 关于改革药品医疗器械审评审批制度的意见 国务院近日发布关于改革药品医疗器械审评审批制度的意见, 提出了改革的主要目标 主要任务以及保障措施 我们认为, 本次以国务院名义发布意见, 体现出国家层面高度重视药品器械审评, 未来新药审评有望提速 注册申请积压的问题有望缓解, 利于医药整体行业 新产品审批缓慢,
原始编号 :H 受理号 :X 批件号 :(2003) 国药标字 Xˉ332ˉ9ˉ2005 号 汉语拼音 : \/ e uo O 尸 英文 / 拉丁名 :MelOXicamTablets 注册分类化学药品第四类试行 WS310(Xˉ261)-2002 企业名称 : 浙江仙
 局 理 管件督肺监准品标 瞄 食国 家 国 原始编号 :H20020146 受理号 :X0402492 批件号 :(2003) 国药标字 Xˉ332ˉ8ˉ2005 号 汉语拼音 : \/ e uo) 尸 英文 / 拉丁名 :MeloXiCamTabletS 注册分类化学药品第四类试行 WS861(X 一 699)ˉ2001 企业名称 : 丹阳市药业有限责任公司 生产地址 : 丹阳市开泰路 11 号
局 理 管件督肺监准品标 瞄 食国 家 国 原始编号 :H20020146 受理号 :X0402492 批件号 :(2003) 国药标字 Xˉ332ˉ8ˉ2005 号 汉语拼音 : \/ e uo) 尸 英文 / 拉丁名 :MeloXiCamTabletS 注册分类化学药品第四类试行 WS861(X 一 699)ˉ2001 企业名称 : 丹阳市药业有限责任公司 生产地址 : 丹阳市开泰路 11 号
模板
 模版 3: 药物临床试验机构资格认定指导 ---Ⅰ 期临床试验 ( 临床研究 分析测试 ) 基本信息现场检查对象 : 现场检查日期 : 现场检查小组派出部门 : 人员组成 : 姓名 : 专业 : 职务 / 职称 : 机构 Ⅰ 期临床试验 ( 临床研究 分析测试 ) 检查主要内容 : 一 I 期临床试验研究室负责人 1. I 期临床试验研究室负责人的专业背景 2. I 期临床试验研究室负责人的药物临床研究基础二
模版 3: 药物临床试验机构资格认定指导 ---Ⅰ 期临床试验 ( 临床研究 分析测试 ) 基本信息现场检查对象 : 现场检查日期 : 现场检查小组派出部门 : 人员组成 : 姓名 : 专业 : 职务 / 职称 : 机构 Ⅰ 期临床试验 ( 临床研究 分析测试 ) 检查主要内容 : 一 I 期临床试验研究室负责人 1. I 期临床试验研究室负责人的专业背景 2. I 期临床试验研究室负责人的药物临床研究基础二
<4D F736F F D20A1B6B1B1BEA9CAD0D2A9CEEFC1D9B4B2CAD4D1E9BBFAB9B9C8D5B3A3BCE0B6BDBCECB2E9B1EAD7BCA1B7B7A2B2BCB8E E646F6378>
 北京市药物临床试验机构日常监督检查标准 ( 试行 ) 总则一 为加强北京市药物临床试验机构监督管理, 提升药物临床试验质量管理水平, 根据 药物临床试验质量管理规范 药物临床试验机构资格认定办法 ( 试行 ) 药物临床试验机构资格认定复核检查标准 药物临床试验伦理审查工作指导原则 国家食品药品监督管理总局关于药物临床试验信息平台的公告 等相关文件, 制定本检查标准 二 本检查标准适用于北京市药物临床试验机构的日常监督检查
北京市药物临床试验机构日常监督检查标准 ( 试行 ) 总则一 为加强北京市药物临床试验机构监督管理, 提升药物临床试验质量管理水平, 根据 药物临床试验质量管理规范 药物临床试验机构资格认定办法 ( 试行 ) 药物临床试验机构资格认定复核检查标准 药物临床试验伦理审查工作指导原则 国家食品药品监督管理总局关于药物临床试验信息平台的公告 等相关文件, 制定本检查标准 二 本检查标准适用于北京市药物临床试验机构的日常监督检查
第二条药品注册现场核查分为研制现场核查和生产现场检查 药品注册研制现场核查, 是指药品监督管理部门对所受理药品注册申请的研制情况进行 实地确证, 对原始记录进行审查, 确认申报资料真实性 准确性和完整性的过程 药品注册生产现场检查, 是指药品监督管理部门对所受理药品注册申请批准上市前的样 品批量生产
 关于印发药品注册现场核查管理规定的通知 国食药监注 [2008]255 号 2008 年 05 月 23 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总后卫生部药品监督管理 局 : 为规范药品研制秩序, 保证药品注册现场核查工作质量, 根据 药品注册管理办法 的有关 规定, 国家局组织制定了 药品注册现场核查管理规定, 现予印发, 请遵照执行 国家食品药品监督管理局 二
关于印发药品注册现场核查管理规定的通知 国食药监注 [2008]255 号 2008 年 05 月 23 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总后卫生部药品监督管理 局 : 为规范药品研制秩序, 保证药品注册现场核查工作质量, 根据 药品注册管理办法 的有关 规定, 国家局组织制定了 药品注册现场核查管理规定, 现予印发, 请遵照执行 国家食品药品监督管理局 二
浙建许撤决字 2018 第 154 号 姚海波 : 经调查核实, 你在建造师执业资格注册 ( 二级建造师初始注册 ) 事项办件中提交了虚假的申报材料, 存在以欺骗手段取得许可的行为 我厅于 2018 年 8 月 27 日向你发出 撤销行政许可告知书, 并已送达给你 你在规定的期限内未向我厅提出书面陈
 浙建许撤决字 2018 第 61 号 袁茂倩 : 经调查核实, 你在建造师执业资格注册 ( 二级建造师初始注册 ) 事项办件中提交了虚假的申报材料, 存在以欺骗手段取得许可的行为 我厅于 2018 年 8 月 27 日向你发出 撤销行政许可告知书, 并已送达给你 你在规定的期限内未向我厅提出书面陈述 申辩 ( 或陈述 申辩未被采纳 ) 根据 中华人民共和国行政许可法 第六十九条 第七十九条之规定,
浙建许撤决字 2018 第 61 号 袁茂倩 : 经调查核实, 你在建造师执业资格注册 ( 二级建造师初始注册 ) 事项办件中提交了虚假的申报材料, 存在以欺骗手段取得许可的行为 我厅于 2018 年 8 月 27 日向你发出 撤销行政许可告知书, 并已送达给你 你在规定的期限内未向我厅提出书面陈述 申辩 ( 或陈述 申辩未被采纳 ) 根据 中华人民共和国行政许可法 第六十九条 第七十九条之规定,
中国科学技术大学 材料工程 05 校外调剂 0870 化学工程 吉林大学 应用化学 05 校外调剂 0870 化学工程 四川大学 制药
 045700000787 东北大学 07030 分析化学 05 校外调剂 07030 无机化学 68 66 94 04 34 063700000004 沈阳药科大学 07030 分析化学 04 校内跨专业调剂 070303 有机化学 73 56 9 00 30 0007008903 北京大学 0780Z 药学类 05 校外调剂 070303 有机化学 75 67 09 8 4 085750830 苏州大学
045700000787 东北大学 07030 分析化学 05 校外调剂 07030 无机化学 68 66 94 04 34 063700000004 沈阳药科大学 07030 分析化学 04 校内跨专业调剂 070303 有机化学 73 56 9 00 30 0007008903 北京大学 0780Z 药学类 05 校外调剂 070303 有机化学 75 67 09 8 4 085750830 苏州大学
国家食品药品监督管理总局办公厅 食品药品监管总局办公厅 公开征求 药品注册管理办法 ( 修订稿 ) 意见 为贯彻落实 国务院关于改革药品医疗器械审评审批制度的意见 ( 国发 号 ), 国家食品药品监督管理总局组织对 药品注册管理办法 进行了修订, 起草了 药品注册管理办法 ( 修订稿
 发 药化注册司 文 要 报 2016-07-22 根据总局整体工作安排 我司组织对 药品注册管理办 法 进行修订 并形成 药品注册管理办法 修订稿 经 以签报形式向总局领导请示同意 现以公告形式挂网征求意 见 联系人 方维 - 1 - 电话 0722 国家食品药品监督管理总局办公厅 食品药品监管总局办公厅 公开征求 药品注册管理办法 ( 修订稿 ) 意见 为贯彻落实 国务院关于改革药品医疗器械审评审批制度的意见
发 药化注册司 文 要 报 2016-07-22 根据总局整体工作安排 我司组织对 药品注册管理办 法 进行修订 并形成 药品注册管理办法 修订稿 经 以签报形式向总局领导请示同意 现以公告形式挂网征求意 见 联系人 方维 - 1 - 电话 0722 国家食品药品监督管理总局办公厅 食品药品监管总局办公厅 公开征求 药品注册管理办法 ( 修订稿 ) 意见 为贯彻落实 国务院关于改革药品医疗器械审评审批制度的意见
Microsoft Word - 7月-药政法规导读
 天士力研究院内部刊物 药政法规导读 ( 月刊,2015 年 7 月 ) 顾 主 问 : 孙鹤 周水平 李长文 编 : 李鸿彬 副主编 : 陆文亮 丁文侠 马洁 李兵 凌芳 孙爽 编 委 : 韩宝玲 孙倩 韩世柳 李杨 林超 主办单位 : 研究院药政事务中心 前 言 多年来, 天士力控股集团有限公司以大健康理念为指导, 形成 一个核心带两翼 的产业发展格局 生物医药产业作为天士力核心产业, 其发展受国家产业政策和法规影响很大
天士力研究院内部刊物 药政法规导读 ( 月刊,2015 年 7 月 ) 顾 主 问 : 孙鹤 周水平 李长文 编 : 李鸿彬 副主编 : 陆文亮 丁文侠 马洁 李兵 凌芳 孙爽 编 委 : 韩宝玲 孙倩 韩世柳 李杨 林超 主办单位 : 研究院药政事务中心 前 言 多年来, 天士力控股集团有限公司以大健康理念为指导, 形成 一个核心带两翼 的产业发展格局 生物医药产业作为天士力核心产业, 其发展受国家产业政策和法规影响很大
药品注册管理办法 ( 局令第 28 条 ) 为保证药品的安全 有效和质量可控, 规范药品注册行为, 根据 中华人民共和国药品管理法 ( 以下简称 药品管理法 ) 中华人民共和国行政许可法 ( 以下简称 行政许可法 ) 中华人民共和国药品管理法实施条例 ( 以下简称 药品管理法实施条例 ) 文件规定,
 第一期 成都普思生物科技股份有限公司 2017 年 4 月 5 日 本期目录 药品注册管理办法 ( 局令第 28 条 ) 药品流通监督管理办法 ( 局令第 26 号 ) 国务院关于印发国家药品安全 十二五 规划的通知 ( 国发 [2012]5 号 ) 国务院关于改革药品医疗器械神评审批制度的意见 ( 国发 2015 44 号 ) 国家食药监局关于化学药生物等效性试验实行备案管理的公告 (2015 年第
第一期 成都普思生物科技股份有限公司 2017 年 4 月 5 日 本期目录 药品注册管理办法 ( 局令第 28 条 ) 药品流通监督管理办法 ( 局令第 26 号 ) 国务院关于印发国家药品安全 十二五 规划的通知 ( 国发 [2012]5 号 ) 国务院关于改革药品医疗器械神评审批制度的意见 ( 国发 2015 44 号 ) 国家食药监局关于化学药生物等效性试验实行备案管理的公告 (2015 年第
附件1
 实际控制关系账户申报表 (K-1 表 ) 大连商品交易所 第一部分 : 申报人信息 * 姓名 * 个人客户 * 身份证号码 * 联系电话 * 组织机构代码 * 联系电话 单位客户 客户类型 主营业务 A. 生产企业 B. 加工企业 C. 贸易公司 D. 投资公司 E. 其他 ( 请详细说明 ) 第二部分 : 实际控制关系账户信息 1 是否实际控制其他主体 ( 个人客户或单位客户 ) 的期货交易? 如果是,
实际控制关系账户申报表 (K-1 表 ) 大连商品交易所 第一部分 : 申报人信息 * 姓名 * 个人客户 * 身份证号码 * 联系电话 * 组织机构代码 * 联系电话 单位客户 客户类型 主营业务 A. 生产企业 B. 加工企业 C. 贸易公司 D. 投资公司 E. 其他 ( 请详细说明 ) 第二部分 : 实际控制关系账户信息 1 是否实际控制其他主体 ( 个人客户或单位客户 ) 的期货交易? 如果是,
天津市 06 年度卫生系统公开招聘事业单位工作人员计划 结核病防治所 结核病防治所 结核病防治所 结核病防治所结核病防治所疾病预防控制中心疾病预防控制中心 中心血站 0 专技岗 0 专技岗 0 0 专技岗 0 0 专技岗 专技岗 专技岗 专技岗 0 03
 天津市 06 年度卫生系统公开招聘事业单位工作人员计划 0 专技岗 0 0 专技岗 0 0 专技岗 3 03 0 专技岗 4 04 0 专技岗 5 05 0 专技岗 6 06 0 专技岗 7 07 0 专技岗 8 08 0 专技岗 0 0 专技岗 0 0 招聘招聘条件招聘代人数简介专业学历其他码 从事临床麻醉工作 从事临床药学工作 从事放疗物理师工作从事临床影像诊断工作 从事临床影像技术工作 0 临床医学
天津市 06 年度卫生系统公开招聘事业单位工作人员计划 0 专技岗 0 0 专技岗 0 0 专技岗 3 03 0 专技岗 4 04 0 专技岗 5 05 0 专技岗 6 06 0 专技岗 7 07 0 专技岗 8 08 0 专技岗 0 0 专技岗 0 0 招聘招聘条件招聘代人数简介专业学历其他码 从事临床麻醉工作 从事临床药学工作 从事放疗物理师工作从事临床影像诊断工作 从事临床影像技术工作 0 临床医学
三 消除阶段的监测 2
 中疾控传防发 2015 139 号附件 全国消除疟疾监测方案 (2015 版 ) 一 原则与目的 二 监测相关定义 1 三 消除阶段的监测 2 3 4 5 6 7 8 四 消除后阶段的监测 9 10 11 五 数据的收集 分析和反馈 六 监测能力维持 12 13 七 质量控制 14 八 组织管理 15 九 附件和附表 16 附件 1 一 调查时间 二 调查方法 三 注意事项 17 附件 2 一 监测时间
中疾控传防发 2015 139 号附件 全国消除疟疾监测方案 (2015 版 ) 一 原则与目的 二 监测相关定义 1 三 消除阶段的监测 2 3 4 5 6 7 8 四 消除后阶段的监测 9 10 11 五 数据的收集 分析和反馈 六 监测能力维持 12 13 七 质量控制 14 八 组织管理 15 九 附件和附表 16 附件 1 一 调查时间 二 调查方法 三 注意事项 17 附件 2 一 监测时间
新政策下的IND技术审评策略和要点
 2016 年中国银川药物非临床安全性评价实验设计和数据分析学术研讨会暨第二届 SD 高级培训班 新政策下的 IND 技术审评策略和要点 王海学 2016 年 8 月 13 日 一 关于 IND 技术审评的相关政策法规 技术审评的政策法规依据 2016 中国银川年药物非临床安全性评价实验设计和数据分析学术研讨会暨第二届 SD 高级培训班 法律 法规 指南 2016 中国银川年近期相关政策法规药物非临床安全性评价实验设计和数据分析学术研讨会
2016 年中国银川药物非临床安全性评价实验设计和数据分析学术研讨会暨第二届 SD 高级培训班 新政策下的 IND 技术审评策略和要点 王海学 2016 年 8 月 13 日 一 关于 IND 技术审评的相关政策法规 技术审评的政策法规依据 2016 中国银川年药物非临床安全性评价实验设计和数据分析学术研讨会暨第二届 SD 高级培训班 法律 法规 指南 2016 中国银川年近期相关政策法规药物非临床安全性评价实验设计和数据分析学术研讨会
生命科学技术学院 生物技术 2016 级生技班 临床医学 儿科学 临床医学 第二临床学院 精神医学 2016 级精医 01 班 临床医学 麻醉学 临床医学 外语学院 英语 2016 级英语 01
 生命科学技术学院 生物技术 2016 级生技班 20161280007 儿科学 临床医学 63.5 83.88 75.7 儿科学 心理学院 应用心理学 2016 级应心 01 班 20161210113 儿科学 医学检验技术 59 83.39 73.6 儿科学 护理学院 护理学 2016 级护理 02 班 20161160203 儿科学 60.5 81.94 73.4 儿科学 外语学院 英语 2016
生命科学技术学院 生物技术 2016 级生技班 20161280007 儿科学 临床医学 63.5 83.88 75.7 儿科学 心理学院 应用心理学 2016 级应心 01 班 20161210113 儿科学 医学检验技术 59 83.39 73.6 儿科学 护理学院 护理学 2016 级护理 02 班 20161160203 儿科学 60.5 81.94 73.4 儿科学 外语学院 英语 2016
刑法第 141 条 生产 销售假药罪 生产 销售假药的, 处三年以下有期徒刑或者拘役, 并处罚金 ; 对人体健康造成严重危害或者有其他严重情节的, 处三年以上十年以下有期徒刑, 并处罚金 ; 致人死亡或者有其他特别严重情节的, 处十年以上有期徒刑 无期徒刑或者死刑, 并处罚金或者没收财产 本条所称假
 一表读懂两高关于办理危害药品安全刑案适用法律若干问题的解释 北京市中伦文德 ( 成都 ) 律师事务所王志坚 张雨薇律师 最高人民法院 最高人民检察院于 2014 年 11 月 18 日公布了 最高人民法院 最高人民检察院关于办理危害药品安全刑事案件适用法律若干问题的解释 ( 简称 14 版 解释 ), 颁布施行后, 同时废止 最高人民法院 最高人民检察院关于办理生产 销售假药 劣药刑事案件具体应用法律若干问题的解释
一表读懂两高关于办理危害药品安全刑案适用法律若干问题的解释 北京市中伦文德 ( 成都 ) 律师事务所王志坚 张雨薇律师 最高人民法院 最高人民检察院于 2014 年 11 月 18 日公布了 最高人民法院 最高人民检察院关于办理危害药品安全刑事案件适用法律若干问题的解释 ( 简称 14 版 解释 ), 颁布施行后, 同时废止 最高人民法院 最高人民检察院关于办理生产 销售假药 劣药刑事案件具体应用法律若干问题的解释
儿科学 儿科学 儿科学 儿科学 儿科学 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 耳鼻咽喉科学 ( 专业学位 ) 非定向 全国统考
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
<4D6963726F736F667420506F776572506F696E74202D20D2BDC1C6C6F7D0B5BACDCCE5CDE2D5EFB6CFCAD4BCC1C1D9B4B2CAD4D1E9C5E0D1B52D323031352E352E31382E707074205BBCE6C8DDC4A3CABD5D>
 医 疗 器 械 临 床 试 验 法 规 介 绍 和 质 控 问 题 王 悦 药 物 医 疗 器 械 医 疗 器 械 研 发 过 程 前 期 研 发 物 理 和 化 学 性 能 评 价 型 式 检 验 安 全 性 评 价 生 物 学 评 价 ( 与 人 体 接 触 ) 动 物 实 验 临 床 试 验 上 市 销 售 医 疗 器 械 临 床 试 验 相 关 法 规 药 物 和 医 疗 器 械 分 类 的
医 疗 器 械 临 床 试 验 法 规 介 绍 和 质 控 问 题 王 悦 药 物 医 疗 器 械 医 疗 器 械 研 发 过 程 前 期 研 发 物 理 和 化 学 性 能 评 价 型 式 检 验 安 全 性 评 价 生 物 学 评 价 ( 与 人 体 接 触 ) 动 物 实 验 临 床 试 验 上 市 销 售 医 疗 器 械 临 床 试 验 相 关 法 规 药 物 和 医 疗 器 械 分 类 的
2014 年度军队文职人员招聘信息
 序号 1 军事交通学院讲师 研究生 : 新闻传播学本科 : 新闻传播学类 天津 022-84657561 2 军事交通学院讲师 研究生 : 俄语语言文学本科 : 俄语 天津 022-84657561 3 军事交通学院讲师 1 硕研以上音乐与舞蹈学天津 022-84657561 4 军事交通学院药师 研究生 : 药学本科 : 药学类 天津 022-84657561 5 军事交通学院护师 3 大专以上
序号 1 军事交通学院讲师 研究生 : 新闻传播学本科 : 新闻传播学类 天津 022-84657561 2 军事交通学院讲师 研究生 : 俄语语言文学本科 : 俄语 天津 022-84657561 3 军事交通学院讲师 1 硕研以上音乐与舞蹈学天津 022-84657561 4 军事交通学院药师 研究生 : 药学本科 : 药学类 天津 022-84657561 5 军事交通学院护师 3 大专以上
<4D F736F F D D2A9CEEFC1D9B4B2CAD4D1E9D4CBD0D0B9DCC0EDD6C6B6C8BACDC1F7B3CCA3A B8FCD0C2A3A92E646F6378>
 SOP-CRC-GL-006.05 药物临床试验运行管理制度和流程 Ⅰ. 目的 : 遵照中国 GCP 及 ICH-GCP 要求, 参照国内 外开展药物临床试验的经验, 结合本机构临床试验的特点, 制定本制度与流程 Ⅱ. 范围 : 适用于本机构药物临床试验 Ⅲ. 规程 : 1. 立项准备 1.1 申办者 /CRO 若有意在我院开展药物临床试验, 需首先与本机构就研究科室 等相关问题进行商洽 1.2 申办者
SOP-CRC-GL-006.05 药物临床试验运行管理制度和流程 Ⅰ. 目的 : 遵照中国 GCP 及 ICH-GCP 要求, 参照国内 外开展药物临床试验的经验, 结合本机构临床试验的特点, 制定本制度与流程 Ⅱ. 范围 : 适用于本机构药物临床试验 Ⅲ. 规程 : 1. 立项准备 1.1 申办者 /CRO 若有意在我院开展药物临床试验, 需首先与本机构就研究科室 等相关问题进行商洽 1.2 申办者
<4D F736F F D20D6D0B9FABDF0C8DAC6DABBF5BDBBD2D7CBF9D6B8B6A8B4E6B9DCD2F8D0D0B9DCC0EDB0ECB7A8>
 2013 8 14 2015 4 3 10015000 10003 600 3 ; 3 5 ; 3 ; ; ; ; ; 3 1 5 7*24 3 3 5 1 ; 1 3 1 10 3 2015 4 3 1 期货保证金存管业务资格申请表 申请人全称注册地址注册资本邮政编码法定代表人姓名企业法人营业执照号码金融业务许可证号码存管业务负责部门联系电话传真电话姓名 存管银行业务负责人 部门及职务 联系方式
2013 8 14 2015 4 3 10015000 10003 600 3 ; 3 5 ; 3 ; ; ; ; ; 3 1 5 7*24 3 3 5 1 ; 1 3 1 10 3 2015 4 3 1 期货保证金存管业务资格申请表 申请人全称注册地址注册资本邮政编码法定代表人姓名企业法人营业执照号码金融业务许可证号码存管业务负责部门联系电话传真电话姓名 存管银行业务负责人 部门及职务 联系方式
HP
 页码 1 / 11 港深医发 2017 37 号 香港大学深圳医院关于修订 的通知 各部门 科室 : 香港大学深圳医院 现予修订, 请遵照执行 特此通知 香港大学深圳医院 香港大学深圳医院院务部 印发 页码 2 / 10 香港大学深圳医院 一 目的规范香港大学深圳医院非注册类临床试验的运行管理 二 范围适用于本院开展的非注册类临床试验项目 三 规程非注册类临床试验是指以已上市的药物 医疗器械及诊断试剂为主要研究对象的临床研究,
页码 1 / 11 港深医发 2017 37 号 香港大学深圳医院关于修订 的通知 各部门 科室 : 香港大学深圳医院 现予修订, 请遵照执行 特此通知 香港大学深圳医院 香港大学深圳医院院务部 印发 页码 2 / 10 香港大学深圳医院 一 目的规范香港大学深圳医院非注册类临床试验的运行管理 二 范围适用于本院开展的非注册类临床试验项目 三 规程非注册类临床试验是指以已上市的药物 医疗器械及诊断试剂为主要研究对象的临床研究,
干细胞和再生医学 科学学位 免考 免考 非定向 干细胞和再生医学 科学学位 免考 85 非定向 干细胞和再生医学 科学学位 免考 69 非定向 护理学 科学学位 免考 免考 非定向 护理学 科学学位
 2018 年秋季报考博士上线考生名单 序号 准考证号 报考专业名称 学位类型外语成绩专业基础课成绩报考类别 备注 1 180371 病理学与病理生理学 科学学位 免考 免考 非定向 2 180393 病理学与病理生理学 科学学位 免考 免考 非定向 3 180427 病理学与病理生理学 科学学位 免考 免考 非定向 4 180436 病理学与病理生理学 科学学位 免考 免考 非定向 5 180474
2018 年秋季报考博士上线考生名单 序号 准考证号 报考专业名称 学位类型外语成绩专业基础课成绩报考类别 备注 1 180371 病理学与病理生理学 科学学位 免考 免考 非定向 2 180393 病理学与病理生理学 科学学位 免考 免考 非定向 3 180427 病理学与病理生理学 科学学位 免考 免考 非定向 4 180436 病理学与病理生理学 科学学位 免考 免考 非定向 5 180474
药物临床试验运行管理制度和程序
 医疗器械临床试验运行管理制度和流程 拟订人 : 许然 审核人 : 曹烨 批准人 : 洪明晃 拟订日期 : 2018-5-11 审核日期 :2018-6-15 批准日期 :2018-6-21 版本号 :4.0 公布日期 : 2018-6-22 生效日期 :2018-7-1 医疗器械临床试验是对申办方申请注册的医疗器械的临床试用或验证的过 程 本机构按照国务院颁发的 医疗器械监督管理条例, 以及国家药品监督管
医疗器械临床试验运行管理制度和流程 拟订人 : 许然 审核人 : 曹烨 批准人 : 洪明晃 拟订日期 : 2018-5-11 审核日期 :2018-6-15 批准日期 :2018-6-21 版本号 :4.0 公布日期 : 2018-6-22 生效日期 :2018-7-1 医疗器械临床试验是对申办方申请注册的医疗器械的临床试用或验证的过 程 本机构按照国务院颁发的 医疗器械监督管理条例, 以及国家药品监督管
金玉其质 妙药良研 您掌心里的临研学院
 机密 精华笔记 研师解飞 : 临床试验数据核查法规指南和要点解读 原创 : 解飞 编者语临床研究自查核查历经两年时间, 到现在仍然是 CFDA 质量监管的重拳举措 本期课程特邀第一三共 ( 中国 ) 投资有限公司药物警戒和质量管理总监解飞老师从临床试验数据自查核查相关法规指南的角度来介绍了药物临床试验自查核查的历史和背景 目的和成果 流程和标准以及未来的发展趋势, 深入阐述了自查核查活动对临床试验质量控制的重要性!
机密 精华笔记 研师解飞 : 临床试验数据核查法规指南和要点解读 原创 : 解飞 编者语临床研究自查核查历经两年时间, 到现在仍然是 CFDA 质量监管的重拳举措 本期课程特邀第一三共 ( 中国 ) 投资有限公司药物警戒和质量管理总监解飞老师从临床试验数据自查核查相关法规指南的角度来介绍了药物临床试验自查核查的历史和背景 目的和成果 流程和标准以及未来的发展趋势, 深入阐述了自查核查活动对临床试验质量控制的重要性!
ThemeGallery PowerTemplate
 不良事件 严重不良事件的报告和处理 主讲人 蒋茸 上海佰盛金泽医药科技有限公司 内 容 AE 和 SAE 的定义 不良事件的获知 不良事件的记录 不良事件的处理 严重不良事件的报告 Definition 定义 Adverse Event (AE) 不良事件 Serious Adverse Event (SAE) 严重不良事件 Adverse Event (AE) 不良事件 Any untoward
不良事件 严重不良事件的报告和处理 主讲人 蒋茸 上海佰盛金泽医药科技有限公司 内 容 AE 和 SAE 的定义 不良事件的获知 不良事件的记录 不良事件的处理 严重不良事件的报告 Definition 定义 Adverse Event (AE) 不良事件 Serious Adverse Event (SAE) 严重不良事件 Adverse Event (AE) 不良事件 Any untoward
考试时间课程名称级人数考试地点 机械工程 17 级卓越 1 30 D-386 机械工程 17 级卓越 2 30 D-386 自动化 17 级 1 30 D-3108 自动化 17 级 2 30 D-3108 电子信息工程 17 级 1 32 C-170 电子信息工程 17 级 2 32 C-242
 考试时间课程名称级人数考试地点 纺织工程 17 级 1 26 D-282 纺织工程 17 级 2 28 D-282 纺织工程 17 级 3 29 D-284 纺织工程 17 级 4 29 D-284 纺织工程 17 级 5 28 D-286 纺织工程 17 级 6 26 D-286 高分子材料与工程 17 级 1 31 C-142 非织造材料与工程 17 级 1 24 D-2108 纺织工程 17
考试时间课程名称级人数考试地点 纺织工程 17 级 1 26 D-282 纺织工程 17 级 2 28 D-282 纺织工程 17 级 3 29 D-284 纺织工程 17 级 4 29 D-284 纺织工程 17 级 5 28 D-286 纺织工程 17 级 6 26 D-286 高分子材料与工程 17 级 1 31 C-142 非织造材料与工程 17 级 1 24 D-2108 纺织工程 17
Ⅰ Ⅱ Ⅲ Ⅳ
 Ⅰ Ⅱ Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Ⅰ Ⅱ Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
<4D F736F F D203230A1A2D6D0BBAAC8CBC3F1B9B2BACDB9FAD0CCB7A8D0DED5FDB0B8A3A8C1F9A3A92E646F63>
 中华人民共和国刑法修正案 ( 六 ) (2006 年 6 月 29 日第十届全国人民代表大会常务委员会第二十二次 会议通过 ) 一 将刑法第一百三十四条修改为 : 在生产 作业中违反有关安全管理的规定, 因而发生重大伤亡事故或者造成其他严重后果的, 处三年以下有期徒刑或者拘役 ; 情节特别恶劣的, 处三年以上七年以下有期徒刑 强令他人违章冒险作业, 因而发生重大伤亡事故或者造成其他严重后果的, 处五年以下有期徒刑或者拘役
中华人民共和国刑法修正案 ( 六 ) (2006 年 6 月 29 日第十届全国人民代表大会常务委员会第二十二次 会议通过 ) 一 将刑法第一百三十四条修改为 : 在生产 作业中违反有关安全管理的规定, 因而发生重大伤亡事故或者造成其他严重后果的, 处三年以下有期徒刑或者拘役 ; 情节特别恶劣的, 处三年以上七年以下有期徒刑 强令他人违章冒险作业, 因而发生重大伤亡事故或者造成其他严重后果的, 处五年以下有期徒刑或者拘役
Ⅰ Ⅱ1 2 Ⅲ Ⅳ
 Ⅰ Ⅱ1 2 Ⅲ Ⅳ 1 1 2 3 2 3 4 5 6 7 8 9 10 12 13 14 15 16 17 18 19 20 21 ~ 22 23 24 25 26 27 28 29 30 31 32 ~ 34 35 36 37 38 39 40 41 42 43 44 45 ~ 46 47 ~ ~ 48 49 50 51 52 54 55 56 57 58 59 60 61 62 63
Ⅰ Ⅱ1 2 Ⅲ Ⅳ 1 1 2 3 2 3 4 5 6 7 8 9 10 12 13 14 15 16 17 18 19 20 21 ~ 22 23 24 25 26 27 28 29 30 31 32 ~ 34 35 36 37 38 39 40 41 42 43 44 45 ~ 46 47 ~ ~ 48 49 50 51 52 54 55 56 57 58 59 60 61 62 63
 Ⅰ Ⅱ1 2 3 Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Ⅰ Ⅱ1 2 3 Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
2016年苏州高新区公开招聘教师
 2018 年苏州高新区公开招聘教育专项编制教师 面试成绩及进入体检人员名单公告 根据 2018 年苏州高新区公开招聘教育专项编制教师简章 要求, 现将考生面试成绩及进入体检人员名单予以公布 请进入体检的人员于 2018 年 5 月 21 日 ( 周一 )~5 月 25 日 ( 周五 ) 上午 7:30 10:30 凭本人身份证原件到苏州市市立医院北区体检中心 ( 原苏州市第三人民医院 )( 地址 :
2018 年苏州高新区公开招聘教育专项编制教师 面试成绩及进入体检人员名单公告 根据 2018 年苏州高新区公开招聘教育专项编制教师简章 要求, 现将考生面试成绩及进入体检人员名单予以公布 请进入体检的人员于 2018 年 5 月 21 日 ( 周一 )~5 月 25 日 ( 周五 ) 上午 7:30 10:30 凭本人身份证原件到苏州市市立医院北区体检中心 ( 原苏州市第三人民医院 )( 地址 :
研究者都应具备承担该项临床试验的专业特长 资格和能力, 并经过培训 临床试验开始前, 研究者和申办者应就试验方案 试验的监查 稽查和标准操作规程以及试验中的职责分工等 达成书面协议 第三章受试者的权益保障 第八条在药物临床试验的过程中, 必须对受试者的个人权益给予充分的保障, 并确保 试验的科学性和
 药物临床试验质量管理规范 ( 局令第 3 号 ) 药物临床试验质量管理规范 于 2003 年 6 月 4 日经国家食品药品监督管理局局务会 审议通过, 现予发布 本规范自 2003 年 9 月 1 日起施行 二 三年八月六日 第一章总则 第一条为保证药物临床试验过程规范, 结果科学可靠, 保护受试者的权益并保障其安 全, 根据 中华人民共和国药品管理法 中华人民共和国药品管理法实施条例, 参照国 际公认原则,
药物临床试验质量管理规范 ( 局令第 3 号 ) 药物临床试验质量管理规范 于 2003 年 6 月 4 日经国家食品药品监督管理局局务会 审议通过, 现予发布 本规范自 2003 年 9 月 1 日起施行 二 三年八月六日 第一章总则 第一条为保证药物临床试验过程规范, 结果科学可靠, 保护受试者的权益并保障其安 全, 根据 中华人民共和国药品管理法 中华人民共和国药品管理法实施条例, 参照国 际公认原则,
恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期是否发生下档触发事件 挂钩标的 最初价格 * 最新价格 累积回报 OTZR 年 5 月 5 日 2018 年 5 月 7 日 3 否 728 HK Equity 3.7
 恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期是否发生下档触发事件 挂钩标的 最初价格 * 最新价格 累积回报 OTZR89 2017 年 5 月 5 日 2018 年 5 月 7 日 3 否 728 HK Equity 3.77 3.45 不适用 941 HK Equity 82.85 73.40 902 HK Equity
恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期是否发生下档触发事件 挂钩标的 最初价格 * 最新价格 累积回报 OTZR89 2017 年 5 月 5 日 2018 年 5 月 7 日 3 否 728 HK Equity 3.77 3.45 不适用 941 HK Equity 82.85 73.40 902 HK Equity
OTZR 年 12 月 13 日 2017 年 12 月 13 日 2 否 中国电信 不适用 中国移动 华能国际 EFZR 年 2 月 13 日 2018 年 2 月 13 日 1 否 盈富基金
 恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期 是否发生下档触发事件 挂钩标的 最初价格 * 最新价格 累积回报 EFZR36 2016 年 9 月 13 日 2017 年 9 月 13 日 3 否 盈富基金 24.85 26.00 不适用 H 股指数上市基金 102.40 106.90 OTZR95 2016 年 9 月 14
恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期 是否发生下档触发事件 挂钩标的 最初价格 * 最新价格 累积回报 EFZR36 2016 年 9 月 13 日 2017 年 9 月 13 日 3 否 盈富基金 24.85 26.00 不适用 H 股指数上市基金 102.40 106.90 OTZR95 2016 年 9 月 14
神经功能检查医师 是 神经功能检查医师 神经功能检查医师 神经功能检查医师 神经功能检查医师 是 神经功能检查医师 急诊内科医师 1
 2017 年青岛市西海岸医院 ( 青岛大学附属医院黄岛院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科医师 1 170907006 57.5 是 体检中心超声医师 170901013 43.7 体检中心超声医师 170906005 59.7 是 体检中心超声医师 170907015 60 是 体检中心超声医师 170907019 45.2 体检中心超声医师
2017 年青岛市西海岸医院 ( 青岛大学附属医院黄岛院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科医师 1 170907006 57.5 是 体检中心超声医师 170901013 43.7 体检中心超声医师 170906005 59.7 是 体检中心超声医师 170907015 60 是 体检中心超声医师 170907019 45.2 体检中心超声医师
湖州市吴兴区织里镇卫生院 护理 护理学 湖州市吴兴区织里镇卫生院 护理 护理学 湖州市吴兴区织里镇卫生院 护理 护理学
 序号 试场号 吴兴区 2018 年公开招聘医疗单位医疗卫生专业技术人员笔试成绩及入围面试人员名单 准考证号 座位号 报考单位 报考职位 笔试科目 笔试成绩 是否入围面试 1 1 20180701001 1 湖州市吴兴区人民医院护理护理学 84.7 入围面试 2 1 20180701002 2 湖州市吴兴区人民医院护理护理学 62.9 3 1 20180701003 3 湖州市吴兴区人民医院护理护理学
序号 试场号 吴兴区 2018 年公开招聘医疗单位医疗卫生专业技术人员笔试成绩及入围面试人员名单 准考证号 座位号 报考单位 报考职位 笔试科目 笔试成绩 是否入围面试 1 1 20180701001 1 湖州市吴兴区人民医院护理护理学 84.7 入围面试 2 1 20180701002 2 湖州市吴兴区人民医院护理护理学 62.9 3 1 20180701003 3 湖州市吴兴区人民医院护理护理学
首都医科大学附属北京儿童医院药物临床试验项目质量控制中文档管理情况首都医科大学附属北京儿童医院完成的和在研的临床试验项目 39 个, 共计 46 个不合格项, 具体分类情况见表 资料保存不完整 1 个项目未将更新过的临床试验方案保存至研究者文件夹中 ;1 个项目未将更新的病
 1828 基于药物临床试验质量控制的文档管理规范化探讨 丁倩 1, 曹彩 2, 王晓玲 1. 首都医科大学附属北京儿童医院, 北京 100045 2. 中关村玖泰药物临床试验技术创新联盟, 北京 100034 1 摘要 : 药物临床试验文件是记录临床试验过程中所产生的所有信息 资料, 反映研究者 申办者和监察员对 GCP 和所有的现行管理要求的依从性, 并且作为药品监督管理部门进行监察 新药审批的第一手资料和关键依据
1828 基于药物临床试验质量控制的文档管理规范化探讨 丁倩 1, 曹彩 2, 王晓玲 1. 首都医科大学附属北京儿童医院, 北京 100045 2. 中关村玖泰药物临床试验技术创新联盟, 北京 100034 1 摘要 : 药物临床试验文件是记录临床试验过程中所产生的所有信息 资料, 反映研究者 申办者和监察员对 GCP 和所有的现行管理要求的依从性, 并且作为药品监督管理部门进行监察 新药审批的第一手资料和关键依据
Relevant Forms and Templates BCR__020_ 02: Project Management Plan (Example Tool)
 复 方 奥 美 拉 唑 干 混 悬 剂 治 疗 十 二 指 肠 溃 疡 多 中 心 随 机 双 盲 双 模 拟 阳 性 药 物 对 照 II 期 临 床 试 验 项 目 管 理 计 划 版 本 号 :V 1.0 版 本 日 期 :2015/3/27 组 长 单 位 : 中 南 大 学 湘 雅 三 医 院 合 同 研 究 组 织 : 北 京 合 瑞 阳 光 医 药 科 技 有 限 公 司 1. 术 语
复 方 奥 美 拉 唑 干 混 悬 剂 治 疗 十 二 指 肠 溃 疡 多 中 心 随 机 双 盲 双 模 拟 阳 性 药 物 对 照 II 期 临 床 试 验 项 目 管 理 计 划 版 本 号 :V 1.0 版 本 日 期 :2015/3/27 组 长 单 位 : 中 南 大 学 湘 雅 三 医 院 合 同 研 究 组 织 : 北 京 合 瑞 阳 光 医 药 科 技 有 限 公 司 1. 术 语
证券研究报告 2016 年行业研究报告 新药不重形式重临床, 仿药一致性评价更严苛 发布时间 :2016 年 3 月 6 日 化学药品注册分类改革工作方案 点评 投资评级 事件 : 推荐 主要数据 行业指数 上证指数 / 深圳成指 / 年 3 月
 证券研究报告 2016 年行业研究报告 新药不重形式重临床, 仿药一致性评价更严苛 发布时间 :2016 年 3 月 6 日 化学药品注册分类改革工作方案 点评 投资评级 事件 : 推荐 主要数据 行业指数 7323.85 上证指数 / 深圳成指 2874.15/9536.71 2016 年 3 月 4 日, 国家食品药品监督管理总局 (CFDA) 发布了 关于 发布化学药品注册分类改革工作方案的公告
证券研究报告 2016 年行业研究报告 新药不重形式重临床, 仿药一致性评价更严苛 发布时间 :2016 年 3 月 6 日 化学药品注册分类改革工作方案 点评 投资评级 事件 : 推荐 主要数据 行业指数 7323.85 上证指数 / 深圳成指 2874.15/9536.71 2016 年 3 月 4 日, 国家食品药品监督管理总局 (CFDA) 发布了 关于 发布化学药品注册分类改革工作方案的公告
验资报告的 虚假 与 真实 法律界与会计界的对立 二 德阳案对注册会计师职业的冲击
 兼评最高人民法院法函 号 刘 燕 一 问题的提出 验资报告的 虚假 与 真实 法律界与会计界的对立 二 德阳案对注册会计师职业的冲击 法学研究 年第 期 验资报告的 虚假 与 真实 法律界与会计界的对立 三 会计界的 真实性 概念及其所蕴含的制度理性 法学研究 年第 期 四 什么是 虚假验资报告 法律上的含义 验资报告的 虚假 与 真实 法律界与会计界的对立 法学研究 年第 期 验资报告的 虚假 与
兼评最高人民法院法函 号 刘 燕 一 问题的提出 验资报告的 虚假 与 真实 法律界与会计界的对立 二 德阳案对注册会计师职业的冲击 法学研究 年第 期 验资报告的 虚假 与 真实 法律界与会计界的对立 三 会计界的 真实性 概念及其所蕴含的制度理性 法学研究 年第 期 四 什么是 虚假验资报告 法律上的含义 验资报告的 虚假 与 真实 法律界与会计界的对立 法学研究 年第 期 验资报告的 虚假 与
 !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! 2 3 4 2 3 4 5 7 8 9 10
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! 2 3 4 2 3 4 5 7 8 9 10
中药材来源的稳定和资源的可持续利用, 并应关注对环境保护等因素 的影响 涉及濒危野生动植物的应当符合国家有关规定 第三条主治病证未在国家批准的中成药 功能主治 中收载的 新药, 属于 药品注册管理办法 第四十五条第一款第 ( 四 ) 项的范 围 第四条中药注册申请, 应当明确处方组成 药材基原 药材
 关于印发中药注册管理补充规定的通知 国食药监注 [2008]3 号 2008 年 01 月 07 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总 后卫生部药品监督管理局 : 为遵循中医药研究规律, 体现中药注册特点, 规范中药注册行为, 促进中医药和民族医药事业发展, 根据 药品注册管理办法 的有关规定, 国家局组织制定了 中药注册管理补充规定, 现予印发, 请遵照执行
关于印发中药注册管理补充规定的通知 国食药监注 [2008]3 号 2008 年 01 月 07 日发布 各省 自治区 直辖市食品药品监督管理局 ( 药品监督管理局 ), 总 后卫生部药品监督管理局 : 为遵循中医药研究规律, 体现中药注册特点, 规范中药注册行为, 促进中医药和民族医药事业发展, 根据 药品注册管理办法 的有关规定, 国家局组织制定了 中药注册管理补充规定, 现予印发, 请遵照执行
2.8 从本中心 临床研究管理平台 - 公告发布 自行下载实验室室间质控证书和实验室 正常值等文件, 如有疑问, 可联系机构办公室研究护士组启动专员 ( 联系信息见附表 ) 2.9 与机构办公室研究护士组合同专员 ( 联系信息见附表 ) 联系, 对合同条款和经费 进行初步沟通, 经 PI 确认后合同
 监查员工作指引 拟定人 : 葛洁英审核人 : 曹烨批准人 : 洪明晃 拟订时间 :2017-11-10 审核时间 :2017-11-10 批准时间 :2017.12.12 版本号 :2.0 公布时间 :2017.12.12 生效时间 :2017.12.18 Ⅰ 目的 : 为监查员在本中心工作提供指引, 保证临床试验的顺利进行 Ⅱ 范围 : 适用于本机构所有新药临床试验 Ⅲ 规程 : 1. 资质要求
监查员工作指引 拟定人 : 葛洁英审核人 : 曹烨批准人 : 洪明晃 拟订时间 :2017-11-10 审核时间 :2017-11-10 批准时间 :2017.12.12 版本号 :2.0 公布时间 :2017.12.12 生效时间 :2017.12.18 Ⅰ 目的 : 为监查员在本中心工作提供指引, 保证临床试验的顺利进行 Ⅱ 范围 : 适用于本机构所有新药临床试验 Ⅲ 规程 : 1. 资质要求
2018 年 5 月 11 日页码 1 / 12 港深医发 号 香港大学深圳医院关于印发 非注册类临床 试验运行管理制度和流程 的通知 各部门 科室 : 香港大学深圳医院非注册类临床试验运行管理制度和流 程 现予印发, 请遵照执行 香港大学深圳医院 香港大学深圳医院院务部 印发
 香港大学深圳医院 文件编码 HKUSZH-CTC-004-20160512 撰写人 周文菁 审查人 刘宇隆 制订部门 / 科室 临床研究中心 签发人 邓惠琼 生效日期 检视日期 2018 年 5 月 11 日 发布范围 全院员工 备注 : 1 文件编码规则为 HKUSZH- 部门 / 科室英文简写 - 顺序号 (001-999)- 生效日期, 例如 HKUSZH-HAD-001-20150730 2
香港大学深圳医院 文件编码 HKUSZH-CTC-004-20160512 撰写人 周文菁 审查人 刘宇隆 制订部门 / 科室 临床研究中心 签发人 邓惠琼 生效日期 检视日期 2018 年 5 月 11 日 发布范围 全院员工 备注 : 1 文件编码规则为 HKUSZH- 部门 / 科室英文简写 - 顺序号 (001-999)- 生效日期, 例如 HKUSZH-HAD-001-20150730 2
»
 政法论坛 中国政法大学学报 年第 期 王 铮 作者结合国际公约以及中国自 年代至今对外缔结的双边条约和 涉外刑事诉讼的司法实践 总结分析了国际刑事司法协助中调查取证方面的各类问题 包括 提供证据和鉴定材料 扣押移交赃款赃物 代为询问证人 移送人员出 庭作证 跨境调查 控制下交付等等 同时 对加强与毒品 经济诈骗 洗钱等跨 国犯罪的斗争和健全我国司法协助制度提出了建议 国际司法协助 刑事 调查取证 ¹
政法论坛 中国政法大学学报 年第 期 王 铮 作者结合国际公约以及中国自 年代至今对外缔结的双边条约和 涉外刑事诉讼的司法实践 总结分析了国际刑事司法协助中调查取证方面的各类问题 包括 提供证据和鉴定材料 扣押移交赃款赃物 代为询问证人 移送人员出 庭作证 跨境调查 控制下交付等等 同时 对加强与毒品 经济诈骗 洗钱等跨 国犯罪的斗争和健全我国司法协助制度提出了建议 国际司法协助 刑事 调查取证 ¹
耳鼻咽喉科医师 是 耳鼻咽喉科医师 耳鼻咽喉科医师 是 耳鼻咽喉科医师 是 耳鼻咽喉科医师 耳鼻咽喉科医师 耳鼻
 2018 年青岛市西海岸医院 ( 青岛大学附属医院西海岸院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科技师 1 180360008 65.4 是 病理科技师 2 180704001 45.2 病理科技师 2 180706010 45.3 病理科技师 2 180707012 0 病理科技师 2 180711006 47.1 病理科技师 2 180716009
2018 年青岛市西海岸医院 ( 青岛大学附属医院西海岸院区 ) 公开招聘工作人员笔试成绩 报考岗位 准考证号 笔试成绩 是否进入面试范围 病理科技师 1 180360008 65.4 是 病理科技师 2 180704001 45.2 病理科技师 2 180706010 45.3 病理科技师 2 180707012 0 病理科技师 2 180711006 47.1 病理科技师 2 180716009
( 二 ) 送审 1. 送审责任人 : 伦理审查申请人应是研究项目的主要研究者 / 课题负责人, 并作为研究项目的送审责任人 2. 伦理递交 : 医院相关管理部门完成研究项目的审查并同意后, 由申请人将伦理审查资料递交至伦理委员会办公室, 并将申请表 审查文件目录以及整套审查文件电子版 (PDF/W
 四川省肿瘤医院临床研究伦理审查申请指南 一 审查范围四川省肿瘤医院医学伦理委员会负责审查由本院医药专业技术人员担任主要研究者 / 课题负责人并计划在本院开展的涉及人的临床研究项目, 包括新药 / 医疗器械注册临床试验 上市后临床评价研究 研究者发起的临床试验 临床科研课题 ( 含课题申报 ) 医疗新技术 临床研究项目经伦理委员会批准后方可实施 二 伦理审查申请类别 ( 一 ) 初始审查申请 : 首次向伦理委员会提交的审查申请
四川省肿瘤医院临床研究伦理审查申请指南 一 审查范围四川省肿瘤医院医学伦理委员会负责审查由本院医药专业技术人员担任主要研究者 / 课题负责人并计划在本院开展的涉及人的临床研究项目, 包括新药 / 医疗器械注册临床试验 上市后临床评价研究 研究者发起的临床试验 临床科研课题 ( 含课题申报 ) 医疗新技术 临床研究项目经伦理委员会批准后方可实施 二 伦理审查申请类别 ( 一 ) 初始审查申请 : 首次向伦理委员会提交的审查申请
华夏沪深三百 EFZR 年 9 月 14 日 2018 年 9 月 14 日 1 否 H 股指数上市基金 不适用 华夏沪深三百 EFZR 年 9 月 14 日 2018 年 9 月 14 日 1
 恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期发生下档触发 挂钩标的 最初价格 * 最新价格 累积回报 OTZR89 2017 年 5 月 5 日 2018 年 5 月 7 日 2 否 中国电信 3.77 3.79 不适用 中国移动 82.85 79.25 华能国际 5.35 5.00 OTZR88 2017 年 6 月 21
恒生银行 ( 中国 ) 银行结构性投资产品表现报告 步步稳 系列部分保本投资产品 产品编号 起始日 到期日 当前观察期发生下档触发 挂钩标的 最初价格 * 最新价格 累积回报 OTZR89 2017 年 5 月 5 日 2018 年 5 月 7 日 2 否 中国电信 3.77 3.79 不适用 中国移动 82.85 79.25 华能国际 5.35 5.00 OTZR88 2017 年 6 月 21
 ? Ⅰ Ⅱ Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
? Ⅰ Ⅱ Ⅲ Ⅳ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
品质量的变更时, 其生产企业应主动开展相应的评估, 及时通知药品 生产企业, 并按要求向食品药品监督管理部门报送相关资料 药包材 药用辅料变更的相关要求由国家食品药品监督管理总局另行制定 五 已批准的药包材 药用辅料, 其批准证明文件在效期内继续 有效 有效期届满后, 可继续在原药品中使用 如用于其
 总局关于药包材药用辅料与药品关联审评审批有关事项的公告 (2016 年第 134 号 ) 2016 年 08 月 10 日发布 为贯彻落实 国务院关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ), 简化药品审批程序, 将直接接触药品的包装材料和容器 ( 以下简称药包材 ) 药用辅料由单独审批改为在审批药品注册申请时一并审评审批 现就有关事项公告如下 : 一 在中华人民共和国境内研制
总局关于药包材药用辅料与药品关联审评审批有关事项的公告 (2016 年第 134 号 ) 2016 年 08 月 10 日发布 为贯彻落实 国务院关于改革药品医疗器械审评审批制度的意见 ( 国发 2015 44 号 ), 简化药品审批程序, 将直接接触药品的包装材料和容器 ( 以下简称药包材 ) 药用辅料由单独审批改为在审批药品注册申请时一并审评审批 现就有关事项公告如下 : 一 在中华人民共和国境内研制
化学药品申报资料撰写格式和内容
 化学药物综述资料的撰写格式和内容的 技术指导原则 药学研究资料综述 目 录 一 概述 1 二 原料药药学研究资料综述的格式和内容 1 ( 一 ) 制备工艺研究 1 ( 二 ) 结构确证研究 2 ( 三 ) 质量研究和质量标准的制订 2 ( 四 ) 稳定性研究 3 ( 五 ) 直接接触药品的包装材料或容器 3 ( 六 ) 综合分析与评价 3 ( 七 ) 参考资料 3 三 制剂药学研究资料综述的格式和内容
化学药物综述资料的撰写格式和内容的 技术指导原则 药学研究资料综述 目 录 一 概述 1 二 原料药药学研究资料综述的格式和内容 1 ( 一 ) 制备工艺研究 1 ( 二 ) 结构确证研究 2 ( 三 ) 质量研究和质量标准的制订 2 ( 四 ) 稳定性研究 3 ( 五 ) 直接接触药品的包装材料或容器 3 ( 六 ) 综合分析与评价 3 ( 七 ) 参考资料 3 三 制剂药学研究资料综述的格式和内容
疫苗临床试验的质量管理
 附件 1 疫苗临床试验质量管理指导原则 ( 试行 ) 第一章总则第一条为加强疫苗临床试验的管理, 提高疫苗临床试验的质量, 根据 药品注册管理办法 药物临床试验质量管理规范 (GCP) 等, 制定本指导原则 第二条本指导原则适用于国家药品监管部门批准的疫苗临床试验, 旨在为疫苗临床试验的组织管理 实施和质量管理提供指导, 保障疫苗临床试验过程规范, 结果科学可靠, 保护受试者权益和安全 疫苗临床试验申办者
附件 1 疫苗临床试验质量管理指导原则 ( 试行 ) 第一章总则第一条为加强疫苗临床试验的管理, 提高疫苗临床试验的质量, 根据 药品注册管理办法 药物临床试验质量管理规范 (GCP) 等, 制定本指导原则 第二条本指导原则适用于国家药品监管部门批准的疫苗临床试验, 旨在为疫苗临床试验的组织管理 实施和质量管理提供指导, 保障疫苗临床试验过程规范, 结果科学可靠, 保护受试者权益和安全 疫苗临床试验申办者
专 业 最高分最低分一本线最高分最低分一本线最高分最低分一本线 临床医学 ( 5+3 一体化 ) 口腔医学 ( 5+3 一体化 )
 目 录 安徽省 1 北京市 2 福建省 3 甘肃省 4 广西壮族自治区 5 贵州省 6 海南省 7 河北省 8 河南省 9 黑龙江省 10 湖北省 11 湖南省 12 吉林省 13 江苏省 14 江西省 15 辽宁省 16 内蒙古自治区 17 宁夏回族自治区 18 山东省 19 山西省 20 陕西省 21 四川省 22 天津市 23 新疆维吾尔自治区 24 云南省 25 浙江省 26 重庆市 27
目 录 安徽省 1 北京市 2 福建省 3 甘肃省 4 广西壮族自治区 5 贵州省 6 海南省 7 河北省 8 河南省 9 黑龙江省 10 湖北省 11 湖南省 12 吉林省 13 江苏省 14 江西省 15 辽宁省 16 内蒙古自治区 17 宁夏回族自治区 18 山东省 19 山西省 20 陕西省 21 四川省 22 天津市 23 新疆维吾尔自治区 24 云南省 25 浙江省 26 重庆市 27
<A1B6D2A9CEEFC1D9B4B2CAD4D1E9D6CAC1BFB9DCC0EDB9E6B7B6A1B7A3A8BED6C1EEB5DA33BAC5A3A9>
 药物临床试验质量管理规范 ( 局令第 3 号 ) 2003 年 08 月 06 日发布 国家食品药品监督管理局令 第 3 号 药物临床试验质量管理规范 于 2003 年 6 月 4 日经国家食品药品监督管理局局务会审议通过, 现予发布 本规范自 2 003 年 9 月 1 日起施行 二 三年八月六日 药物临床试验质量管理规范 第一章 总则 第一条 为保证药物临床试验过程规范, 结果科学可靠, 保护受试者的权益并保障其安全,
药物临床试验质量管理规范 ( 局令第 3 号 ) 2003 年 08 月 06 日发布 国家食品药品监督管理局令 第 3 号 药物临床试验质量管理规范 于 2003 年 6 月 4 日经国家食品药品监督管理局局务会审议通过, 现予发布 本规范自 2 003 年 9 月 1 日起施行 二 三年八月六日 药物临床试验质量管理规范 第一章 总则 第一条 为保证药物临床试验过程规范, 结果科学可靠, 保护受试者的权益并保障其安全,
福建农业学报 材料与方法 毒株 主要仪器 主要试剂 引物设计 的培养 反应条件的建立 荧光定量 检测临床样本 结果与分析
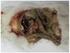 福建农业学报 林 甦 朱春华 陈 珍 刘斌琼 施少华 江 斌 蔡国漳 林 羽 黄 瑜 甦 男 硕士 助理研究员 主要从事病毒学和动物传染病学研究 福建农业学报 材料与方法 毒株 主要仪器 主要试剂 引物设计 的培养 反应条件的建立 荧光定量 检测临床样本 结果与分析 林 甦等 鸡 亚型白血病病毒荧光定量 检测方法的建立 福建农业学报 讨 论 林 甦等 鸡 亚型白血病病毒荧光定量 检测方法的建立 责任编辑
福建农业学报 林 甦 朱春华 陈 珍 刘斌琼 施少华 江 斌 蔡国漳 林 羽 黄 瑜 甦 男 硕士 助理研究员 主要从事病毒学和动物传染病学研究 福建农业学报 材料与方法 毒株 主要仪器 主要试剂 引物设计 的培养 反应条件的建立 荧光定量 检测临床样本 结果与分析 林 甦等 鸡 亚型白血病病毒荧光定量 检测方法的建立 福建农业学报 讨 论 林 甦等 鸡 亚型白血病病毒荧光定量 检测方法的建立 责任编辑
中山大学附属肿瘤医院临床研究部/药物临床试验机构
 药物临床试验运行管理制度和流程 拟订人 : 许然 审核人 : 曹烨 批准人 : 洪明晃 拟订日期 : 2018-5-11 审核日期 :2018-6-15 批准日期 :2018-6-21 版本号 :11.0 公布日期 : 2018-6-22 生效日期 : 2018-7-1 药物临床试验是指任何在人体 ( 病人或健康志愿者 ) 进行的药物的系统性研究, 以证实或发现试验药物的临床 药理和 / 或其他药效学方面的作用
药物临床试验运行管理制度和流程 拟订人 : 许然 审核人 : 曹烨 批准人 : 洪明晃 拟订日期 : 2018-5-11 审核日期 :2018-6-15 批准日期 :2018-6-21 版本号 :11.0 公布日期 : 2018-6-22 生效日期 : 2018-7-1 药物临床试验是指任何在人体 ( 病人或健康志愿者 ) 进行的药物的系统性研究, 以证实或发现试验药物的临床 药理和 / 或其他药效学方面的作用
 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心 www.aboo 科学出版社职教技术出版中心
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 病理学与病理生理学 病理学与病理生理学
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
药物临床试验机构基本信息 温州医学院附属第二医院组织机构代码 : 机构电话 : 机构传真 : 机构邮箱 机构网址 : 医院官网首页 - 新药研究 (
 CRA CRC 工作手册 目录 药物临床试验机构基本信息... 1 医学伦理委员会基本信息... 1 一 机构立项流程... 2 二 伦理审查流程... 3 三 合同签订流程... 4 四 项目启动流程... 5 五 CRC 工作管理要求...6 六 CRA 工作管理要求...8 七 项目归档与结题... 9 八 资料档案查阅... 10 九 溯源...11 十 提前终止或暂停临床试验项目...12
CRA CRC 工作手册 目录 药物临床试验机构基本信息... 1 医学伦理委员会基本信息... 1 一 机构立项流程... 2 二 伦理审查流程... 3 三 合同签订流程... 4 四 项目启动流程... 5 五 CRC 工作管理要求...6 六 CRA 工作管理要求...8 七 项目归档与结题... 9 八 资料档案查阅... 10 九 溯源...11 十 提前终止或暂停临床试验项目...12
untitled
 1 1 2 3 4 1 2 3 4 5 6 7. 8 3 4 5 [] ) 6 7 8 JGPSSI No.1 CFC A I A II CFC B I B II 111- B III C III 2 E HBFC C II HCFC C I 1 1 JGPSSI 2 4 9 10 11 12 13 76/769/EEC 19 4-2- 33-4- 4-- 24-5-- 33--44-44- 44-33-
1 1 2 3 4 1 2 3 4 5 6 7. 8 3 4 5 [] ) 6 7 8 JGPSSI No.1 CFC A I A II CFC B I B II 111- B III C III 2 E HBFC C II HCFC C I 1 1 JGPSSI 2 4 9 10 11 12 13 76/769/EEC 19 4-2- 33-4- 4-- 24-5-- 33--44-44- 44-33-
“内幕交易、泄露内幕信息”
 内幕交易 泄露内幕信息 和 利用未公开信息交易 的罪与罚 第一部分 : 内幕交易 泄露内幕信息犯罪一 内幕交易 泄露内幕信息犯罪的概念所谓内幕交易 泄露内幕信息罪, 根据 刑法 第一百八十条第一款规定, 是指证券 期货交易内幕信息的知情人员 单位或者非法获取证券 期货内幕信息的人员 单位, 在涉及证券的发行, 证券 期货交易或者其他对证券 期货交易价格有重大影响的信息尚未公开前, 买入或者卖出该证券,
内幕交易 泄露内幕信息 和 利用未公开信息交易 的罪与罚 第一部分 : 内幕交易 泄露内幕信息犯罪一 内幕交易 泄露内幕信息犯罪的概念所谓内幕交易 泄露内幕信息罪, 根据 刑法 第一百八十条第一款规定, 是指证券 期货交易内幕信息的知情人员 单位或者非法获取证券 期货内幕信息的人员 单位, 在涉及证券的发行, 证券 期货交易或者其他对证券 期货交易价格有重大影响的信息尚未公开前, 买入或者卖出该证券,
 目 录 厦 门 市 第 十 四 届 人 大 常 委 会 第 二 十 八 次 会 议 议 程 (1) 厦 门 市 第 十 四 届 人 大 常 委 会 第 二 十 八 次 会 议 日 程 安 排 表 (2) 厦 门 市 人 民 代 表 大 会 常 务 委 员 会 关 于 批 准 2015 年 厦 门 市 地 方 政 府 新 增 债 券 发 行 计 划 及 市 本 级 预 算 调 整 的 决 议 (5)
目 录 厦 门 市 第 十 四 届 人 大 常 委 会 第 二 十 八 次 会 议 议 程 (1) 厦 门 市 第 十 四 届 人 大 常 委 会 第 二 十 八 次 会 议 日 程 安 排 表 (2) 厦 门 市 人 民 代 表 大 会 常 务 委 员 会 关 于 批 准 2015 年 厦 门 市 地 方 政 府 新 增 债 券 发 行 计 划 及 市 本 级 预 算 调 整 的 决 议 (5)
食 品 与 生 物 技 术 学 报 第 卷 列入我国 的植物多酚黄酮抗氧剂 防治高血脂和心血管疾病
 第 卷第 期 年 月 食品与生物技术学报 植物多酚黄酮抗氧化剂与人体健康 尤新 中国食品添加剂和配料生产应用工业协会 北京 主要综述了对植物多酚黄酮类物质的生物活性和安全性 其内容包括 茶多酚 甘草黄酮 竹叶黄酮 大豆异黄酮以及从各种鲜果提取物的功能成分 如葡萄提取物 杨梅提取物 橄榄提取 物 乌饭树果提取物等 介绍了植物多酚黄酮的国际市场信息及相关的研究机构和生产单位 多酚 黄酮 健康 食 品 与
第 卷第 期 年 月 食品与生物技术学报 植物多酚黄酮抗氧化剂与人体健康 尤新 中国食品添加剂和配料生产应用工业协会 北京 主要综述了对植物多酚黄酮类物质的生物活性和安全性 其内容包括 茶多酚 甘草黄酮 竹叶黄酮 大豆异黄酮以及从各种鲜果提取物的功能成分 如葡萄提取物 杨梅提取物 橄榄提取 物 乌饭树果提取物等 介绍了植物多酚黄酮的国际市场信息及相关的研究机构和生产单位 多酚 黄酮 健康 食 品 与
Microsoft Word - 9_「中華人民共和国薬品管理法」修正案(草案意見募集稿)
 中国法令アップデート 中華人民共和国薬品管理法 修正案 ( 草案意見募集稿 ) ( 中国語名称 : 総局弁公庁公開征求 中華人民共和国薬品管理法 修正案 ( 草案征求意見稿 ) 意見 ) 法令番号 :--- 总局办公厅公开征求 中华人民共和国药品管理法 修正案 ( 草案征求意见稿 ) 意见 10 月 1 日, 中央办公厅 国务院办公厅印发 关于深化审评审批制度改革鼓励药品医疗器械创新的意见 ( 以下简称
中国法令アップデート 中華人民共和国薬品管理法 修正案 ( 草案意見募集稿 ) ( 中国語名称 : 総局弁公庁公開征求 中華人民共和国薬品管理法 修正案 ( 草案征求意見稿 ) 意見 ) 法令番号 :--- 总局办公厅公开征求 中华人民共和国药品管理法 修正案 ( 草案征求意见稿 ) 意见 10 月 1 日, 中央办公厅 国务院办公厅印发 关于深化审评审批制度改革鼓励药品医疗器械创新的意见 ( 以下简称
北京中医药大学 2019 年博士考生材料审核表 序号 报名号 报考类别 专项计划 报考学位类型 报考学院 定向少干学术学位中药学院 定向少干专业学位东方 定向少干学术学位中医学院 定向少干学术学位
 1 1002698807 定向少干学术学位中药学院 2 1002698865 定向少干专业学位东方 3 1002698931 定向少干学术学位中医学院 4 1002698976 定向少干学术学位中医学院 5 1002699020 定向少干学术学位中医学院 6 1002699109 定向少干学术学位中医学院 7 1002699139 定向少干学术学位中医学院 8 1002699182 定向少干学术学位中医学院已通知不让考
1 1002698807 定向少干学术学位中药学院 2 1002698865 定向少干专业学位东方 3 1002698931 定向少干学术学位中医学院 4 1002698976 定向少干学术学位中医学院 5 1002699020 定向少干学术学位中医学院 6 1002699109 定向少干学术学位中医学院 7 1002699139 定向少干学术学位中医学院 8 1002699182 定向少干学术学位中医学院已通知不让考
( 一 ) 主 办 单 位 : 中 国 医 药 城 楚 天 科 技 股 份 有 限 公 司 仿 制 药 一 致 性 评 价 技 术 联 盟 培 优 一 致 性 评 价 研 发 联 盟 隆 泰 投 资 管 理 有 限 合 伙 企 业 ( 二 ) 承 办 单 位 : 北 京 培 优 创 新 医 药 生
 中 国 工 业 药 剂 学 与 BE 研 究 高 峰 论 坛 主 题 : 仿 制 药 质 量 与 疗 效 一 致 性 评 价 要 点 难 点 解 析 邀 请 函 ( 第 一 轮 ) 2016.8.25~ 28 长 沙 宁 乡 通 程 温 泉 大 酒 店 各 有 关 单 位 : 仿 制 药 质 量 与 疗 效 一 致 性 评 价 是 全 面 提 升 我 国 上 市 药 品 质 量 的 重 大 战 略,
中 国 工 业 药 剂 学 与 BE 研 究 高 峰 论 坛 主 题 : 仿 制 药 质 量 与 疗 效 一 致 性 评 价 要 点 难 点 解 析 邀 请 函 ( 第 一 轮 ) 2016.8.25~ 28 长 沙 宁 乡 通 程 温 泉 大 酒 店 各 有 关 单 位 : 仿 制 药 质 量 与 疗 效 一 致 性 评 价 是 全 面 提 升 我 国 上 市 药 品 质 量 的 重 大 战 略,
untitled
 65 114 1 2 3 1 96.49% 89.47% 68.42% 62.28% 42.98% 32.46% 26.32% 14.04% 13.16% 120.00 100.00 80.00 60.00 40.00 20.00 0.00 89.47 96.49 62.28 68.42 14.04 26.32 13.16 42.98 32.46 1 2 73.68% 63.16% 56.14% 36.84%
65 114 1 2 3 1 96.49% 89.47% 68.42% 62.28% 42.98% 32.46% 26.32% 14.04% 13.16% 120.00 100.00 80.00 60.00 40.00 20.00 0.00 89.47 96.49 62.28 68.42 14.04 26.32 13.16 42.98 32.46 1 2 73.68% 63.16% 56.14% 36.84%
投标药品 : 阿立哌唑片 5mg mg 上海上药中西制药有限公司 (5mg* 片 ) 浙江大冢制药有限公司 (5mg* 片 ) 江苏恩华药业股份有限公司 (mg*24 片 ) 浙江大冢制药有限公司 (mg* 片 ) 1 投标药品 2016 年产销量证明 2 投标药品拥有本次招标品种指定规格的有效注册
 附件 : 上海市医疗机构第三批集中带量招标采购综合质量信息公示表 投标药品 : 阿法骨化醇软胶囊 0.25μg 0.5μg 广州白云山星群 ( 药业 ) 股份有限公司 (0.25μg*20 粒 ) 上海信谊延安药业有限公司 (0.25μg*20 粒 ) 青岛正大海尔制药有限公司 (0.25μg*20 粒 ) 南通华山药业有限公司 (0.25μg*20 粒 ) 华润双鹤药业股份有限公司 (0.25μg*30
附件 : 上海市医疗机构第三批集中带量招标采购综合质量信息公示表 投标药品 : 阿法骨化醇软胶囊 0.25μg 0.5μg 广州白云山星群 ( 药业 ) 股份有限公司 (0.25μg*20 粒 ) 上海信谊延安药业有限公司 (0.25μg*20 粒 ) 青岛正大海尔制药有限公司 (0.25μg*20 粒 ) 南通华山药业有限公司 (0.25μg*20 粒 ) 华润双鹤药业股份有限公司 (0.25μg*30
目录 Part1 关于立项 伦理审查 我们公司有一个药品 / 器械 / 诊断试剂, 需要进行临床试验, 机构是否可以承接? 机构对立项 伦理审查有何要求? 递交立项资料时, 是否需要确定整个项目研究团队? 机构对研究团队的人员的资质有何要求? 请问项
 临床试验百问百答 第 1 期 温州医科大学附属第二医院 2018-02-28 目录 Part1 关于立项 伦理审查...1 1 我们公司有一个药品 / 器械 / 诊断试剂, 需要进行临床试验, 机构是否可以承接?... 1 2 机构对立项 伦理审查有何要求?...1 3 递交立项资料时, 是否需要确定整个项目研究团队? 机构对研究团队的人员的资质有何要求?...1 4 请问项目立项资料最晚递交时间?...1
临床试验百问百答 第 1 期 温州医科大学附属第二医院 2018-02-28 目录 Part1 关于立项 伦理审查...1 1 我们公司有一个药品 / 器械 / 诊断试剂, 需要进行临床试验, 机构是否可以承接?... 1 2 机构对立项 伦理审查有何要求?...1 3 递交立项资料时, 是否需要确定整个项目研究团队? 机构对研究团队的人员的资质有何要求?...1 4 请问项目立项资料最晚递交时间?...1
( 本页无正文, 仅为 关于提供信息的承诺函 的签署页 ) 承诺方 : 杨圣辉 2015 年 5 月 6 日
 关于提供信息的承诺函 江苏友利投资控股股份有限公司 ( 下称 友利控股 ) 拟通过资产置换及非公开发行股份方式收购北京中清龙图网络技术有限公司 ( 下称 标的公司 )100% 股权 ( 下称 标的资产 ) 并向江苏双良科技有限公司出售资产 ( 下称 本次交易 ) 本方( 下称 承诺方 ) 作为交易对方, 现承诺如下 : 1 承诺方将及时向友利控股提供本次交易相关信息, 并保证所提供的信息真实 准确
关于提供信息的承诺函 江苏友利投资控股股份有限公司 ( 下称 友利控股 ) 拟通过资产置换及非公开发行股份方式收购北京中清龙图网络技术有限公司 ( 下称 标的公司 )100% 股权 ( 下称 标的资产 ) 并向江苏双良科技有限公司出售资产 ( 下称 本次交易 ) 本方( 下称 承诺方 ) 作为交易对方, 现承诺如下 : 1 承诺方将及时向友利控股提供本次交易相关信息, 并保证所提供的信息真实 准确
第十章附则 第一章总则 第一条为加强药品监督管理, 保证药品质量, 保障人体用药安全, 维护人民身体健康和用药的合法权益, 特制定本法 第二条在中华人民共和国境内从事药品的研制 生产 经营 使用和监督管理的单位或者个人, 必须遵守本法 第三条国家发展现代药和传统药, 充分发挥其在预防 医疗和保健中的
 中华人民共和国药品管理法 2015 年 04 月 24 日 中华人民共和国药品管理法 (1984 年 9 月 20 日第六届全国人民代表大会常务委员会第七次会议通过 2001 年 2 月 28 日第九届全国人民代表大会常务委员会第二十次会议修订根据 2013 年 12 月 28 日第十二届全国人民代表大会常务委员会第六次会议 关于 修改 < 中华人民共和国海洋环境保护法 > 等七部法律的决定 第一次修正根据
中华人民共和国药品管理法 2015 年 04 月 24 日 中华人民共和国药品管理法 (1984 年 9 月 20 日第六届全国人民代表大会常务委员会第七次会议通过 2001 年 2 月 28 日第九届全国人民代表大会常务委员会第二十次会议修订根据 2013 年 12 月 28 日第十二届全国人民代表大会常务委员会第六次会议 关于 修改 < 中华人民共和国海洋环境保护法 > 等七部法律的决定 第一次修正根据
其保存条件要求进行储藏 2.2 试验用药物存放期间每日通过温控系统监测最高最低温度及湿度, 每月打印当月温湿度记录存档 常温存放, 药物贮藏温度不超过 30 ; 阴凉存放, 药物贮藏温度不超过 20 ; 凉暗处保存, 药物避光保存并不超过 20 ; 冷处保存, 药物贮藏温度 2~10 试验用药物储存
 试验用药物接收 保存 发放 回收 退还的 SOP I 目的规范药物临床试验中试验用药物的接收 保存 发放 回收 退还, 确保 试验药物质量, 保证药物正确使用 II III 范围适用于本机构所有临床试验 规程试验药物是指临床试验中用作试验或对照的药物或安慰剂 本机构试验药 物采用中心化管理, 指定药物管理专员负责试验用药物的管理 特殊项目需要由专业组进行管理的, 需在启动前得到机构办批准, 并遵循相应专业组的
试验用药物接收 保存 发放 回收 退还的 SOP I 目的规范药物临床试验中试验用药物的接收 保存 发放 回收 退还, 确保 试验药物质量, 保证药物正确使用 II III 范围适用于本机构所有临床试验 规程试验药物是指临床试验中用作试验或对照的药物或安慰剂 本机构试验药 物采用中心化管理, 指定药物管理专员负责试验用药物的管理 特殊项目需要由专业组进行管理的, 需在启动前得到机构办批准, 并遵循相应专业组的
Ⅰ Ⅱ Ⅲ Ⅳ
 Ⅰ Ⅱ Ⅲ Ⅳ 2 2 3 4 5 6 7 8 2 3 4 1 1 5 6 7 8 10 1 2 1 2 11 12 1 1 13 14 1 1 15 16 1 1 1 17 2 3 18 4 19 20 21 1 1 22 1 1 23 1 1 24 25 1 2 3 1 2 3 26 1 2 1 2 27 1 1 29 30 31 ~ 32 1 1 ~ ~ ~ ~ ~ ~ 33 ~
Ⅰ Ⅱ Ⅲ Ⅳ 2 2 3 4 5 6 7 8 2 3 4 1 1 5 6 7 8 10 1 2 1 2 11 12 1 1 13 14 1 1 15 16 1 1 1 17 2 3 18 4 19 20 21 1 1 22 1 1 23 1 1 24 25 1 2 3 1 2 3 26 1 2 1 2 27 1 1 29 30 31 ~ 32 1 1 ~ ~ ~ ~ ~ ~ 33 ~
 昆明冶专 2016 年公开招聘笔试成绩 (7 月 2 日 ) 公告 各考生 : 根据云南省人力资源与社会保障厅考试中心的通知和下发的笔试考试结果, 我校现将 2016 年报考昆明冶金高等专科学校公开招聘考试人员笔试成绩公告如下 : 报名序 号 报考职位 考号 职业能力倾向测 验成绩 综合应用 能力成绩 091335 064366 041508 096243 011118 022096 008085
昆明冶专 2016 年公开招聘笔试成绩 (7 月 2 日 ) 公告 各考生 : 根据云南省人力资源与社会保障厅考试中心的通知和下发的笔试考试结果, 我校现将 2016 年报考昆明冶金高等专科学校公开招聘考试人员笔试成绩公告如下 : 报名序 号 报考职位 考号 职业能力倾向测 验成绩 综合应用 能力成绩 091335 064366 041508 096243 011118 022096 008085
管理与发展_重庆
 临床研究不良事件的伦理审查 浙江大学医学院附属第一医院 黄明珠 新药临床试验中, 安全性评价不仅和有效性评价具有同等重要意义, 在实施临床试验规范 ( GCP) 过程中, 要求执行赫尔辛基宣言, 保护受试者的权益, 被提到了越来越重要的位置 相关的法规 药品注册管理办法 (2007) 第 41 条临床试验过程中发生严重不良事件的, 研究者应当在 24 小时内报告有关 -- - 药品监督管理局, 通知申请人,
临床研究不良事件的伦理审查 浙江大学医学院附属第一医院 黄明珠 新药临床试验中, 安全性评价不仅和有效性评价具有同等重要意义, 在实施临床试验规范 ( GCP) 过程中, 要求执行赫尔辛基宣言, 保护受试者的权益, 被提到了越来越重要的位置 相关的法规 药品注册管理办法 (2007) 第 41 条临床试验过程中发生严重不良事件的, 研究者应当在 24 小时内报告有关 -- - 药品监督管理局, 通知申请人,
制 定 人 员 : 龚 萍 经 营 与 教 研 室 副 教 授 余 虹 经 营 与 教 研 室 讲 师 执 笔 人 : 龚 萍 审 核 部 门 : 药 学 院 专 业 建 设 指 导 委 员 会 实 施 部 门 : 经 营 与 教 研 室 批 准 部 门 : 教 务 处
 重 庆 医 药 高 等 专 科 学 校 药 学 专 业 (015 年 ) 药 事 与 法 规 课 程 标 准 重 庆 医 药 高 等 专 科 学 校 印 制 制 定 人 员 : 龚 萍 经 营 与 教 研 室 副 教 授 余 虹 经 营 与 教 研 室 讲 师 执 笔 人 : 龚 萍 审 核 部 门 : 药 学 院 专 业 建 设 指 导 委 员 会 实 施 部 门 : 经 营 与 教 研 室 批
重 庆 医 药 高 等 专 科 学 校 药 学 专 业 (015 年 ) 药 事 与 法 规 课 程 标 准 重 庆 医 药 高 等 专 科 学 校 印 制 制 定 人 员 : 龚 萍 经 营 与 教 研 室 副 教 授 余 虹 经 营 与 教 研 室 讲 师 执 笔 人 : 龚 萍 审 核 部 门 : 药 学 院 专 业 建 设 指 导 委 员 会 实 施 部 门 : 经 营 与 教 研 室 批
PEKING UNIVERSITY 临床研究的质量管理 吉萍北京大学临床研究所 1
 北京大学科研伦理与科研诚信培训第十期 ( 模块 A) 日程 2016 年 5 月 12 日 ( 星期四 ), 时间 : 下午 01:00-04:30 地点 : 北京大学医学部逸夫教学楼 702 12:40-01:00 签到 01:00-01:45 项目质量控制及常见问题分析 吉萍 01:45-02:45 研究中的样本含量估计与伦理审查 康晓平 02:45-03:00 休息 03:00-04:20 移动健康相关研究的伦理问题
北京大学科研伦理与科研诚信培训第十期 ( 模块 A) 日程 2016 年 5 月 12 日 ( 星期四 ), 时间 : 下午 01:00-04:30 地点 : 北京大学医学部逸夫教学楼 702 12:40-01:00 签到 01:00-01:45 项目质量控制及常见问题分析 吉萍 01:45-02:45 研究中的样本含量估计与伦理审查 康晓平 02:45-03:00 休息 03:00-04:20 移动健康相关研究的伦理问题
2 重庆医科大学附属第二医院急救部医师 是 3 重庆医科大学附属第二医院 急救部医师 是 重庆医科大学附属
 重庆医科大学附属第二医院 2018 年上半年公开招聘事业单位工作人员考试成绩公示表 名次报考单位报考岗位准考证号 1 重庆医科大学附属第二医院病理科医师 82013071626 65.5 19.65 64.00 19.20 129.50 38.85 是 2 重庆医科大学附属第二医院 病理科医师 82013081917 50 15 66.00 19.80 116.00 34.80 是 重庆医科大学附属第二医院
重庆医科大学附属第二医院 2018 年上半年公开招聘事业单位工作人员考试成绩公示表 名次报考单位报考岗位准考证号 1 重庆医科大学附属第二医院病理科医师 82013071626 65.5 19.65 64.00 19.20 129.50 38.85 是 2 重庆医科大学附属第二医院 病理科医师 82013081917 50 15 66.00 19.80 116.00 34.80 是 重庆医科大学附属第二医院
31 中学语文教师 进入面试 32 中学语文教师 进入面试 33 中学语文教师 进入面试 34 中学语文教师 进入面试 35 中学语文教师 进入面试
 2018 年太仓市教育系统公开招聘教师笔试成绩公布 2018 年太仓市教育系统公开招聘教师笔试成绩现予以公布 本次考试中学物理教师岗位笔试合格分数线为 57.23 分 ( 平均分 ), 其它岗位笔试合格分数线均为 60 分 本次招考根据岗位计划招录人数 ( 部分岗位根据核减后的招录人数 ), 在笔试成绩合格者中, 按 3:1 的比例从高分到低分确定进入面试人选 ; 不足 3:1 比例的, 按实际符合条件人数确定进入面试人选
2018 年太仓市教育系统公开招聘教师笔试成绩公布 2018 年太仓市教育系统公开招聘教师笔试成绩现予以公布 本次考试中学物理教师岗位笔试合格分数线为 57.23 分 ( 平均分 ), 其它岗位笔试合格分数线均为 60 分 本次招考根据岗位计划招录人数 ( 部分岗位根据核减后的招录人数 ), 在笔试成绩合格者中, 按 3:1 的比例从高分到低分确定进入面试人选 ; 不足 3:1 比例的, 按实际符合条件人数确定进入面试人选
一 我国部分研究型大学 大学生创新性实验计划 实施的现状 莙政基 莙政基金 外 在学生中有
 高等教育研究 乔 连 全 厦门大学教育研究院 福建厦门 从调研情况来看 教育部 大学生创新性实验计划 的实施已取得一定的成效 但 也存在一些问题和不足 结合与国外类似项目的比较 各参与高校应从提高思想认识 创新管理模式 构建课程体系 拓展项目类型 加强项目评价 建立交流平台 落实激励措施等方面进 一步改进和完善 以更好地推动高校人才培养模式改革 培养高素质的创新型人才 研究型大学 创新型人才 本科生科研
高等教育研究 乔 连 全 厦门大学教育研究院 福建厦门 从调研情况来看 教育部 大学生创新性实验计划 的实施已取得一定的成效 但 也存在一些问题和不足 结合与国外类似项目的比较 各参与高校应从提高思想认识 创新管理模式 构建课程体系 拓展项目类型 加强项目评价 建立交流平台 落实激励措施等方面进 一步改进和完善 以更好地推动高校人才培养模式改革 培养高素质的创新型人才 研究型大学 创新型人才 本科生科研
中华人民共和国药品管理法》(主席令第45号)
 中华人民共和国药品管理法 ( 主席令第 45 号 ) 2001 年 02 月 28 日发布 中华人民共和国主席令 第四十五号 中华人民共和国药品管理法 已由中华人民共和国第九届全国人民代表大会常务委员 会第二十次会议于 2001 年 2 月 28 日修订通过, 现将修订后的 中华人民共和国药品管理法 公布, 自 2001 年 12 月 1 日起施行 中华人民共和国主席江泽民 2001 年 2 月 28
中华人民共和国药品管理法 ( 主席令第 45 号 ) 2001 年 02 月 28 日发布 中华人民共和国主席令 第四十五号 中华人民共和国药品管理法 已由中华人民共和国第九届全国人民代表大会常务委员 会第二十次会议于 2001 年 2 月 28 日修订通过, 现将修订后的 中华人民共和国药品管理法 公布, 自 2001 年 12 月 1 日起施行 中华人民共和国主席江泽民 2001 年 2 月 28

 Ⅰ Ⅱ1 2 Ⅲ Ⅳ 1 2 1
Ⅰ Ⅱ1 2 Ⅲ Ⅳ 1 2 1  Ⅰ Ⅱ1 2 Ⅲ Ⅳ ! " # $
Ⅰ Ⅱ1 2 Ⅲ Ⅳ ! " # $