治療 24 週 醫療科技評估報告摘要 摘要說明 : 一 案由 : 台灣必治妥施貴寶股份有限公司建議健保新收載藥品 daclatasvir ( 商品名 Daklinza) 與 asunaprevir ( 商品名 Sunvepra) 用於 慢性 C 型肝炎 Genotype 1b 治療 :(1) 限 A
|
|
|
- 央翕 卫
- 5 years ago
- Views:
Transcription
1 財團法人醫藥品查驗中心 Center For Drug Evaluation 坦克干膜衣錠及速威干軟膠囊 (Daklinza Tablet 30mg,60mg 及 Sunvepra Capsule 100mg) 醫療科技評估報告 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱坦克干膜衣錠 30 毫克 /60 建議者 藥品許可證持有商 含量規格劑型 主管機關許可適應症 目前健保已給付之適 應症內容 此次建議健保給付之 適應症內容 建議健保給付條件 建議療程 毫克 (Daklinza) 速威干軟 膠囊 100 毫克 (Sunvepra) 台灣必治妥施貴寶股份有限公司 台灣必治妥施貴寶股份有限公司 Daklinza:30mg/60mg 膜衣錠 Sunvepra:100mg 軟膠囊 成分 Daclatasvir Asunaprevir 1. Daclatasvir 與 Asunaprevir 併用, 治療先前未曾接受治療 不 適合接受 interferon 或 ribavirin 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之 代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎 基因型第 1b 型感染症 2. Daclatasvir 與 Asunaprevir peginterferon 及 ribavirin 併用, 治 療先前未曾接受治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括 肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1 型感 染症 無 慢性 C 型肝炎 Genotype 1b 治療 C 型肝炎相關 ICD code: ICD-9-CM: ICD-10-CM: B17.1 B18.2 無 有,(1) 限 ALT 值異常者, 且 Anti-HCV 與 HCV RNA 均為陽 性, 或經由肝組織切片 ( 血友病患及類血友病患經照會消化系專 科醫師同意後, 得不作切片 ), 以 METAVIR system 證實輕度纖 維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (2) 上 述患者如有 NS5A 抗藥相關變異株 (L31 或 Y93) 或非代償性 (decompensated) 肝硬化者, 則不適用此藥物 104BTD12010_ Daklinza Tablet 30mg,60mg 及 Sunvepra Capsule 100mg Daclinza 60mg 每日口服 1 次合併 Sunvepra 100mg 每日口服 2 次 1/64
2 治療 24 週 醫療科技評估報告摘要 摘要說明 : 一 案由 : 台灣必治妥施貴寶股份有限公司建議健保新收載藥品 daclatasvir ( 商品名 Daklinza) 與 asunaprevir ( 商品名 Sunvepra) 用於 慢性 C 型肝炎 Genotype 1b 治療 :(1) 限 ALT 值異常者, 且 Anti-HCV 與 HCV RNA 均為陽性, 或經由肝組織切片 ( 血友病患及類血友病患經照會消化系專科醫師同意後, 得不作切片 ), 以 METAVIR system 證實輕度纖維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (2) 上述患者如有 NS5A 抗藥相關變異株 (L31 或 Y93) 或非代償性 (decompensated) 肝硬化者, 則不適用此藥物 之適應症 二 主要醫療科技評估組織之給付建議 : 請參見表二三 相對療效與安全性 ( 人體健康 ): 相對療效實證主要文獻搜尋共採納 5 篇臨床試驗結果, 一篇為 daclatasvir 合併 asunaprevir 與安慰劑相比用於慢性 C 型肝炎病毒基因型 1b 患者之隨機分派臨床試驗 HALLMARK-DUAL[17], 一篇為於日本執行 daclatasvir 合併 asunaprevir 與 telaprevir 合併 PR 治療相比用於慢性 C 型肝炎病毒基因型 1b 患者之隨機分派臨床試驗 [18], 一為於日本執行 daclatasvir 合併 asunaprevir 用於慢性 C 型肝炎病毒基因型 1b 患者之開放性無對照臨床試驗 [30], 一為追蹤期中位數達 27 個月之日本小型研究, 說明以 daclatasvir 與 asunaprevir 治療慢性 C 型肝炎患者達 SVR 之患者其肝炎與肝纖維化之相關指標改善之程度 [11] 一為關於 HALLMARK-DUAL 試驗之韓國與台灣患者次族群分析之摘要 [31] 各試驗之結果摘要如下 : (1) HALLMARK-DUAL 試驗及相關分析 [17, 31] 在分層分析時, 達到 SVR12 的比例在不同的性別 年齡 種族 BMI 或是 IL28B 之基因型別與肝硬化狀態上都沒有顯著的差異 有肝硬化的族群達 SVR12 比例為 84%, 沒有肝硬化的族群達到 SVR12 的比例則為 85% 在其他次族群分析時, 採用多因子迴歸分析時僅發現 HCV RNA 量 IU/ml 與 NS5A 抗藥性相關之變異病毒株 (L31 或 Y93 變異之型別 ) 與較低的 SVR12 比例有關 具 NS5A-L31 變異株之受試者僅有 41% 達 SVR12; 具 NS5A-Y93 的受試者僅有 38% 達 SVR12 (2) 於日本執行之第三期無對照臨床試驗 [30] 在有肝硬化的患者中, 達 SVR24 的比例有 90.9%, 而無肝硬化的患者達 SVR24 的比例有 84% IL28B 基因型為 CC 之患者 SVR24 的比例為 84.5%,non-CC 之族群 2/64
3 SVR24 比例為 84.8% 服藥配合度達 95% 以上的患者有 92.7% 達到 SVR24, 而服藥配合度未達 95% 的患者只有 31% 達到 SVR24 ( 但服藥配合度未達 95% 者其中有約一半的患者是因為治療無效而終止治療, 使配合度未達 95%) (3) 於日本執行之第三期隨機分派對照臨床試驗, 對照組為 telaprevir 使用 12 週合併 PR 治療 24 週 [18] 在次族群分析時發不論針對年齡 性別 FibroTest score HCV RNA 病毒量 IL28B 基因型作分層分析,daclatasvir 合併 asunaprevir 的組別皆有顯著較高的比例達到 SVR12, 然 telaprevir 合併 PR 組中並未扣除中途停止治療者 共有 119 位患者進入未曾治療過之 daclatasvir 合併 asunprevir 組, 最終中有 90.8% 的患者完成治療 ; 另有 111 位進入 telaprevir 合併 PR 組, 最終僅有 67.6% 的患者完成治療 中斷治療的主要原因是因為不良反應與治療無效 Daclatasvir 合併 asunaprevir 組別中有 5% 患者因不良反應停止治療, 有 3.4% 因治療無效而停止治療 Telaprevir 合併 PR 的組別中有 19.8% 因不良反應停止治療, 有 9% 因治療無效停止治療 由於 telaprevir 合併 PR 組有較多人未完成治療, 進一步針對治療失敗者的情形作分析 治療中病毒量突破的患者在 daclatasvir 合併 asunaprevir 組中有 3.4%, 在 telaprevir 合併 PR 組有 5.4% 治療完成時未測得病毒但是後續復發者在 daclatasvir 合併 asunaprevir 組中有 8.7% (10 人 /115 人, 在 telaprevir 合併 PR 組中有 18.8% (16 人 /85 人 ) (4) 於日本執行之長期追蹤試驗 [11] 追蹤期中位數達 27 個月之日本小型研究, 說明以 daclatasvir 與 asunaprevir 合併使用 24 週治療慢性 C 型肝炎病毒基因型為 1b 之患者達 SVR 之患者與未達 SVR 之患者相比, 其肝炎與肝纖維化之相關指標有較顯著之改善 ( 如血中 ALT 與 AFP 下降達統計上顯著之水準 ; 血中 albumin 與血小板數量上升達統計上顯著水準 ; 肝纖維化相關指標如 M2BPGi hyaluronic acid and type IV collagen 之血中濃度改善達統計上顯著之水準 ) 唯該研究使用之 daclatasvir 劑量為每日 60mg,asunaprevir 劑量為每日 400mg (200mg BID), 與本案申請之建議劑量不同 在安全性部分, 總結其結果, 各文獻皆顯示合併 daclatasvir 與 asunaprevir 用於慢性 C 型肝炎病毒基因型 1b 之患者不論其先前治療經驗為未曾治療 受干擾素治療失敗或是無法耐受干擾素治療, 產生嚴重不良反應的患者都不多, 患者由於不良反應中止治療的比例也不多, 基本上此療法是大多數患者可耐受與完成治療的 另於與干擾素為基礎的治療比較的文獻中,daclatasvir 合併 asunaprevir 組別患者發生第三級與第四級不良反應之比例及因不良反應停止治療的比例也較少 四 醫療倫理 : 本藥品沒有特殊倫理議題 3/64
4 五 成本效益 : 建議者建議者提出一分本土情境的成本效用分析, 來探討 daclatasvir /asunaprevir (DCV/ASV) 相較於 pegylated interferon-alpha/ribavirin (PR) 用於治療感染基因型 1b 慢性 C 型肝炎病人的成本效益評估 分析結果顯示無論在未曾接受過治療 曾接受過治療 不適合使用 interferon 治療或對 interferon 具耐受性的病人組別的遞增值成本效果比值 (ICER) 為負值 查驗中心認為此分析結果因部分假設 採用參數 參數來源等疑義與局限, 可能在反應本土國情上具不確定性 六 財務衝擊 : 建議者認為將 daclatasvir 合併 asunaprevir 治療收載於健保後, 將取代 peg-ifn/ribavirin/boceprevir (Victrelis ) 的治療組合 據此預估本品納入健保給付後的 5 年間約有 1 萬人至 1.2 萬人接受治療, 根據建議者之建議價,5 年間的藥費約為 33 億元至 39 億元, 扣除原情境下的藥品費用後, 產生的藥費影響將為 18 億元至 24 億元 ; 若再扣除現有藥品衍生的其他醫療費用 ( 如處置副作用 檢驗費等 ), 則預估本品納入健保給付後將為健保帶來約 13 至 19 億元的醫療支出 查驗中心認為建議者所作的預算影響邏輯大致清楚而合理, 但在可能病人數 市佔率 治療累積等待病人的比例 及費用等估算部分參數有高低估的可能 查驗中心依據建議者提供的財務影響模型校正部分參數, 推估本品納入健保後的第一年至第五年, 約較原建議者的預估人數增加 1,500 至 3,000 人, 以建議者提供的建議價格計算, 本品藥費約為 38 億至 46 億 在不考慮取代 boceprevir 後, 預估本品每年將增加 31 億至 40 億之健保藥費支出, 而整體健保支出部份每年則將增加近 26 億至 36 億 查驗中心考量就目前我國相關流行病學資訊相當有限 本品使用的便利性 干擾素的副作用等情況下, 推估的治療人數不確定性甚高, 進而影響財務分析的結果 4/64
5 財團法人醫藥品查驗中心 Center For Drug Evaluation 表一本次提案藥品與目前健保已收載藥品 ( 參考品 ) 之比較資料 本案藥品 本案藥品 參考品 商品名 Daklinza Sunvepra 無 主成分 / 含量 Daclatasvir Asunaprevir 劑型 / 包裝 60mg 膜衣錠 /30mg 膜衣錠 100mg 軟膠囊 WHO/ATC 碼 J05AX14 J05AE15 主管機關許可適應症 此次建議健保 1. 與 asunaprevir 併用, 治療先前未曾接受治療 不適合接受 interferon 或 ribavirin 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1b 型感染症 2. 與 asunaprevir peginterferon 及 ribavirin 併用, 治療先前未曾接受治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1 型感染症 慢性 C 型肝炎 Genotype 1b 治療 :(1) 限 ALT 值 1. 與 daclatasvir 併用, 治療先前未曾接受治療 不適合接受 interferon 或 ribavirin 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1b 型感染症 2. 與 daclatasvir peginterferon 及 ribavirin 併用, 治療先前未曾接受治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1 型感染症 慢性 C 型肝炎 Genotype 1b 治療 :(1) 限 ALT 值異常 5/64
6 給付之適應症 異常者, 且 Anti-HCV 與 HCV RNA 均為陽性, 或經由肝組織切片 ( 血友病患及類血友病患經照會消化系專科醫師同意後, 得不作切片 ), 以 METAVIR system 證實輕度纖維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (2) 上述患者如有 NS5A 抗藥相關變異株 (L31 或 Y93) 或非代償性 (decompensated) 肝硬化者, 則不適用此藥物 者, 且 Anti-HCV 與 HCV RNA 均為陽性, 或經由肝組織切片 ( 血友病患及類血友病患經照會消化系專科醫師同意後, 得不作切片 ), 以 METAVIR system 證實輕度纖維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (2) 上述患者如有 NS5A 抗藥相關變異株 (L31 或 Y93) 或非代償性 (decompensated) 肝硬化者, 則不適用此藥物 健保給付條件擬訂中擬訂中 健保給付價擬訂中擬訂中 仿單建議劑量與用法 60 毫克每日口服一次, 於基因型第 1b 型之未曾治療者 曾使用 peginterferon alfa 合併 ribavirin 治療失敗者建議使用 Daklinza 加 Sunvepra 合併治療 24 週 100 毫克每日兩次 Sunvepra 應與 Daklinza 併用或與 Daklinza peginterferon alfa 及 ribavirin 併用 於基因型第 1b 型之未曾治療者 曾使用 peginterferon alfa 合併 ribavirin 治療失敗者建議使用 Daklinza 加 Sunvepra 合併治療 24 週 腎功能不全者需調整劑量, 中或重度肝功能不全者禁用 療程 24 週 24 週 每療程 花費 具直接比較試驗 (head-to-head comparison) 具間接比較 (indirect comparison) 近年來, 最多病人使用或使用量最多的藥品 目前臨床治療指引建議的首選 6/64
7 其他考量因素, 請說明 : 7/64
8 表二主要醫療科技評估組織之給付建議 來源 CADTH( 加拿大 ) PBAC( 澳洲 ) NICE( 英國 ) 最新給付建議 CADTH 於 2015 年 9 月 21 日公告建議收載 daclatasvir 與 sofosbuvir 合併使用於治療先前經 peginterferon 加上 ribavirin 治療無效之慢性 C 型肝炎, 病毒基因型為第 3 型患者 然目前尚未有關於 asunaprevir 之評估報告 ( 審查暫停 ) PABC 公布於 2015 年 3 月進行之會議之報告, 其中建議收載 daclatasvir 與 sofosbuvir 併用於慢性 C 型肝炎病毒基因型第 1 型且先前未曾治療過無肝硬化之患者, 與病毒基因型第 3 型之患者 但 PBAC 於同期公布之報告中並不建議收載 asunaprevir NICE 於 2015 年 11 月發布指引, 建議收載 daclatasvir 合併不同藥物用於慢性 C 型肝炎病毒基因型第 1 型 第 3 型 第 4 型的患者 其中對於病毒基因型第 1 型的患者需與 sofosbuvir 或 sofosbuvir 加上 ribavirin 併用, 且僅限用於有顯著肝纖維化或肝硬化的患者 但截至 2016 年 2 月 17 日止並沒有關於 asunaprevir 的評估報告 註 :CADTH 為 Canadian Agency for Drugs and Technologies in Health 加拿大藥品及醫療科技評估機構的縮寫 ; PBAC 為 Pharmaceutical Benefits Advisory Committee 藥品給付諮詢委員會的縮寫 ; NICE 為 National Institute for Health and Care Excellence 國家健康暨照護卓越研究院的縮寫 8/64
9 坦克干 速威干 醫療科技評估報告 報告撰寫人 : 財團法人醫藥品查驗中心醫藥科技評估組報告完成日期 : 民國 105 年 2 月 24 日前言 : 近年來世界各國積極推動醫療科技評估制度, 做為新藥 新醫材給付決策參考, 以促使有限的醫療資源能發揮最大功效, 提升民眾的健康福祉 醫療科技評估乃運用系統性回顧科學實證證據的方式, 對新穎醫療科技進行療效與經濟評估 為建立一專業 透明 且符合科學性的醫療科技評估機制, 財團法人醫藥品查驗中心 ( 以下簡稱查驗中心 ) 受衛生福利部委託, 對於建議者向衛生福利部中央健康保險署 ( 以下簡稱健保署 ) 所提出之新醫療科技給付建議案件, 自收到健保署來函後, 在 42 個日曆天內完成療效與經濟評估報告 ( 以下稱本報告 ), 做為全民健康保險審議藥品給付時之參考, 並於健保局網站公開 惟報告結論並不代表主管機關對本案藥品之給付與核價決議 本報告彙整國外主要醫療科技評估組織對本案藥品所作之評估結果與給付建議, 提醒讀者各國流行病學數據 臨床治療型態 資源使用量及單價成本或健康狀態效用值可能與我國不同 另本報告之臨床療效分析僅針對本建議案論述, 讀者不宜自行引申為其醫療決策之依據, 病人仍應與臨床醫師討論合適的治療方案 一 背景說明 台灣必治妥施貴寶股份有限公司建議健保新收載藥品 daclatasvir ( 商品名 Daklinza) 與 asunaprevir ( 商品名 Sunvepra) 用於 慢性 C 型肝炎 Genotype 1b 治療 :(1) 限 ALT 值異常者, 且 Anti-HCV 與 HCV RNA 均為陽性, 或經由肝組織切片 ( 血友病患及類血友病患經照會消化系專科醫師同意後, 得不作切片 ), 以 METAVIR system 證實輕度纖維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (2) 上述患者如有 NS5A 抗藥相關變異株 (L31 或 Y93) 或非代償性 (decompensated) 肝硬化者, 則不適用此藥物 之適應症 經衛生福利部中央健康保險署函文, 委託醫藥品查驗中心協助提供醫療科技評估資料, 俾供參考 本案兩項藥品先前並未收載於健保給付藥品中,Daklinza 獲衛生福利部核可之藥品許可證字號為 衛部藥輸字第 號 (30mg) 及 衛部藥輸字第 號 (60mg), 許可之適應症中關於 C 型肝炎 genotype 1b 之內容為 與 asunaprevir 併用, 治療先前未曾接受治療 不適合接受 interferon 或 ribavirin 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1b 型感 9/64
10 染症 Sunvepra 之藥品許可證字號為 衛部藥輸字第 號, 許可之適應症中關於 C 型肝炎 genotype 1b 之內容為 與 daclatasvir 併用, 治療先前未曾接受治療 不適合接受 interferon 或 ribavirin 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前治療無反應 部份反應及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患者 (18 歲及以上 ) 的慢性 C 型肝炎基因型第 1b 型感染症 二 疾病治療現況 <C 型肝炎病毒感染之影響與診斷 > C 型肝炎病毒為一 RNA 病毒, 依其基因型不同共分為 6 型, 第 1 型至 6 型, 各型別對 C 型肝炎病毒之各種療法的反應也不同, 各型別可能又分 a 型或 b 型 我國常見的型別主要為 1b 2a 與 2b, 其中以 1b 最多 [1] 病人感染 C 型肝炎病毒後之急性感染期 (acute infection) 通常是輕微無症狀的, 但有少數患者會有嚴重症狀, 如猛爆性肝炎與肝衰竭 急性感染後之患者有部分會在六個月內即使不接受治療, 體內也會自行清除病毒而痊癒, 但是其中大多數的人 (WHO: 55%~85%, 台灣疾病管制署 : 70%~80%) 在感染 C 型肝炎病毒後會演變成慢性 C 型肝炎病毒的感染 慢性 C 型肝炎可能有症狀, 但常常無臨床症狀, 因其有很大一部分有慢性 C 型肝炎病毒感染的患者並不知道自己有被感染 [2, 3] 慢性 C 型肝炎病毒感染的患者根據肝纖維化不同的程度, 後續轉為肝硬化或肝衰竭的風險也有所不同, 根據一美國的研究 ( 其中約有 66.5% 的 C 型肝炎患者病毒基因型為第 1 型 ), 肝纖維化指數 F0 加上 F1 F2 F3 F4 族群 5 年後進展至肝衰竭 (hepatic decompensation) 的機率分別為 2.3% 3.5% 18.6% 33.6%;5 年後進展至肝癌的機率分別為 0% 1.2% 3.3% 11.7%;5 年後進展至肝衰竭或肝癌任一結果的機率分別為 2.3% 4.7% 19.6% 37.2%;5 年後之總死因死亡率分別為 6.8% 6.9% 13.7% 31.5% 我國根據一長年期追蹤的世代研究( 根據 REVEAL-HCV cohort 及 Taiwan Liver Cancer Network,TLCN 之資料 ), 自 1991 年至 2008 年追蹤慢性 C 型肝炎病毒感染的患者, 結果顯示病毒基因型 1b 的患者其終身罹患肝癌的風險較其他型別的患者來的高 病毒基因型第 1b 型患者發生肝癌的終身發生率與非基因型 1b 的患者相比分別為 29.7% 與 19.2%, 多因子校正後的風險比值為 1.85 (95% CI )[4] 根據此研究的另一分析, 血中可測得 HCV RNA( 即有 C 型肝炎病毒感染 ), 與無法測得 HCV RNA 的受試者的肝癌終身發生率分別為 24.77% 與 3.63% C 型肝炎病毒感染的診斷目前的依據是血清中 anti-hcv 抗體篩檢陽性合併後續 HCV-RNA 陽性確診, 但在同時感 HIV 的患者或是血液透析的患者可能出現 HCV-RNA 陽性但 anti-hcv 為陰性的情形 在治療前必須要評估患者的病毒基因型別 肝纖維化程度與肝功能指標, 這會影響到患者的治療選擇 雖然有慢性 C 型肝炎病毒感染的患者可能肝功能指數是正常的 ( 如 AST/ALT), 但目前主流的共識是除了預期壽命無法藉由治療 C 型肝炎來延長的患者之外, 其餘有慢性 C 10/64
11 型肝炎病毒感染的患者都應該要接受 C 型肝炎病毒的治療 [2, 5, 6] 有些指引建議肝纖維化指數為 F0 或 F1 的患者接受抗病毒治療的迫切程度沒那麼高, 但仍需依照患者的生活型態 其他疾病狀態 及可能傳染他人的程度來決定, 並需接受追蹤 [7] 而對於肝纖維化指數為 F3 或 F4 或肝硬化的患者應優先治療, 而對於已有肝衰竭 (decompensation) 的患者, 則應以無干擾素的療法盡快治療 [5] <C 型肝炎病毒感染之治療方式與治療目標 > 過去 C 型肝炎的治療方式在直接抗病毒藥 (DAA, direct antiviral agents) 問世前, 標準療法是以干擾素 ( 如 interferon-alfa peginterferon alfa 等 ) 為基礎合併口服 ribavirin 的治療為主, 然過去標準治療有許多與藥物相關的副作用, 如貧血 倦怠 噁心等, 再加上干擾素為基礎的治療必須以注射藥物的型式給藥, 雖然台灣的醫療體系中容許患者將藥物帶回家施打, 但是副作用與給藥型式仍然影響很多患者的治療意願, 同時也有許多患者因為副作用的緣故中斷治療, 或是由於條件的限制不合干擾素的治療資格, 因此使許多很可能其實有機會被治癒的慢性 C 型肝炎患者未接受完整的治療, 也無法治癒 因醫藥進步, 後續有口服劑型的 DAA 類 C 型肝炎藥物問世 DAA 藥品的作用機轉為直接干擾 C 型肝病毒的複製 C 肝病毒進入肝細胞後, 會脫去蛋白質外殼, 將基因體 RNA 經轉譯後再經蛋白轉化過程為病毒蛋白質, 最後再組裝病毒, 將病毒釋出細胞 其中病毒蛋白質包括結構蛋白 (structural proteins) 和非結構蛋白 (non-structural proteins); 非結構蛋白包括 NS2 NS3 NS4A NS4B NS5A 及 NS5B, 功能與 RNA 複製有關 目前 DAA 依作用點可分為三類, 第一類是 NS3/4A 蛋白酶抑制劑 (NS3/4A protease inhibitor) 如 boceprevir telaprevir simeprevir paritaprevir 及本案藥品 asunaprevir; 第二類是 NS5B 聚合抑制劑 (NS5B polymerase inhibitor) 如 sofosbuvir dasabuvir; 第三類是 NS5A 抑制劑 (NS5A inhibitor) 如 ledipasvir ombitasvir 及本案藥品 daclatasvir 其訴求特色為全口服 不使用干擾素的療法 減少干擾素相關的副作用等, 與過去以干擾素為基礎的標準治療是相當不同的療法 台灣目前在健保給付的規範下, 僅有給付以干擾素為基礎的療法, 而尚未納入 DAA 類藥物 國際間主要的肝臟相關學會公布之指引, 例如美國肝臟研究學會 (American Association for the Study of Liver Diseases,AASLD) 歐洲肝臟研究學會(European Association for the Study of the Liver,EASL) 或是亞太肝臟研究學會 (Asian Pacific Association for the Study of the Liver,APASL), 皆指出 C 型肝炎病毒感染之治療目標為 治癒 感染, 意即清除患者體內之 C 型肝炎病毒, 以避免 C 型肝炎病毒感染造成之肝臟與非肝臟之相關併發症, 包括壞死性的肝發炎 肝纖維化 肝硬化 肝功能失去代償 (decompensation) 肝癌 其他相關之非肝臟疾患 與死亡 [5-7] 一般而言肝臟功能若失去代償之一定程度之患者, 也會出現其他重要器官之病變, 例如肝性腦病變 (hepatic encephalopathy) 肝腎症候群(hepatorenal syndrome) 肝肺症候群(hepatopulmonary syndrome) 等 11/64
12 雖然對於慢性 C 型肝炎之療法, 應以治療後 C 型肝炎病毒感染相關併發症減少之幅度作為評估療效之指標最能反映該療法的臨床效益, 但在許多國家的法規單位已接受以代表病毒清除程度之相關指標作為替代指標, 例如持續性病毒反應 (sustained virous response,svr), 即為一為許多國家法規單位與學會接受之療效指標 原因是在以干擾素為基礎的慢性 C 型肝炎療法下, 達到 SVR 的患者未來進展至肝衰竭或肝癌的風險顯著的較未達 SVR 的患者風險為低 [8, 9] 然截至本報告完成日為止, 關於能夠證明達到 SVR 狀態可降低肝癌或肝衰竭相關疾病風險的慢性 C 型肝炎療法相關長期研究僅只限於干擾素為基礎的療法 [10] 本案藥品所屬的 DAA 直接抗病毒藥物類別目前尚無可直接證明達到 SVR 能降低肝癌或肝衰竭相關疾病也之長期研究發表 唯有一追蹤期中位數達 27 個月之日本小型研究說明以 daclatasvir 與 asunaprevir 治療慢性 C 型肝炎患者達 SVR 之患者 (26 人 ) 與未達 SVR(non-SVR) 之患者 ( 共 4 人 ) 相比, 其肝炎與肝纖維化之相關指標有較顯著之改善 於治療後 27 個月時達 SVR 之患者之血中 ALT 指數與甲型胎兒蛋白 (α-fetoprotein,afp) 下降達統計上顯著之水準 ; 血中白蛋白 (albumin) 與血小板數量上升達統計上顯著水準 ; 肝纖維化相關指標如 M2BPGi hyaluronic acid and type IV collagen 之血中濃度於達 SVR 之患者改善達統計上顯著之水準 而 non-svr 之患者上述指標於追蹤時與治療前相比無明顯差異 唯該研究使用之 daclatasvir 劑量為每日 60mg,asunaprevir 劑量為每日 400mg (200mg BID), 與本案申請之建議劑量不同 [11] 以 SVR 作為療效指標尚需注意有少部分經治療達到 SVR 的 C 型肝炎患者在後續追蹤期間仍發生肝癌, 甚至可在達到 SVR 數年之後才發生肝癌 因此,C 型肝炎患者經治療達到 SVR 並不能代表其肝臟功能惡化或進展之肝癌之可能性就此終止, 僅是發生肝衰竭與肝癌之機會較未達 SVR 及未治療之患者來的低 我國於 2006 年發表的一項研究追蹤 1619 位經干擾素治療的基因型 1 型 C 型肝炎患者, 追蹤期間為 12 個月至 180 個月不等 ( 平均約 70 個月 ), 達 SVR 之患者之肝癌年發生率為 0.33%, 未達 SVR 之患者肝癌年發生率為 2.2% 若針對其中在治療前尚無肝硬化之患者分析, 則在無肝硬化之次族群中達 SVR 之患者其肝癌年發生率為 0.09%, 未達 SVR 之患者肝癌年發生率為 0.85%[9] 有其他文獻回顧提及患者之肝纖維化狀態 血小板數目 甲型胎兒蛋白 (AFP) 指數可能與已達 SVR 之患者後續發生肝癌之機會有關, 而患者達到 SVR 後之肝纖維化持續進展的狀態也與後續肝癌發生的機會有關 [12] 此外,C 型肝炎患者即使達到 SVR, 仍有再復發的可能性 有一統合分析指出在 C 型肝炎再感染的低風險族群中, 治療後達到 SVR 的患者, 治療後五年的復發率 (relapse) 為 0.40% (95% CI, 0.35% 1.05%), 而再感染率 (reinfection) 為 0.00% (95% CI, 0.00% 0.00%) 在 C 型肝炎再感染的高風險族群中, 治療後達到 SVR 的患者, 若再發現患者有 C 型肝炎病毒的感染, 多半是因為再感染 (reinfection) 而非復發 (relapse) 也因此,C 型肝炎患者即便經治療後達到 SVR, 也仍需持續接受追蹤其肝功能 肝臟影像學檢查, 以及病毒感染是否有復發或再 12/64
13 感染之情形 [13] SVR 之定義為完成療程後之 12 週後 (SVR12) 或 24 週後 (SVR24), 患者血液中之 HCV RNA 降到測不到的程度 ( 即低於特定檢驗方法可偵測之下限值 ), 而檢驗方法需屬於一分子檢驗方法 檢驗方法之偵測下限值依各個單位發布的指引略有不同, 亞太肝臟研究學會建議之檢測下限值應小於或等於 50 IU/mL[7], 而歐洲肝臟研究學會建議之下限值應小於或等於 15IU/ml[5], 美國肝臟研究學會則建議該檢驗法需屬於核酸檢驗法且檢測下限值小於或等於 25IU/ml[6] 對於 SVR 之計算方法, 目前 AASLD 與 EASL 與歐美法規單位對於 SVR12 或 SVR24 皆可接受, 原因是兩者之一致性可達 99%[14], 然而於臨床試驗或實際臨床運用時得到的 SVR 結果上, 兩者還是有些微的差異 有研究指出可以以 SVR24 的結果推估未來將近 4 年患者血液中病毒量的狀況, 在該試驗中, 若患者達到 SVR24, 則有 99% 的患者在未來數年血液中仍測不到 HCV RNA, 但仍有很少部分的患者在結束治療後 2 年左右血液中又可測得 HCV RNA, 但原因不明 [15] 而亞太肝臟研究學會 APASL 於 2012 年公布的指引仍以 SVR24 作為治療目標, 尚不包括 SVR12[7] 根據各學會最新公布的指引,AASLD 與 EASL 皆建議對於慢性 C 型肝炎病毒基因型第 1 型之患者, 應該優先選擇以合併特定種類直接抗病毒藥物 (direct antiviral agents,daa, 本案藥品亦屬此類別 ) 之療法, 且不再建議使用僅含 ribavirin 與干擾素類藥物, 如 interferon(ifn) 及長效干擾素 peginterferon (peg-ifn) 之療法, 原因是與 DAA 類藥物相較, 干擾素為基礎的治療有較多的副作用,SVR 也較低, 另外干擾素治療必須注射藥物, 病人用藥滿意度較低, 較不如 DAA 類藥物以口服治療方便 然 EASL 指引仍有說明, 若該地區尚無法取得特定種類之 DAA 類藥物, 則合併 ribavirin 與干擾素之治療仍是可以考量的療法 [5, 6] APASL 於 2012 年公布之指引中仍以干擾素為基礎之療法作為建議治療, 尚無新版指引公布 [7] 各學會對於慢性 C 型肝炎病毒基因型 1b 感染之患者建議治療如下 : 美國肝臟研究學 (AASLD)[6] AASLD 對病毒基因型 1b 的患者建議療法如下 : (1) 未曾治療過之慢性 C 型肝炎病毒基因型 1b 患者 : 無肝硬化者每日 daclatasvir 60mg 合併 sofosbuvir 400mg 治療 12 週 ( 證據等級 I-B), 有肝硬化者治療 24 週, 也可考慮再加上 ribavirin 合併治療 ( 證據等級 IIa-B) (2) 未曾治療過之慢性 C 型肝炎病毒基因型 1b 患者也可考慮使用 ledipasvir 每日 90 mg 與 sofosbuvir 每日 400 mg 合併治療 12 週 ( 證據等級 I-A) (3) 未曾治療過之慢性 C 型肝炎病毒基因型 1b 患者也可考慮使用 paritaprevir (150 mg)/ritonavir (100 mg)/ombitasvir (25 mg) 之複方藥物每日兩次加上 dasabuvir 250 mg 每日兩次合併治療 12 週 ( 證據等級 I-A) (4) 未曾治療過之慢性 C 型肝炎病毒基因型 1b 患者也可考慮對於無肝硬化者使用 simeprevir 每日 150 mg 合併 sofosbuvir 每日 400 mg 治療 12 週, 對有肝硬 13/64
14 化者合併 24 週, 也可再合併 ribavirin ( 證據等級 I-A) 以下幾種處方則不建議用於未經治療過的病毒基因型第 1 型 C 型肝炎患者 : (1) Sofosbuvir 每日 400mg 合併 ribavirin 治療 24 週 ( 證據強度 IIb-A) (2) PEG-IFN 合併 ribavirin 治療, 或再合併 sofosbuvir simeprevir telaprevir 或 boceprevir 治療 12 週至 48 週 ( 證據強度 IIb-A) (3) PEG-IFN 或 ribavirin 或 DAA 類藥物之單方治療 ( 證據等級 III-A) 歐洲肝臟研究學會 (EASL)[5] 2015 年 EASL 對病毒基因型第 1 型的患者建議療法如下 : 1. 含干擾素的療法 : (1) Peginterferon-alpha 合併 ribavirin 及 sofosbuvir 每日 400 mg 治療 12 週 ( 證據等級 A1) (2) Peginterferon-alpha 合併 ribavirin 及 simeprevir 每日 150 mg 治療 12 週, 接著繼續使用 PR 治療 12 週 ( 先前未曾治療者或復發者, 有肝硬化者亦同 ) 或 36 週 ( 對先前治療無反應者, 有肝硬化者亦同 ) 2. 不含干擾素的療法 (interferon free): (1) Sofosbuvir 400 mg 與 ledipasvir 90 mg 複方使用每日一次, 於無肝硬化者 ( 不論先前是否曾接受過治療 ) 使用 12 週, 有肝硬化者應於 12 週中加上 ribavirin 使用 有肝硬化者若無法接受 ribavirin 治療則 sofosbuvir 合併 ledipasvir 的複方可延長使用至 24 週 (2) Ombitasvir 12.5 mg 加上 paritaprevir 75 mg 與 ritonavir 50 mg 的複方每日兩次合併 dasabuvir 250 mg 每日兩次 於病毒基因型 1b 無肝硬化的患者使用 12 週, 若基因型 1b 的患者有肝硬化, 則應於 12 週合併 ribavirin 使用 (3) Sofosbuvir 400mg 合併 simeprevir 150 mg 每日一次治療 12 週, 若患者有肝硬化應再加上 ribavirin, 若無法使用 ribavirin 則肝硬化的患者可延長治療為 24 週 (4) Sofosbuvir 400mg 與 daclatasvir 60 mg 每日一次合併治療 12 週, 若患者有肝硬化應再加上 ribavirin, 若無法使用 ribavirin 則肝硬化的患者可延長治療為 24 週 亞太肝臟研究學 (APASL)[7] APASL 自 2012 後尚無新版指引公布 APASL 建議於病毒基因型第 1 型的患者使用每週一次皮下注射長效干擾素 peginterferon alfa 合併每日口服 ribavirin (PR 治療 ) Peginterferon alfa-2a 建議劑量為每週 180 μg 而 peginterferon alfa-2b 則為每週每公斤體重 1.5 μg Ribavirin 的建議劑量對於體重 75 公斤以下的患者為每日 1,000 mg, 體重 75 kg 以上的患者為每日 1200 mg 而病毒基因型第 1 型的患者應接受長達 1 年的治療 14/64
15 APASL 另外有提到對於先前治療無反應者, 再使用 PR 治療只有 10%~15% 的慢性 C 型肝炎患者能達到 SVR, 而對於病毒復發者則為 40~50% 的患者可達到 SVR 而學會認為雖然復發者再使用 PR 而不合併使用 DAA 治療仍然也可能達到 SVR, 不過隨著時代進展, 合併 DAA 使用的三合一治療應該作為先前對傳統 PR 治療無反應的 C 型肝炎患者的標準治療 < 我國治療現況 > 根據亞太肝臟研究學會 APASL 於 2015 年發表的文獻, 台灣之 C 型肝炎病毒感染之盛行率為 4.4% 至 8.6%, 主要之 C 型肝炎病毒感染風險因子為輸血 刺青 醫療處置 家人有人感染 C 型肝炎病毒與注射藥物毒癮者 台灣 C 型肝炎病毒感染患者之病毒基因型的盛行率約 53% 為基因型 1b (genotype 1b), 其餘 47% 為基因型 2a 與 2b[1] 過去接受干擾素相關療法之成效方面, 若是以 interferon 加上 ribavirin 合併使用 24 週之療法於基因型第一型之患者持續病毒反應率 (SVR) 為 41% 至 53%, 非基因型第一型之患者 SVR 為 87% 至 93%; 若是以 peginterferon 加上 ribavirin 合併使用 48 週用於基因型第一型之患者其 SVR 為 70% 至 75%, 合併使用 24 週於基因型第二型之患者其 SVR 為 85% 至 90% 若是由治療中的反應再進一步對療程作區別, 則可發現針對原本病毒量不高 ( IU/ml) 且達到 RVR (rapid virous response, 即於治療開始 4 週後血清中 HCV RNA 病毒量即低於檢測極限 ) 的患者, 基因型第一型之患者僅需 24 週之 peginterferon 合併 ribavirin 療法即可達到 94% 至 96% 之 SVR, 而達到此條件之基因型第二型患者僅需 16 週之合併治療也可達到 98% 以上之 SVR[1] 另有 2008 年文獻指出台灣基因型第一型的 C 型肝炎患者若可達到低病毒量與 RVR 的兩個條件, 接受 24 週 peginterferon 合併 ribavirin 治療者其 SVR24 為 96.4% 而其復發率 (relapse) 為 3.6%, 若是達到這兩個條件的患者延長治療為 48 週, 則 SVR24 為 100%, 復發率為 0%[16] 台灣 C 型肝炎患者之 IL28B 基因型具有數種單核苷酸多型性 (single-nucleotide polymorphism,snp), 可能與干擾素治療之療效反應有關 以 IL28B rs 之 SNP 為例, 於台灣 C 型肝炎病毒基因型第一型之患者中, IL28B rs 之 SNP 為 TT 型者佔 80~85%, 而 C 型肝炎病毒基因型第二型之族群中,IL28B rs snp 為 TT 型者佔 85~90%, 此種 IL28B rs TT 之 SNP 型別為對於干擾素治療反應較好的族群 [1] 然對於 DAA 類藥物之療效方面,IL28B 之 SNP 型別則似乎影響不大 本案藥品 daclatasvir 與 asunaprevir 之樞鈕試驗中, 針對先前未曾接受治療之慢性 C 型肝炎患者, 不論受試者之 IL28B 基因型為 IL28B CC/CT 或 TT, 其 SVR 皆達 88% 以上 然而, 此試驗僅有針對 IL28B rs SNP 分型之分析結果而無其他位置的 SNP[17] 另一 daclatasvir 合併 asunaprevir 用於日本慢性 C 型肝炎病毒基因型 1b 患者之臨床試驗中, 則發現 IL28B SNP rs 或 rs 上不論其 SNP 之型別為何, 併用 daclatasvir 與 asunaprevir 治療之 SVR12 皆可達 86.8% 以上 [18] 15/64
16 三 疾病治療藥品於我國之收載現況 在世界衛生組織藥物統計方法整合中心 (WHO Collaborating Center for Drug Statistics Methodology 頁面下 [19], 查詢到本案申請藥品 Daclatasvir 之 ATC 碼為 J05AX14,Asunaprevir 之 ATC 碼為 J05AE15, 皆屬直接抗病毒藥物 (J05A,direct acting antivirals) Daclatasvir 為 其他抗病毒藥物 (J05AX),Asunaprevir 為蛋白質酶抑制劑 (J05AE,Protease inhibitors) 成分 於 J05AX 層級下, 共有 17 項不同的藥品且其中有三項 ATC code 中含兩種以上藥物成分 a ; 於 J05AE 層級下, 共有 14 項不同的藥品 b 經逐一查核, 除本案申請藥品外, 目前已經獲得我國上市許可且未註銷者共有 lysozyme inosine pranobex raltegravir maraviroc dolutegravir daclatasvir( 本案申請藥物 ) sofosbuvir sofosbuvir/ledipasvir ritonavir atazanavir tipranavir darunavir boceprevir asunaprevir( 本案申請藥物 ) 等 14 項 其中僅 sofosbuvir sofosbuvir/ledipasvir boceprevir 本案藥品 daclatasvir 與 asunaprevir 於我國有獲得用於 C 型肝炎治療之相關適應症 為了解我國現有 C 型肝炎相關之治療藥品, 以下列關鍵字查詢 TFDA 藥品許可證資料庫 : 以 C 型肝炎 為關鍵字查詢並限制許可證類型為未註銷且類別為藥品許可證 [20]: 共得到 8 種不同成份 (eltrombopag olamine ribavirin boceprevir sofosbuvir sofosbuvir/ledipasvir interferon alpha-2a peginterferon alfa-2b 及 peginterferon alfa-2a) 13 種不同藥名 ( 同藥名下有不同劑型劑量 ) 共 25 品項 :Revolade film-coated tablets 25mg/50mg Robatrol capsules 200mg Ribarin capsules 200mg LIV-UP capsule 200mg Rebetol capsule 200mg Zyverin capsules 200mg Copegus film-coated tablets 200 mg Victrelis capsule 200mg Sovaldi film-coated tablets 400mg Harvoni tablets Roferon-A (solution for injection) Peg-Intron powder for injection 50mcg/80mcg/100mcg/120mcg per vial Pegasys pre-filled syringes 90mcg/135mcg/180mcg per 0.5 ml 其中 Revolade film-coated tablets 之適應症中與肝臟疾患相關處為可用於治療肝炎患者之血小板低下疾患, 並無抗病毒功效 在關於 C 型肝炎治療之適應症部分,ribavirin 類之藥物需與 peginterferon alfa 或 interferon alfa 併用 ;Victrelis (boceprevir) 需與 peginterferon alfa 及 ribavirin 併用 ;Sovaldi (sofosbuvir) 應與 ribavirin 併用, 或與 pegylated interferon 及 ribavirin 併用, 仿單中並未說明其他可併用於 C 型肝炎患者治療之 a moroxydine(j05ax01) lysozyme(j05ax02) inosine pranobex(j05ax05) pleconaril(j05ax06) enfuvirtide(j05ax07) raltegravir(j05ax08) maraviroc(j05ax09) maribavir(j05ax10) elvitegravir(j05ax11) dolutegravir(j05ax12) umifenovir(j05ax13) daclatasvir(j05ax14) sofosbuvir(j05ax15) dasabuvir(j05ax16) sofosbuvir and ledipasvir(j05ax65) dasabuvir, ombitasvir, paritaprevir and ritonavir(j05ax66) ombitasvir, paritaprevir and ritonavir(j05ax67) b saquinavir(j05ae01) indinavir(j05ae02) ritonavir(j05ae03) nelfinavir(j05ae04) amprenavir(j05ae05) fosamprenavir(j05ae07) atazanavir(j05ae08) tipranavir(j05ae09) darunavir(j05ae10) telaprevir(j05ae11) boceprevir(j05ae12) faldaprevir(j05ae13) simeprevir(j05ae14) asunaprevir(j05ae15) 16/64
17 藥物 本案藥品 daclatasvir 與 asunaprevir 之適應症依照建議者檢附之衛生福利部許可函中所示,daclatasvir 應與 asunaprevir 併用或與 asunaprevir peginterferon 及 ribavirin 併用,asunaprevir 應與 daclatasvir 併用或與 daclatasvir peginterferon 及 ribavirin 併用 關於其健保收載狀態為, 依據衛生福利部中央健康保險署所公告之 全民藥品給付規定 查詢 [21],Ribavirin 類藥品有收載於健保中, 可有條件用於參加 全民健康保險加強慢性 B 型及慢性 C 型肝炎治療試辦計畫 之 慢性病毒性 C 型肝炎患者且應與 interferon-alfa 2a 或 interferon-alfa 2b 或 interferon alfacon-1 或 peginterferon alfa-2b 或 peginterferon alfa-2a 合併治療 Interferon alpha-2a peginterferon alfa-2a peginterferon alpha-2b 類藥品有收載於健保中, 可有條件用於參加 全民健康保險加強慢性 B 型及慢性 C 型肝炎治療試辦計畫 之 慢性病毒性 C 型肝炎患者且應與 ribavirin 併用 而 boceprevir sofosbuvir sofosbuvir/ledipasvir 及本案藥品 daclatasvir 及 asunaprevir 皆尚未收載於健保中 與本案申請藥品具有相近治療地位, 於我國已上市且有獲健保收載之藥品, 其相關給付規定內容整理如下表 所謂 相近治療地位, 指主要與 C 型肝炎治療有關之治療指引 ( 如 AASLD EASL APASL 指引 ) 中有提及可用於本案建議者建議給付族群之藥品品項, 然不一定於我國有獲得 C 型肝炎治療之適應症 表三與本案藥品具有相近治療地位之藥品 ATC 分類碼我國許可適應症成分名 J05AB04 1. 與 Peginterferon Alfa Ribavirin 或 Interferon Alfa 併用治療於 :(1) 曾經使用 Interferon Alfa 單一療法治療後又復發的慢性 C 型肝炎 (2) 首次接受治療的慢性 C 型肝炎 (3) 合併感染臨床穩定 HIV 的慢性 C 型肝炎 2. 與 Peginterferon Alfa 併用治療於曾以 Interferon Alfa 併用 Ribavirin 治療無效或復發之慢性 C 型肝炎 獲健保收載之劑型 200mg 口服膠囊 (Capsule) 200mg 膜衣錠 (film-coated tablets) 健保現行給付條件 ( 詳見附錄一 ) 1. 限用於參加 全民健康保險加強慢性 B 型及慢性 C 型肝炎治療試辦計畫 之下列慢性病毒性 C 型肝炎患者且應與干擾素合併治療 : 限 ALT 值異常者, 且 Anti-HCV 與 HCV RNA 均為陽性 ( 略 )... 且無肝功能代償不全者 (98/11/1) 2. 療程依 Viral 17/64
18 Kinetics 區分如 下 ( 略 ) L03AB11 1 治療慢性 B 型肝炎 : 對於 135mcg/0.5ml 1. 限用於參加 全 Peginterferon alfa-2a 沒有肝硬化的病人以及有代 注射劑與 民健康保險加強 償功能的肝硬化病人, 珮格西 180mcg/0.5ml 慢性 B 型及慢性 施適合用來治療 HBeAg 陽性 注射劑 C 型肝炎治療試 或 HBeAg 陰性, 有病毒複製 辦計畫 之下列 和肝臟發炎證據之慢性 B 型 慢性病毒性 B 型 肝炎 2 治療慢性 C 型 或慢性病毒性 C 肝炎成人病患 : 珮格西 型肝炎患者 施可單獨或合併其他 (1) 用於慢性病毒性 B 治療 C 型肝炎藥物一 型肝炎患者 ( 略 ) 起使用, 適合用來治療 (2) 用於慢性病毒 沒有肝硬化的病人以 性 C 型肝炎治療 及有代償功能的肝硬 時 : 化病人之慢性 C 型肝 Ⅰ. 應與 Ribavirin 炎 併用 Ⅱ. 限 ALT 值異 常者, 且 Anti-HCV 與 HCV RNA 均為 陽性, 或經由肝 組織切片 ( 血友病 患及類血友病患 經照會消化系專 科醫師同意後, 得不作切片 ) 以 METAVIR system 證實輕度纖維化 大於或等於 F1 及肝炎變化, 且 無肝功能代償不 全者 (98/11/1) III. 療程依 Viral Kinetics 區分 ( 略 ) (98/11/1) L03AB10 用於治療慢性 C 型肝 50mcg/vial 1. 限用於參加 全 Peginterferon alfa-2b 炎 80mcg/vial 民健康保險加強 18/64
19 100mcg/vial 慢性 B 型及慢性 120mcg/vial C 型肝炎治療試 凍晶乾粉注射 辦計畫 之下列 劑 慢性病毒性 C 型 肝炎患者, 且應 與 ribavirin 併 用 2. 限 ALT 值異常 者, 且 Anti-HCV 與 HCV RNA 均 為陽性, 或經由 肝組織切 片 ( 略 ) 且無 肝功能代償不全 者 (98/11/1) 3. 療程依 Viral kinetics 區分 ( 略 )(98/11/1) L03AB04 卡波西氏肉瘤 多毛狀細胞白 注射劑 1. 限用於參加 全 Interferon alfa-2a 血球過多病 對活性慢性 B 民健康保險加強 型肝炎可能有效 慢性骨髓白 慢性 B 型及 C 血病 皮膚 T 細胞淋巴瘤 型肝炎治療試辦 慢性 C 型肝炎 腎細胞 計畫 之下列慢 癌 非何杰金氏淋巴瘤 尖頭 性病毒性 B 型或 濕疣 慢性病毒性 C 型 肝炎患者 (1) 用於慢性病毒性 B 型肝炎患者 ( 略 ) (2) 用於慢性病毒 性 C 型肝炎治療 時 : Ⅰ. 應與 Ribavirin 併用 Ⅱ. 限 ALT 值異 常者, 且 Anti-HCV 與 HCV RNA 均為 陽性, 或經由肝 19/64
20 組織切片 ( 血友病患及類血友病患經照會消化系專科醫師同意後, 得不作切片 ) 以 METAVIR system 證實輕度纖維化大於或等於 F1 及肝炎變化, 且無肝功能代償不全者 (98/11/1) III. 療程依 Viral Kinetics 區分 ( 略 ) (98/11/1) 2. 限用於下列癌瘤病患 限 interferon alpha-2a ( 如 Roferon-A) 及 interferon alpha-2b ( 如 Intron A)( 略 ) J05AX14 (1) 與 asunaprevir 併 30mg/60mg 口 慢性 C 型肝炎 Daclatasvir 用, 治療先前未曾接受 服膜衣錠 Genotype 1b 之 治療 不適合接受 (tablets) 治療給付建議收 interferon 或 ribavirin 載中 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前 治療無反應 部份反應 及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患 者 (18 歲及以上 ) 的慢 性 C 型肝炎基因型第 1b 型感染症 (2) 與 asunaprevir peginterferon 及 ribavirin 併用, 治療先 前未曾接受治療或先 前曾以 interferon 及 ribavirin 治療失敗 ( 包 20/64
21 括對先前治療無反 應 部份反應及復發 ) 之代償性肝病 ( 包括肝 硬化 ) 成人患者 (18 歲 及以上 ) 的慢性 C 型肝 炎基因型第 1 型感染 症 J05AE15 (1) 與 daclatasvir 併 100mg 軟膠囊 慢性 C 型肝炎 Asunaprevir 用, 治療先前未曾接受 (capsules) Genotype 1b 之 治療 不適合接受 治療給付建議收 interferon 或 ribavirin 載中 治療或先前曾以 interferon 及 ribavirin 治療失敗 ( 包括對先前 治療無反應 部份反應 及復發 ) 之代償性肝病 ( 包括肝硬化 ) 成人患 者 (18 歲及以上 ) 的慢 性 C 型肝炎基因型第 1b 型感染症 (2) 與 daclatasvir peginterferon 及 ribavirin 併用, 治療先 前未曾接受治療或先 前曾以 interferon 及 ribavirin 治療失敗 ( 包 括對先前治療無反 應 部份反應及復發 ) 之代償性肝病 ( 包括肝 硬化 ) 成人患者 (18 歲 及以上 ) 的慢性 C 型肝 炎基因型第 1 型感染 症 J05AX15 Sovaldi 與其他藥物併 400mg 口服膜 慢性 C 型肝炎之 Sofosbuvir 用可以治療成人慢性 衣 錠 治療給付建議收 C 型肝炎 (film-coated 載中 tablets) 21/64
22 四 療效評估報告 ( 含文獻回顧摘要 ) 本報告主要參考 CADTH/pCODR PBAC 及 NICE 之醫療科技評估報告及建 議者提供之資料 ; 輔以其他醫療科技評估組織報告或 Cochrane/PubMed/Embase 相關文獻, 以瞭解主要醫療科技評估組織之給付建議及目前相關臨床研究結果 來源 CADTH/CDEC ( 加拿大 ) PBAC NICE( 英國 ) 其他實證資料 報告日期 CADTH 於 2015 年 9 月 21 日公告建議收載 daclatasvir 與 sofosbuvir 合併使用於治療先前經 peginterferon 加上 ribavirin 治療無效之慢性 C 型肝炎, 病毒基因型為第 3 型患者 然目前尚未有關於 asunaprevir 之評估報告 ( 審查暫停 ) PABC 公布於 2015 年 3 月進行之會議之報告, 其中建議收載 daclatasvir 與 sofosbuvir 併用於慢性 C 型肝炎病毒基因型第 1 型且先前未曾治療過無肝硬化之患者, 與病毒基因型第 3 型之患者 但 PBAC 於同期公布之報告中並不建議收載 asunaprevir NICE 於 2015 年 11 月發布指引, 建議收載 daclatasvir 合併不同藥物用於慢性 C 型肝炎病毒基因型第 1 型 第 3 型 第 4 型的患者 其中對於病毒基因型第 1 型的患者需與 sofosbuvir 或 sofosbuvir 加上 ribavirin 併用, 且僅限用於有顯著肝纖維化或肝硬化的患者 但截至 2016 年 2 月 17 日止並沒有關於 asunaprevir 的評估報告 Cochrane/PubMed/Embase 的搜尋結果 建議者提供之資料 註 :CDEC 為加拿大藥物專家委員會 Canadian Drug Expert Committee 的縮寫 ( 一 ) CADTH/CDEC( 加拿大 )[22, 23] Daclatasvir 於加拿大獲得的適應症許可為與 sofosbuvir 併用於治療慢性 C 型肝炎病毒基因型第 1 型 第 2 型與第 3 型的患者, 有些基因型可用於有肝硬化的患者, 但是對於有肝衰竭的患者, 療效與安全性尚未確立 在加拿大的每日建議劑量為 60mg 每日一次, 共有 60mg 與 30mg 兩種劑型可取得 CADTH 在 2015 年 9 月 21 日公布由 CDEC 作出對 daclatasvir 收載的評估報告 其中建議收載 daclatasvir 用於成人慢性 C 型肝炎基因型第 3 型無肝硬化的患者, 然需與 sofosbivur 併用, 且病人先前需已接受過 pegylated-interferon 加上 22/64
23 ribavirin (PR treatment) 之治療但無反應 此項處方需由肝臟學家與對治療慢性 C 型肝炎有經驗之醫師開立, 且 daclatasvir 加上 sofosbuvira 一療程計畫的總藥費不得超過以 sofosbuvir 合併 ribavirin 作為治療計畫的總藥費 關於 asunaprevir 的評估, 由於 CADTH 後來與建議者討論的結果, 希望 asunaprevir 的審查時程可與 daclatasvir 一致, 因此 asunaprevir 的審查暫時停止, 目前尚無相關評估報告發布 關於 daclatasvir 的建議, 委員會主要是基於一項開放性無對照的臨床試驗 (ALLY-3) 的結果作出建議 此試驗的次族群分析中顯示對於慢性 C 型肝炎基因型第 3 型且對先前治療無反應的患者, 使用 daclatasvir 合併 sofosbuvir 合併治療 12 週, 其 SVR12 可達 86% (95% CI, 74%-94%) 限制用於無肝硬化且對先前治療無反應的患者的原因是因為委員會針對建議者檢送之藥物經濟學資料再分析後, 發現在無肝硬化的患者中, 使用 daclatasvir 與 sofosbuvir 併用治療與 sofosbuvir 與 ribavirin 併用治療 24 週相比時, 前者較具有成本效果 (cost-effective) 但在已有肝硬化, 或是先前未曾治療過之慢性 C 型肝炎基因型第 3 型之患者族群則不較具有成本效果 但委員會聲明此評估報告並不是在主張慢性 C 型肝炎第 3 型之患者必須要以 peginterferon 加上 ribavirin 作為第一線治療 關於藥品相關的臨床試驗評估委員會的考量是基於一針對兩開放性臨床試驗的系統性文獻回顧 (ALLY-3 與 study 040) ALLY-3 是針對慢性 C 型肝炎基因型第 3 型的患者, 而 study 040 包括基因型第 1 型 第 2 型與第 3 型的患者 兩個試驗皆排除同時有 HBV 或 HIV 感染的患者 肝功能失去代償的肝衰竭患者 (decompensated) 與藥癊者 採用之治療方式主要為 daclatasvir 合併 sofosbuvir, 可能再併用或不併用 ribavirin 這兩個臨床試驗的主要療效指標為達到 SVR12 的比例 而 CDEC 於評估這兩個臨床試驗結果時主要考量的療效指標為 SVR12 復發情形 (relapse) 與 EQ-5D 的結果 委員會認為這兩個試驗的規模都很小, 也無對照組而且是開放性設計因此試驗品質因此受限, 不過試驗設計的方式與目前其他 DAA 類藥物的臨床試驗設計是一致的 然而, 委員會也提到目前並沒有 daclatasvir 與 sofosbuvir 合併治療與其他加拿大可取得的 DAA 類藥物直接比較療效的研究 同時, 目前對於先前接受 DAA 類藥物治療失敗的病人族群相關的資料也很有限 委員會評估的摘要如下 : (1) 療效部分對於使用 daclatasvir 與 sofosbuvir 合併治療但不包括 ribavirin 的療法,ALLY-3 試驗中各組條件的患者接受合併治療 ( 無 ribavirin) 之時間為 12 週, 於 study 040 中則為 12 週或 24 週, 各組達 SVR12 之比例如下 : SVR12 之比例 ALLY-3 Study 040 先前未經治療 C 型肝炎病毒基因型第 3 基因型第 1 型接受 12 週型接受 12 週治療 :90% 治療 :100% 基因型第 1 型接受 24 週治療 :100% 23/64
24 基因型第 2 型或第 3 型接受 24 週治療 :100% 先前曾接受其他治療 C 型肝炎病毒基因型第 3 型接受 12 週治療 :86% 基因型第 1 型接受 24 週治療 :100% 於 ALLY-3 中, 有肝硬化的患者達到 SVR12 比例較低, 為 58% 至 69%, 無 肝硬化者則為 94% 至 97% 於 study 040 中, 若再加上 ribavirin 合併治療 24 週, 則於基因型第 2 型或第 3 型先前未經治療的患者, 其達到 SVR12 之比例為 86% 關於復發之情形, 於 ALLY-3 中先前未經治療之病毒基因型第 3 型患者復發 率為 9%, 先前曾接受過其他治療者復發率為 14%, 於 study 040 中則無復發案例 被報告 在生活品質的部分,ALLY-3 試驗中在治療中 治療完成時 治療完成 12 週後收集到的生活品質分數相比沒有臨床上有意義的差異 (2) 健康危害部分併用 daclatasvir 與 sofosbuvir 治療時最常被報告的不良反應為頭痛 (20% 至 34%) 噁心(0% 至 36%) 與疲倦 (14% 至 50%) 有發生至少一項不良反應之患者比例於 ALLY-3 中接受 12 週治療的患者為 66% 至 78%; 於 study 040 中接受 12 週治療者為 93%, 接受 24 週治療者則為 76% 至 93% 有發生至少一項嚴重不良反應之患者比例於 ALLY-3 中接受 12 週治療的患者為 0% 至 1%; 於 study 040 中接受 12 週治療者為 2%, 接受 24 週治療者為 0% 至 14% 因嚴重不良反應中止治療者於 ALLY-3 中為 0%, 於 study 040 接受 12 週治療者為 0%, 接受 24 週治療者為 0 至 7% (3) 病人團體方面委員會也考量了 4 個病人團體的意見 (Patient Input Information) 病人團體認為慢性 C 型肝炎病毒感染可能會造成肝硬化 肝癌 肝衰竭與死亡, 是一種可能會致命的疾病 病人也可能會覺得很疲倦 沒胃口 噁心 腹痛 肌肉酸痛 黃疸 搔癢 睡眠問題 頭痛 循環變差, 甚至有可能造成認知功能障礙 病人也必須面對 C 型肝炎病毒感染帶來的汙名化可能性, 並因為擔心被他人拒絕及歧視因此不敢透露自己受到感染 患者的家人與照顧者也可能因為病人的症狀與相關疾病造成經濟 心理 身體上的負擔, 並可影響到家人之間的關係與對孩童的照顧 病人團體認為由於 daclatasvir 毒性不高也較少有藥物交互作用, 因此對於無法耐受干擾素治療或不合干擾素治療條件的患者來說, 這是一個新的治療機會, 而這類條件患者的治療需求在先前是未被滿足的 (unmet patient needs) 病人團體也認為 daclatasvir 所需的療程較短 不良反應較少, 也不用吃太多藥 而病人團體認為對治療有反應的患者很多, 這是最重要的 CDEC 認為病人團體由於過往干擾素為基礎的治療有許多不良反應, 因此他 24/64
25 們會較喜歡其他不需干擾素的有效治療 CDEC 認為 daclatasvir 與 sofosbuvir 併 用的療法不需要用到干擾素或 ribavirin 也能用於治療病毒基因型第 3 型的無肝硬 化慢性 C 型肝炎患者 ( 二 ) PBAC( 澳洲 )[15] Daclatasvir 於澳洲取得的許可適應症為與 sofosbuvir 或與 asunaprevir 併用治 療肝功能尚可代償之慢性 C 型肝炎患者, 其中與 asunaprevir 併用僅限用於病毒 基因型 1b 之患者, 且僅限 60mg 之劑型 PABC 公布於 2015 年 3 月進行之會議之報告, 其中建議收載 daclatasvir 與 sofosbuvir 併用於慢性 C 型肝炎病毒基因型第 1 型且先前未曾治療過無肝硬化之患者, 與病毒基因型第 3 型之患者 主要原因是基於與不治療相比 (no treatment), 此療法較具有成本效果,PBAC 並未採用與其他療法如 ledipasvir 合併 sofosbuvir 或是 sofosbuvir 合併 ribavirin 等療法相互比較其成本效果的作法來評估此案 但 PBAC 對於各別疾病的療程費用都有做出建議, 建議此療法用於基因型第 1 型的總療程費用應與 ledipasvir 合併 sofosbuvir 的費用相同, 而用於基因型第 3 型時的總療程費用應與 sofosbuvir 合併 ribavirin 相同 對於某些類型的 C 型肝炎患者,PBAC 認為沒有足夠的證據支持 daclatasvir 與 sofosbuvir 合併治療 12 週的療法的臨床效益 這些類型的患者包括先前接受過治療的病毒基因型第 1 型患者與有肝硬化但未經治療的病毒基因型第 1 型患者, 及病毒基因型第 2 型 第 4 型 第 5 型與第 6 型的患者 PBAC 表示他們知道新的 C 型肝炎治療可達到較高的 SVR12, 他們也注意到有許多病人 醫療專業人員與組織認為不使用干擾素的新治療可能具有較好的治療可近性 (availability, 即此療法較容易被取得 ) PBAC 認為收載新的全口服藥療法是合宜的, 因為就長期觀點來看, 對取得治療與提升受治療率都有幫助 這也符合一些關於 C 型肝炎的大型國家計畫的目標, 包括提升基層醫療人員在治療 C 型肝炎上的角色 降低治療的副作用與簡化療法的實施方式 PBAC 表示建議者在送審資料中對於 daclatasvir 合併 sofosbuvir 用於病毒基因型第 1 型的患者時採用的比較品是一種蛋白酶抑制劑合併 peginterferon 與 ribavirin (PR) 的療法, 而用於其他病毒基因型的患者時採用的比較品是 PR 療法 雖然若是對於一位希望積極治療 C 型肝炎的患者來說, 這樣的比較品可能是適當的, 然而就目前的狀況而言, 許多患者其實是因為較難耐受或接受干擾素治療, 因此選擇不治療 C 型肝炎, 所以 PBAC 在先前的會議認為比較適當的比較品是 無治療 (no treatment) 然 PBAC 表示, 由於 ledipasvir 合併 sofosbuvir 等含有 sofosbuvir 的療法在澳洲可能成為大多數慢性 C 型肝炎的標準療法, 這類含有 25/64
26 sofosbuvir 的療法將是未來其他口服 C 型肝炎藥物最適當的比較品 同時, 收載 daclatasvir 也只有可能在 PBS ( 澳洲藥品支付制度,Pharmaceutical Benefits Scheme) 收載 sofosbuvir 後才有可能完成 在療效方面的考量,PBAC 認為雖然建議者檢送之資料中相關臨床試驗皆是小規模且無對照組之臨床試驗, 因此其臨床上與其他療法相比之相對效益 (SVR12) 具有不確定性, 但在目前 DAA 類藥物開發過程中通常都採用無對照組之試驗設計的情形下, 這可能已是能取得的最適當資料了 PBAC 評估 daclatasvir 所採用的臨床試驗資料主要是基於一無對照組的試驗 Study 4040 的結果 此試驗評估 daclatasvir 與 sofosbuvir 併用於慢性 C 型肝炎基因型第 1 型 第 2 型與第 3 型的患者 申請者有檢送 ALLY-1 ALLY-2 與 ALLY-3 試驗的部分內容, 但是委員會認為其中的資料不夠充足, 因此在評估時未予採用 與 sofosbuvir 併用 ribavirin 或併用 ledipasvir 的療法可達到的 SVR12 程度相比,PBAC 認為 daclatasvir 與 sofosbuvir 併用 12 週的療法在相對療效上不劣於 (non-inferiority) ledipasvir 併用 sofosbuvir 用於未經治療的無肝硬化慢性 C 型肝炎病毒基因型第 1 型的患者, 或是不劣於 sofosbuvir 與 ribavirin 併用 24 週於病毒基因型第 3 型的患者, 且療效優於 無治療 而 daclatasvir 併用 sofosbuvir 的療法與其他兩類療法相比在上述兩種族群使用的安全性也是相當的 然而, daclatasvir 併用 sofosbuvir 療法在安全性上是劣於 無治療 的 此外,PBAC 留意到建議者檢送之資料中有關於 daclatasvir 併用 sofosbuvir 與 telaprevir 併用 PR 治療相比之間接比較療效資料 (matching adjusted indirect comparison), 然而, 由於在比較時, 僅在對照組中有肝硬化患者的資料, 在實驗組則無, 因此 daclatasvir 與 sofosbuvir 在此情形下達到 SVR 的相對療效可能被高估, 同時, 其相對療效也無法確定, 因為在此間接比較的設計下, 尚有可交換性 (exchangeability) 的假設有待釐清 不過委員會認同此分析中說明在安全性方面, 與 PR 治療相比,daclatasvir 併用 sofosbuvir 的安全性較好 PBAC 於同期公布之報告中建議 不收載 asunaprevir 主要原因是因為 asunaprevir 併用 daclatasvir 用於病毒基因型 1b 的 C 型肝炎患者在療效上與 ledipasvir 併用 sofosbuvir 的療法, 或是 daclatasvir 併用 sofosbuvir 的療法相比, 並未達到不劣性 (not non-inferior), 且在安全性上 daclatasvir 合併 asunaprevir 的組合也並未較好 在評估上, 主要是採用開放性無對照的臨床試驗 Study 7026 與一部分在安全性評估方面具有雙盲隨機分派對照試驗設計的 Study 7028 的結果, 兩個試驗主要皆收納病毒基因型 1b 的患者 ( 三 ) NICE( 英國 )[24] 26/64
27 NICE 於 2015 年 11 月發布指引, 建議收載 daclatasvir 合併不同藥物用於慢性 C 型肝炎病毒基因型第 1 型 第 3 型 第 4 型的患者 其中對於病毒基因型第 1 型的患者需與 sofosbuvir 或 sofosbuvir 加上 ribavirin 併用, 且僅限用於有顯著肝纖維化或肝硬化的患者 但截至 2016 年 2 月 17 日止並沒有關於 asunaprevir 的評估報告 關於 daclatasvir 用於病毒基因型第 1 型患者的指引內容,NICE 建議若用於病毒基因型第 1 型無肝硬化的患者,daclatasvir 可與 sofosbuvir 併用 12 週治療, 但僅建議用於已有顯著肝纖維化的患者, 但不論先前是先前未曾治療者 對先前治療反應不佳或是無法耐受干擾素治療者皆可使用 若是用於已有肝硬化之患者, 則 daclatasvir 可與 sofosbuvir 併用 24 週, 可考慮再加上 ribavirin, 但僅限用於先前無法耐受干擾素治療或不合干擾素治療條件的患者, 且患者的肝功能需尚可代償 Daclatasvir 的建議劑量皆為每日一次 60mg NICE 指引評估的臨床資料來源主要是基於與臨床試驗 AI 與 ALLY-3 試驗相關的送件資料 在試驗的品質方面, 委會會認為雖然這兩個試驗都沒有對照組, 不過在慢性 C 型肝炎相關研究發展快速的情形下, 採取這樣的試驗設計是可被理解的 在研究結果涵蓋的族群部分, 委員會認為雖然在檢送資料中針對先前已經治療的肝硬化患者與無法耐受干擾素治療的患者的資料不多, 但是檢送資料中對於有顯著肝纖維化的患者有許多討論 大至上委員會認為這些臨床試驗的品質是良好的, 只是在某些次族群患者的臨床證據強度較弱 針對 daclatasvir 的療效部分, 委員會認為雖然在建議者檢送的比較資料中顯示含有 daclatasvir 的療法比其他療法達到較高的 SVR 比例, 但是由於各試驗中各療法應用的族群特性有差異, 而且在比較不同療法時建議者未採用一正式的比較方式, 因此雖然 SVR 的比例在 daclatasvir 的療法方面數字上看起來較高, 但是到底比其他療法好多少具有不確定性, 也無法得到相對療效的明確結論 委員會也考慮了病人與臨床專家的意見 專家們認為臨床上若能較方便的取得整體療程較短藥物, 例如 daclatasvir, 則較能鼓勵 C 型肝炎的患者接受治療 對於一些以往因所在情境, 如監獄 毒癮者 移民等較難接受治療者, 也可能可以提升治療的可近性 委員會認為慢性 C 型肝炎對患者的生活的確產生顯著的影響, 因此若有治療可以提供很高的 SVR 程度 有助於減少 C 型肝炎病毒的傳播與協助去除 C 型肝炎相關的汙名化, 則此治療應受重視 委員會從臨床專家的意見了解到目前在英國, 對於病毒基因型第 1 型的患者,boceprevir 合併 PR 治療 telaprevir 合併 PR 治療 與 PR 治療皆是常用的療法, 但由於 PR 相關的治療可能會有一些嚴重的副作用例如疲倦 神經心理症狀或糖尿病等, 影響病人治療意願, 因此有些慢性 C 型肝炎的患者不願意治療 27/64
28 患者若不接受治療, 將來會面臨疾病進展至肝硬化等狀況的風險 因此委員會認 為有其他治療選擇, 特別是不含干擾素的治療 ( 例如 daclatasvir 合併 sofosbuvir 的 療法 ) 可能是一有價值的治療選擇 ( 四 ) 其他實證資料 1. 電子資料庫相關文獻 (1) 搜尋方法 本報告用於搜尋 Cochrane/PubMed/Embase 電子資料庫之方法說明如下 : 以下列 PICOS 做為搜尋條件, 即搜尋符合本次建議新藥給付條件下之病人 群 (population) 治療方法 (intervention) 療效對照品 (comparator) 療效測量指標 (outcome) 及研究設計與方法 (study design), 其搜尋條件整理如下 : Population Intervention 慢性 C 型肝炎病毒基因型 1b 患者 Daclatasvir 合併 Asunaprevir ( 排除再合併其他藥 物之療法 ) Comparator 安慰劑 (placebo) 以干擾素為基礎合併 ribavirin 的治療 (PR) 其他 DAA 類藥物 或無對照組 Outcome Study design SVR 肝衰竭或肝癌發生情形 Randomized controlled trial phase 3 以上之臨床試 驗 systematic review AND/OR meta-analysis 依照上述之 PICOS, 透過 Cochrane/PubMed/Embase 等文獻資料庫, 於 2016 年 1 月 20 日, 以 daclatasvir asunaprevir hepatitis C 1b 等做為關鍵字 進行搜尋, 搜尋策略請見附錄 (2) 搜尋結果 在 PubMed 電子資料庫以上述關鍵字進行搜尋, 合併 daclatasvir 及 asunaprevir 搜尋共得到 126 篇文獻, 合併 hepatitis C 及 genotype 1b 搜尋共得到 2755 篇文獻, 再將前兩項結果取交集後得到 41 篇文獻, 進一步從中篩選其中為 randomized controlled trial phase 3 trial systemic review meta-analysis 相關之文獻 於 Embase 資料庫中搜尋主題為慢性 C 型肝炎病毒基因型 1b 使用 28/64
29 daclatasvir 與 asunaprevir 之文獻, 限縮文獻類型為 cochrane review systematic review randomized controlled trial controlled clinical meta analysis 共找到 15 篇文獻 再對以上兩資料庫之搜尋結果經逐筆文獻標題及摘要閱讀, 排除不符合研究主題 PICOS 者, 排除合併主要試驗療法為 daclatasvir 合併 asunaprevir 及其他試驗藥物之三合一或四合一療法之文獻, 排除無法取得全文之文獻, 及排除研討會摘要性質之文獻後共納入 3 篇文獻 又因一研討會摘要之目標族群為台灣患者, 具族群特異性之參考價值, 將其納入 ; 再因搜尋 daclatasvir 合併 asunaprevir 使用於慢性 C 型肝炎患者後續發生肝炎相關併發症 肝衰竭相關指標或肝癌相關指標之文獻納入 1 篇文獻, 最終一共納入 5 篇文獻 另於 Cochrane Library 中搜尋是否有針對使用過 daclatasvir 合併 asunaprevir 患者之 Cochrane Reviews 或 Technology Assessments 文獻類型, 找到兩篇 Technology Assessments, 但皆無法取得全文 關於 daclatsvir 合併 asunaprevir 與其他藥品之間接比較分析, 雖有找到兩篇文章, 但皆無法取得全文, 或以摘要短文的型式發表, 因此在此不納入評估 [25-27] 有一網絡統合分析文獻雖有納入 daclatasvir, 但其療法為 daclatasvir 合併 sofosbuvir 的療法而非合併 asunaprevir, 因此在此不納入評估 [28] 並未找到 daclatasvir 合併 asunaprevir 之療法與 PR 治療直接進行比較之對照試驗相關文獻 以下為最終納入之 5 篇文獻之內容 : (1) All-oral daclatasvir plus asunaprevir for hepatitis C virus genotype 1b: a multinational, phase 3, multicohort study[17] (HALLMARK-DUAL 試驗 ) 此文獻之內容為發表一多國多中心雙盲隨機分派之第三期臨床試驗 (Hallmark-DUAL study), 使用 daclatasvir 與 asunaprevir 於下列三群慢性 C 型肝炎基因型 1b 之患者 :(1) 未曾接受治療 ;(2) 先前對 peginterferon-α 及 ribavirin(p/r) 之合併治療無反應 / 僅有部分反應者 ;(3) 對 P/R 治療不耐受 / 不合 P/R 治療資格之患者 受試者之納入條件為 18 歲以上 C 型肝炎病毒基因型 1b 感染之患者,HCV RNA 之數量在 IU/ml 以上 根據患者先前的治療情形分配到上述的三群之一 對 P/R 治療不耐受或不合治療資格的患者包括因為憂鬱 貧血 低中性球 顯著肝纖維化或肝硬化 ( 纖維化指數為 F3 或 F4) 且血小板數量不足而無法接受 P/R 治療之患者 明顯肝功能無法代償之患者, 例如有食道靜脈瘤 腹水或其他肝功能失去代償之患者則不被納入試驗 試驗設計將未曾接受治療的患者皆依 2:1 的比例隨機分派至實驗組接受 daclatasvir 60mg 每日一次及 asunaprevir 100mg 每日兩次之合併治療 24 週, 或是對照組接受安慰劑治療 12 週 對照組於治療結束後 12 週之後 (Week 24) 會再進入另一項 daclatasvir 與 asunaprevir 的試驗 而對先前干擾素治療無反應者或無法耐受者則共接受 24 週之治療, 對照組則沒有納入先前已接受過治療但無反應或無法耐受的這類患者 所有接受 daclatasvir 與 29/64
30 asunaprevir 的患者皆追蹤至治療完成後 24 週 此試驗也有收入台灣的患者 此試驗的主要療效指標是未曾接受治療者與先前治療無反應者之 SVR 12 ( 定義為 HCV RNA < 25 IU/ml, 可能測的到 HCV RNA 或可能測不到 ) 無法耐受干擾素治療者之 SVR12 依照 IL28B rs 基因型別分析的 SVR12 與治療過程中第 週, 完成治療時與治療完成後 24 週無法測得 HCV RNA 的患者比例等則為次要療效指標 一些描述治療結果上的定義如下 : 病毒學上的再突破 (virological breakthrough) 定義為自 HCV RNA 的最低量後又測得病毒量的上升且病毒量大於最低量的 10 倍或是病毒量曾小於 25 IU/ml 但稍後又測得大於 25 IU/ml 的值 ; 治療無效之定義為治療第 8 週時 CV RNA 的量仍大於 25 IU/ml; 治療後的復發則定義為當治療結束時無法測得 HCV RNA 然而之後又可測得 HCV RNA 的量大於 25 IU/ml 試驗中除了測量療效指標之外也監測安全性指標, 例如治療中第 3 級或第 4 級以上實驗室檢查異常的情形 貧血 皮膚疹與不良事件及退出試驗等事件發生的情形 未曾接受治療的實驗組一共有 205 人, 其對照組有 102 人 兩組受試者的性別 種族 ( 亞洲人比例分別為 25% 與 32%) 年齡( 平均年齡分別為 55 歲與 54 歲 ) HCV RNA 量 ( IU/ml 之比例分為 74% 與 75%) 與肝硬化比例 ( 兩組皆為 16%) 基本上相似 先前對治療無反應一組有 205 人 無法耐受治療一組有 235 人 這兩組的平均年齡 ( 平均為 58 歲及 60 歲 ) HCV RNA 量 IU/ml 的比例 ( 分別為 87% 與 80%) 及肝硬化的比例 ( 分別為 31% 及 47%) 高於前述兩組 在 IL28B rs 基因型別的分析上, 對干擾素治療較有反應的 CC 型別在未曾治療 / 對干擾素治療無反應 / 無法耐受干擾素治療三組實驗組之比例分別為 37% 14% 與 35% 對干擾素治療無反應的實驗組其中有 58% 是完全無反應者,41% 為部分反應者 無法耐受治療之實驗組其無法耐受之原因則有 30% 是因為憂鬰 37% 是因為貧血或中性球過低 33% 是因為肝硬化及肝纖維化合併血小板低下 最終分析結果時, 未曾治療之實驗組達 SVR12 之比例為 90% (95% CI, 85% 94%) ; 對干擾素治療無反應組達 SVR12 之比例為 82% (95% CI, 77%-87%); 無法耐受干擾素治療組達 SVR12 之比例為 82% (95% CI, 77%-87%) 在治療第 4 週時未曾治療組有 83% 的受試者血中測不到 HCV RNA, 在先前無反應組與無法耐受治療組之比例則分別為 73% 及 68% 在三組受試者中, 各有 3% 4% 與 6% 的患者在結束治療後有復發的情形, 即在結束療程時測不到 HCV RNA 但稍後又測得 HCV RNA 的量大於 25 IU/ml 在分層分析時, 達到 SVR12 的比例在不同的性別 年齡 種族 BMI 或是 IL28B 之基因型別與肝硬化狀態上都沒有顯著的差異 有肝硬化的族群達 SVR12 比例為 84%, 沒有肝硬化的族群達到 SVR12 的比例則為 85% 在其他次族群分析時, 採用多因子迴歸分析時僅發現 HCV RNA 量 IU/ml 與 NS5A 抗藥 30/64
31 性相關之變異病毒株 (L31 或 Y93 變異之型別 ) 與較低的 SVR12 比例有關 具 NS5A-L31 變異株之受試者僅有 41% 達 SVR12; 具 NS5A-Y93 的受試者僅有 38% 達 SVR12 在安全性上, 發生嚴重不良事件的患者於未曾治療的組別中有 6%, 對先前 PR 治療無反應者有 5%, 無法耐受干擾素治療者有 7% 試驗主持人認為共有 4 個嚴重不良事件與 daclatasvir 合併 asunaprevir 的治療有關, 分別是於無法耐受 PR 治療組與對 PR 治療無反應組有兩例心房顫動案例, 於未曾治療組有兩例肝功能相關指數異常之嚴重不良事件, 但其中有一例是發生於患有 Gilbert s syndrome 的患者 此外, 因不良事件造成中止治療者在未曾治療的組別中有 3%, 對先前 PR 治療無反應者有 1%, 無法耐受干擾素治療者有 1%, 主都是因為 AST 或 ALT 上升導致試驗治療中止, 但無人死亡, 在中止治療後 AST/ALT 指數也會改善 第 3 級或第 4 級以上之實驗室檢查數據異常不常見, 在使用 daclatasvir 合併 asunaprevir 之實驗組或使用安慰劑組的組別中一共僅有 2% 的受試者發生 AST 或 ALT 上升至第 3 或第 4 級不良事件程度的情形 (2) Daclatasvir plus asunaprevir for chronic HCV genotype 1b infection[29] 此研究為於日本進行的第三期開放性臨床試驗, 共收納 222 名慢性 C 型肝炎病毒基因型 1b 之患者 全部的群體中約有 34.7% 為男性,HCV RNA IU/mL 者佔 85.1%, 總共有 9.9% 的患者有肝硬化 受試者中 135 名無法耐受或不符合接受干擾素治療資格, 另外 87 名為對先前以干擾素為基礎之治療無反應者, 而對干擾素治療無反應者有 81.6% 的患者 IL28B 之基因型為 non-cc 基因型 兩類別受試者中患者 HCV RNA IU/mL 分別為 80.7% 與 92%, 有肝硬化的患者比例分別為 8.1% 與 12.6% 試驗的治療方式為 daclatasvir 60mg 每日一次與 asunaprevir 100mg 每日兩次治療 24 週, 主要療效指標為 SVR24 在治療過程中, 有 75.2% 的患者在治療第 4 週時血中已測不到 HCV RNA, 而有 91% 的患者在第 12 週測不到血中 HCV RNA 本次試驗於無法耐受干擾素治療的族群與對先前治療無反應的族群中各有 17 人 (15.3%) 治療失敗 其中有部分患者是在治療結束時測不到 HCV RNA 但後來又再測得的 ( 復發,relapse) 在全部完成治療時測不到 HCV RNA 的患者族群中, 原本無法耐受干擾素治療的患者群中有 8.5% 後來產生病毒復發的情形, 而在先前對干擾素治療無反應的患者群中則有 7.9% 復發 共有 9 位對 daclatasvir 合併 asunaprevir 治療失敗且先前對干擾素治療無反應的患者在試驗治療第 8 週被判定治療失敗時, 在接下來的 24 週再接受額外的 PR 合併治療, 即後續合併 daclatasvir 與 asunaprevir 及 PR 治療 24 週 這些患者有 1 位後來達到 SVR24,2 位始終可測得 HCV RNA, 其他 6 位後續曾測不到 HCV RNA 但後來仍復發 31/64
32 在治療失敗的患者中, 有 29 位後來有測得 daclatasvir 或 asunaprevir 抗藥性相關的基因變異 (NS5A-L31M/V-Y93H 或 NS3-D168) 其中有 22 人是治療開始前就有此抗藥性基因型變異的 但並不是所有具有病毒抗藥性基因變異性的患者都沒有達到 SVR 整體族群中有 37 人有 NS5A-L31M/V 或 Y93H 的變異, 其中有 15 人達到 SVR, 而有 2 人有 NS3-D168E 的變異, 有 1 人達到 SVR 在無法耐受或不符合接受干擾素治療資格的患者中, 最終達 SVR24 者佔 87.4%; 對先前以干擾素為基礎之治療無反應之患者中, 最終達 SVR24 者佔 80.5% 在有肝硬化的患者中, 達 SVR24 的比例有 90.9%, 而無肝硬化的患者達 SVR24 的比例有 84% IL28B 基因型為 CC 之患者 SVR24 的比例為 84.5%,non-CC 之族群 SVR24 比例為 84.8% 服藥配合度達 95% 以上的患者有 92.7% 達到 SVR24, 而服藥配合度未達 95% 的患者只有 31% 達到 SVR24 ( 但服藥配合度未達 95% 者其中有約一半的患者是因為治療無效而終止治療, 使配合度未達 95%) 本次試驗於無法耐受干擾素治療的族群與對先前治療無反應的族群中各有 14 人 (12.6%) 退出試驗, 主要原因為不良反應或對治療無反應, 其中有 10 人是因為 AST/ALT 升高而終止治療, 有 1 人是因為重症肌無力而終止 最常見的不良事件為鼻咽炎 AST/ALT 升高 頭痛 腹瀉與發燒, 整體而言嚴重不良反應率為 5.9%, 無人於治療期間中死亡 因 AST/ALT 上升中止治療的患者中有 8 人後來仍達到 SVR 有第 3 級或第 4 級以上 AST/ALT 上升的患者中, 肝功能指數上升的中位時間是治療第 10 週 (4~23 週不等 ), 大多數在中止治療後 2.5 週肝功能數值會回復 而相對於肝功能指數上升的不良反應, 一些患者在開始治療後 AST/ALT 的數值反而下降, 那些原本在治療前肝功能指數不正常的患者, 在治療的第 2 週至第 4 週開始, 肝功能指數會明顯改善 (3) Randomized comparison of daclatasvir + asunaprevir versus telaprevir + peginterferon/ribavirin in Japanese hepatitis C virus patients[18] 本文獻為一於日本執行的第三期臨床試驗, 其中包含一隨機分派開放性臨床試驗, 比較 daclatasvir 併用 asunaprevir 之療法與 telaprevir 併用 PR 療法用於未曾接受治療之慢性 C 型肝炎病毒基因型 1b 患者之療效 ; 還包括另一開放性無對照之試驗組別, 評估 daclatasvir 與 asunaprevir 用於先前接受過 PR 治療但復發之病毒基因型 1b 患者之療效 復發之定義為先前在完成 PR 治療時無法測得 HCV RNA 但在完成治療的後續 24 週追蹤期間又可測得 HCV RNA 試驗所使用的藥物劑量為 daclatasvir 60mg 每日一次合併 asunaprevir 100mg 每日兩次使用 24 週 ( 未曾治療與復發者皆為 24 週 ) 另一組則使用 telaprevir 750mg 每日三次持續 12 週且合併 PR 治療 24 週,PR 治療所使用之干擾素為 peginterferon alfa-2b 患者接受追蹤至治療結束後 24 週 患者若在治療過程中第 32/64
33 8 週 (daclatasvir 與 asunaprevir 組別 ) 或第 12 週 (telaprevir 合併 PR 組別 ) 仍可測得 HCV RNA, 或是 HCV RNA 在治療過程中曾下降但後來又顯著增加 ( 病毒量突 破,virologic breakthrough), 則會被視為治療失敗而停止治療 隨機分派組別的受試者在接受隨機分派時會在使兩治療組別中 IL28B (rs ) 的基因型為 TT 之患者數量盡量平均的考量下進行 兩治療組別 (daclatasvir+asunaprevir 或是 telaprevir+pr) 以 1:1 的比例分派 試驗的主要療效指標是未曾接受治療者達到 SVR12 之比例, 並予分析 daclatasvir 合併 asunaprevir 的組別是否與另一組相比可達不劣性 (non-inferiority), 其 non-inferiority margin 為 -15% 復發者之 SVR12 比例則為一次要指標 其他次要療效指標包括各組達 SVR24 之比例與 HCV RNA 於治療過程中之變動情形 共有 119 位患者進入未曾治療過之 daclatasvir 合併 asunprevir 組, 最終中有 90.8% 的患者完成治療 ; 另有 111 位進入 telaprevir 合併 PR 組, 最終僅有 67.6% 的患者完成治療 中斷治療的主要原因是因為不良反應與治療無效 Daclatasvir 合併 asunaprevir 組別中有 5% 患者因不良反應停止治療, 有 3.4% 因治療無效而停止治療 Telaprevir 合併 PR 的組別中有 19.8% 因不良反應停止治療, 有 9% 因治療無效停止治療 在未曾治療的患者群中,daclatasvir 合併 asunprevir 組患者的特性與 telaprevir 合併 PR 治療組相比, 其平均年齡 IL28B rs 之 CC 型別與 rs 之 TT 型別的比例皆相當接近 HCV RNA 數量 之患者以 daclatasvir 合併 asunaprevir 組別略多 (94.1% vs. 88.3%) 代表肝纖維化程度之 FibroTest score 則在 daclatasvir 合併 asunaprevir 相較於 telaprevir 合併 PR 組有較多的 F0 及 F1 患者與較少的 F3 及 F4 患者 (F0 39.5% vs. 28.8%;F1 21.0% vs. 18.0%:F3 12.6% vs. 19.8%;F4 5.0% vs. 11.7%), 但此試驗基本上排除有肝硬化的患者 在復發的患者群中, 共有 22 人被納入試驗, 有 1 人後來因不良反應停止治療 患者中全部皆為 HCV RNA 的患者,FibroTest score F0 與 F1 的患者共佔 63.6% 最終未曾治療的患者中,daclatasvir 合併 asunaprevir 的組別有 89.1% 達到 SVR12,telaprevir 合併 PR 的組別則有 62.2%, 以上比例的母群體中並未扣除未完成治療之患者 復發接受 daclatasivr 合併 asunaprevir 的第三組試驗組則有 95.5% 的患者達到 SVR12 在次族群分析時發不論針對年齡 性別 FibroTest score HCV RNA 病毒量 IL28B 基因型作分層分析,daclatasvir 合併 asunaprevir 的組別皆有顯著較高的比例達到 SVR12, 然 telaprevir 合併 PR 組中並未扣除中途停止治療者 由於 telaprevir 合併 PR 組有較多人未完成治療, 進一步針對治療失敗者的情 形作分析 治療中病毒量突破的患者在 daclatasvir 合併 asunaprevir 組中有 3.4%, 33/64
34 在 telaprevir 合併 PR 組有 5.4% 治療完成時未測得病毒但是後續復發者在 daclatasvir 合併 asunaprevir 組中有 8.7% (10 人 /115 人, 在 telaprevir 合併 PR 組中有 18.8% (16 人 /85 人 ) 治療中病毒量未下降到一定值而被判定為治療失敗者在 daclatasvir 合併 asunprevir 組為 0 人, 在 telaprevir 合併 PR 組則有 3.6% 針對先前治療後復發再接受 daclatasvir 合併 asunaprevir 治療的患者中,22 人中有 1 人在治療後復發 針對 daclatasvir 合併 asunaprevir 組別分析藥物抗藥性病毒株的影響時, 具有 NS5A-L31 或 Y93 或 NS3-D168 的患者達到 SVR12 的比例顯著較低 在安全性的比較方面,daclatasvir 合併 asunaprevir 組與 telaprevir 合併 PR 組相比, 常見不良事件發生率 (89.1% vs. 100%) 第 3 級或第 4 組以上不良事件發生率 (16% vs. 73%) 與因不良事件停止任一治療藥物者 (5% vs. 62.2%) 皆以 daclatasvir 合併 asunaprevir 組顯著較少 但在嚴重不良反應的發生情形方面兩組接近, 分別為 4.2% 及 5.4% Daclatasvir 合併 asunaprevir 組別中因不良反應停止治療者多數是因 ALT 上升達正常值上限之 10 倍以上停止治療, 但停止治療後 ALT 數值皆有下降 Telaprevir 合併 PR 組因不良反應停止治療者多數是由於腎功能指標變差 皮膚紅疹與貧血停止治療 Daclatasvir 合併 asunaprevir 組最常見的第 3 級與第 4 級以上不良事件為 AST/ALT 上升, 數值開始上升的天數中位數為 64 天 (ALT) 至 67.5 天 (AST) 左右, 而停止治療後數值下降達一個不良事件等級的所需天數中位數約為 25 天 (ALT) 至 42 天 (AST) Telaprevir 合併 PR 治療最常見的第 3 級與第 4 級以上不良反應為貧血 中性球不足與淋巴球不足 兩個治療組別發生的不良反應類型顯著不同, 整體而言 daclatasvir 合併 asunaprevir 組發生的不良反應主要皆為輕微至中度等級, 而 telaprevir 合併 PR 組的不良反應主要為中度至嚴重等級 (4) Daclatasvir and asunaprevir treatment improves liver function parameters and reduces liver fibrosis markers in chronic hepatitis C patients[11] 此研究為一追蹤期中位數達 27 個月之日本小型研究, 說明以 daclatasvir 與 asunaprevir 合併使用 24 週治療慢性 C 型肝炎病毒基因型 1b 之患者達 SVR 之患者 (26 人 ) 與未達 SVR(non-SVR) 之患者 ( 共 4 人 ) 相比, 其肝炎與肝纖維化之相關指標有較顯著之改善 於治療後 27 個月時達 SVR 之患者之血中 ALT 指數與甲型胎兒蛋白 (α-fetoprotein,afp) 下降達統計上顯著之水準 ; 血中白蛋白 (albumin) 與血小板數量上升達統計上顯著水準 ; 肝纖維化相關指標如 M2BPGi hyaluronic acid and type IV collagen 之血中濃度於達 SVR 之患者改善達統計上顯著之水準 而 non-svr 之患則上述指標於追蹤時與治療前相比無明顯差異 唯該研究使用之 daclatasvir 劑量為每日 60mg,asunaprevir 劑量為每日 400mg (200mg BID), 與本案申請之建議劑量不同 34/64
35 (5) All oral dual therapy with daclatasvir and asunaprevir in patients in Korea and Taiwan with HCV genotype 1B infection[30] 此文獻為一發表於 2015 年 APASL 於土耳其召開之第 24 屆會議內容合輯的研究摘要, 但僅能找到文獻摘要而無全文 主要是針對一第三期臨床試驗 (AI447028, 即 HALLMARK-DUAL 試驗 ) 之韓國與台灣次族群的分析結果 包括未經治療的慢性 C 型肝炎病毒基因型 1b 的患者 對干擾素治療無反應之病毒基因型 1b 患者, 與無法耐受干擾素治療的病毒基因型 1b 患者 未經治療者以隨機分派的方式以 2:1 的比例分配至接受 daclatasvir 60mg 每日 1 次合併 asunaprevir 100mg 每日兩次治療 12 週的實驗組 ( 韓國有 21 人, 台灣有 25 人 ) 或使用安慰劑治療 12 週的對照組 ( 韓國有 13 人, 台灣有 14 人 ),12 週後安慰劑組會進入另一臨床試驗 對干擾素治療無反應之病毒基因型 1b 患者 ( 韓國有 21 人, 台灣有 22 人 ), 與無法耐受干擾素治療的病毒基因型 1b 患者 ( 韓國有 23 人, 台灣有 24 人 ) 則皆接受 daclatasvir 合併 asunaprevir 治療 24 週 主要療效指標為 SVR12 韓國與台灣受試者整體有 45% 為男性 34 有肝硬化而有 31% 的患者 IL28B 的基因型為 non-cc 型別 接受 daclatasvir 合併 asunaprevir 合併治療的患者達 SVR12 的比例在未經治療組 干擾素治療失敗組與無法耐受干擾素組在韓國受試者中分別為 95% 86% 與 70 %, 在台灣受試者中分別為 88% 77% 與 92 % 嚴重不良事件在韓國受試者中有 8% 發生, 在台灣受試者中也有 8% 發生, 無人死亡 在台灣受試者中有 2 人因不良事件中止治療, 在韓國受試者中則無人有此情形 第 3 級及第 4 級不良事件的發生率不高, 僅有 2 台灣受試者發生第 3 級或第 4 級之 ALT 上升, 韓國受試者則無此情形 ( 五 ) 建議者提供之資料 查驗中心在 2015 年 12 月 24 日收到本案建議者 藥物納入全民健康保險給付建議書 - 以收載藥品擴增適應症 資料, 其中, 主要為藥品 daclatasvir 與 asunaprevir 之仿單及相關療效與安全性之分析 而療效與安全性分析之臨床試驗資料主要是依據 HALLMARK-DUAL 試驗之已發表文獻與台灣受試者的分析 ( 建議者提供之台灣受試者分析資料同前列分析韓國與台灣受試者之引用文獻 [30]), 其相關重點已整理於報告內文在此段落不再贅述 建議者於資料中另有提供一關於比較 daclatasvir 與 asunaprevir 合併使用與干擾素為基礎的療法之統合分析文獻, 然其中干擾素為基礎的治療其患者達到 SVR 的比例與台灣過去報告干擾素療法成效之資料內容有所差異, 又其中也採用多篇受試者為西方人種之文獻報告 35/64
36 五 療效評估結論 ( 一 ) 療效參考品建議 針對本案申請藥品 Daklinza(daclatasvir) 合併 Sunvepra(asunaprevir) 之目標病人群 慢性 C 型肝炎病毒基因型 1b 且肝功能尚可代償 之患者, 綜合考量國際最新相關臨床指引建議 我國核發之藥品許可證情形 與健保署給付規定, 查驗中心認為目前於我國並無同屬相同臨床治療地位之療效參考品 目前我國健保收載用於治療此類患者的藥品為干擾素為基礎合併 ribavirin 的療法, 與本案藥品所屬全口服無干擾素之 DAA 類藥品機轉與用藥方式皆相當不同, 又考量過去選擇不接受治療之患者有一部分是因為干擾素治療的副作用與用藥方式因此選擇不治療, 因此本案藥品未來可能治療的族群將有一部分與過去可完成干擾素治療的患者族群是不重疊的 因此查驗中心認為目前於我國已收載之藥品中並無屬於相同臨床治療地位之療效參考品 參酌各大學會指引 各國 HTA 組織的評估意見, 與目前申請我國健保收載給付之 C 型肝炎 DAA 類藥物情形, 查驗中心認為在未來之 DAA 類藥物申請給付收載之案件中, 其他含有 DAA 類藥物的療法應為較適合之療效與核價參考品, 或可對於國內現有 DAA 類藥物之收載做一通盤考量 ( 二 ) 臨床治療地位 本案藥品可以以較短的療程與較方便的服藥方式降低病毒量, 同時與干擾素為基礎的治療相比, 副作用可能較少, 因此於公共衛生觀點上對於降低 C 型肝炎病毒的傳播機會可能會有幫助, 另也可能增加患者治療意願 然此藥物機轉與干擾素不同,DAA 類藥物亦有抗藥性的問題, 也有病毒復發之可能性 又因目前 C 型肝炎治療能減少肝硬化與肝癌的相關報告都是使用以干擾素為基礎的療法, 尚無 DAA 類藥物的類似文獻發表, 且即使是達到 SVR, 過去文獻顯示患者後續發生肝癌的風險也仍未完全消失, 是故對於使用本案藥品未來可能減少肝硬化 肝衰竭 其他器官之肝衰竭相關併發症 肝癌發生的情形還有待更多其他研究發表才能提供客觀數據, ( 三 ) 相對療效及安全性 相對療效實證主要文獻搜尋共採納 5 篇臨床試驗結果, 一篇為 daclatasvir 合併 asunaprevir 與安慰劑相比用於慢性 C 型肝炎病毒基因型 1b 患者之隨機分派臨床試驗 HALLMARK-DUAL[17], 一篇為於日本執行 daclatasvir 合併 asunaprevir 與 telaprevir 合併 PR 治療相比用於慢性 C 型肝炎病毒基因型 1b 患者之隨機分派 36/64
37 臨床試驗 [18], 一為於日本執行 daclatasvir 合併 asunaprevir 用於慢性 C 型肝炎病毒基因型 1b 患者之開放性無對照臨床試驗 [29], 一為追蹤期中位數達 27 個月之日本小型研究, 說明以 daclatasvir 與 asunaprevir 治療慢性 C 型肝炎患者達 SVR 之患者其肝炎與肝纖維化之相關指標改善之程度 [11] 一為關於 HALLMARK-DUAL 試驗之韓國與台灣患者次族群分析之摘要 [30] 在安全性部分, 總結其結果, 各文獻皆顯示合併 daclatasvir 與 asunaprevir 用於慢性 C 型肝炎病毒基因型 1b 之患者不論其先前治療經驗為未曾治療 受干擾素治療失敗或是無法耐受干擾素治療, 產生嚴重不良反應的患者都不多, 患者由於不良反應中止治療的比例也不多, 基本上此療法是大多數患者可耐受與完成治療的 另於與干擾素為基礎的治療比較的文獻中,daclatasvir 合併 asunaprevir 組別患者發生第三級與第四級不良反應之比例及因不良反應停止治療的比例也較少 在療效部分, 各試驗中所使用的療程與達到 SVR 之比例摘要如下 : (1) HALLMARK-DUAL 試驗及相關分析 [17, 30] 病毒基因型 1b 之慢性 C 未曾接受治療 受干擾素治療失 無法耐受干擾素 型肝炎患者達 SVR 之 敗 治療 比例 Daclatasvir+Asunaprevir 90% (SVR12) 82% (SVR12) 82% (SVR12) 療程 24 週 ( 台灣 88%) ( 台灣 77%) ( 台灣 92%) 在分層分析時, 達到 SVR12 的比例在不同的性別 年齡 種族 BMI 或是 IL28B 之基因型別與肝硬化狀態上都沒有顯著的差異 有肝硬化的族群達 SVR12 比例為 84%, 沒有肝硬化的族群達到 SVR12 的比例則為 85% 在其他次族群分析時, 採用多因子迴歸分析時僅發現 HCV RNA 量 IU/ml 與 NS5A 抗藥性相關之變異病毒株 (L31 或 Y93 變異之型別 ) 與較低的 SVR12 比例有關 具 NS5A-L31 變異株之受試者僅有 41% 達 SVR12; 具 NS5A-Y93 的受試者僅有 38% 達 SVR12 (2) 於日本執行之第三期無對照臨床試驗 [29] 病毒基因型 1b 之慢性 C 型肝炎患者達 SVR 之比例 Daclatasvir+Asunaprevir 療程 24 週 未曾接受治療 受干擾素治療失 無法耐受干擾素 敗 治療 80.5% (SVR24) 87.4% (SVR24) 37/64
38 在有肝硬化的患者中, 達 SVR24 的比例有 90.9%, 而無肝硬化的患者達 SVR24 的比例有 84% IL28B 基因型為 CC 之患者 SVR24 的比例為 84.5%,non-CC 之族群 SVR24 比例為 84.8% 服藥配合度達 95% 以上的患者有 92.7% 達到 SVR24, 而服藥配合度未達 95% 的患者只有 31% 達到 SVR24 ( 但服藥配合度未達 95% 者其中有約一半的患者是因為治療無效而終止治療, 使配合度未達 95%) (3) 於日本執行之第三期隨機分派對照臨床試驗, 對照組為 telaprevir 使用 12 週 合併 PR 治療 24 週 [18] 病毒基因型 1b 之慢性 C 型肝炎 患者達 SVR 之比例 未曾接受治療 受干擾素治療後復發 者 Daclatasvir+Asunaprevir 療程 24 週 telaprevir 使用 12 週合併 PR 治療 24 週 89.1% (SVR12) 95.5% (SVR12) 62.2% (SVR12, intention to treat analysis) 在次族群分析時發不論針對年齡 性別 FibroTest score HCV RNA 病毒量 IL28B 基因型作分層分析,daclatasvir 合併 asunaprevir 的組別皆有顯著較高的比 例達到 SVR12, 然 telaprevir 合併 PR 組中並未扣除中途停止治療者 關於因不良反應停止治療者,daclatasvir 合併 asunprevir 組最終中有 90.8% 的患者完成治療 ;telaprevir 合併 PR 組最終僅有 67.6% 的患者完成治療 中斷治療的主要原因是因為不良反應與治療無效 Daclatasvir 合併 asunaprevir 組別中有 5% 患者因不良反應停止治療, 有 3.4% 因治療無效而停止治療 Telaprevir 合併 PR 的組別中有 19.8% 因不良反應停止治療, 有 9% 因治療無效停止治療 由於 telaprevir 合併 PR 組有較多人未完成治療, 進一步針對治療失敗者的情形作分析 治療中病毒量突破的患者在 daclatasvir 合併 asunaprevir 組中有 3.4%, 在 telaprevir 合併 PR 組有 5.4% 治療完成時未測得病毒但是後續復發者在 daclatasvir 合併 asunaprevir 組中有 8.7% (10 人 /115 人, 在 telaprevir 合併 PR 組中有 18.8% (16 人 /85 人 ) (4) 於日本執行之長期追蹤試驗 [11] 追蹤期中位數達 27 個月之日本小型研究, 說明以 daclatasvir 與 asunaprevir 合併使用 24 週治療慢性 C 型肝炎病毒基因型為 1b 之患者達 SVR 之患者與未達 SVR 之患者相比, 其肝炎與肝纖維化之相關指標有較顯著之改善 ( 如血中 ALT 與 38/64
39 AFP 下降達統計上顯著之水準 ; 血中 albumin 與血小板數量上升達統計上顯著水準 ; 肝纖維化相關指標如 M2BPGi hyaluronic acid and type IV collagen 之血中濃度改善達統計上顯著之水準 ) 唯該研究使用之 daclatasvir 劑量為每日 60mg, asunaprevir 劑量為每日 400mg (200mg BID), 與本案申請之建議劑量不同 ( 四 ) 主要醫療科技評估組織之建議 1. CADTH/CDEC( 加拿大 ) CADTH 於 2015 年 9 月 21 日公告建議收載 daclatasvir 與 sofosbuvir 合併使 用於治療先前經 peginterferon 加上 ribavirin 治療無效之慢性 C 型肝炎, 病毒基因 型為第 3 型患者 然目前尚未有關於 asunaprevir 之評估報告 ( 審查暫停 ) 2. PBAC( 澳洲 ) PABC 公布於 2015 年 3 月進行之會議之報告, 其中建議收載 daclatasvir 與 sofosbuvir 併用於慢性 C 型肝炎病毒基因型第 1 型且先前未曾治療過無肝硬化之患者, 與病毒基因型第 3 型之患者 但 PBAC 於同期公布之報告中並不建議收載 asunaprevir 主要原因是因為 asunaprevir 併用 daclatasvir 用於病毒基因型 1b 的 C 型肝炎患者在療效上與 ledipasvir 併用 sofosbuvir 的療法, 或是 daclatasvir 併用 sofosbuvir 的療法相比, 並未達到不劣性 (not non-inferior), 且在安全性上 daclatasvir 合併 asunaprevir 的組合也並未較好 BAC 在先前的會議認為 daclatasvir 比較適當的比較品是 無治療 (no treatment) 然 PBAC 表示, 由於 ledipasvir 合併 sofosbuvir 等含有 sofosbuvir 的療法在澳洲可能成為大多數慢性 C 型肝炎的標準療法, 這類含有 sofosbuvir 的療法將是未來其他口服 C 型肝炎藥物最適當的比較品 同時, 收載 daclatasvir 也只有可能在 PBS ( 澳洲藥品支付制度, Pharmaceutical Benefits Scheme) 收載 sofosbuvir 後才有可能完成 3. NICE( 英國 ) NICE 於 2015 年 11 月發布指引, 建議收載 daclatasvir 合併不同藥物用於慢性 C 型肝炎病毒基因型第 1 型 第 3 型 第 4 型的患者 其中對於病毒基因型第 1 型的患者需與 sofosbuvir 或 sofosbuvir 加上 ribavirin 併用, 且僅限用於有顯著肝纖維化或肝硬化的患者 但截至 2016 年 2 月 17 日止並沒有關於 asunaprevir 的評估報告 39/64
40 六 成本效益評估 ( 一 ) 建議者提出之國內藥物經濟學研究 1. 建議者提出之報告內容摘要 建議者提出一分本土情境的成本效用分析, 來探討 daclatasvir /asunaprevir (DCV/ASV) 相較於 pegylated interferon-alpha/ribavirin (PR) 用於治療感染基因型 1b 慢性 C 型肝炎病人的成本效益評估 建議者對 daclatasvir /asunaprevir 建議的療程為 24 週,daclatasvir 的用法為每日一次, 一次一粒,asunaprevir 的用法為每日兩次, 一次一粒 比較品為慢性 C 肝炎的標準療法每週施打一次 pegylated interferon-alpha 合併每日 ribavirin 900mg, 治療 48 週或 72 週 建議者建構決策模型來進行成本效用分析, 模型主要分為兩部分 : 決策樹的部分用來模擬治療期間情境 ; 馬可夫決策模型則用來模擬疾病的自然發生歷程, 架構出 7 個健康狀態 : 持續病毒學反應 慢性肝炎 代償性肝硬化 代償不全肝硬化 肝癌 肝臟移植 和死亡 模型以一年為循環週期, 採付費者觀點, 並以終身為主要分析的評估期間,3.5% 作為效果及成本的折現率 主要療效評估指標為生活品質校正年 (quality adjusted life year, QALY), 成本效益分析指標則以遞增成本效果比值 (incremental cost-effectiveness ratio, ICER) 為主, 並以一倍臺灣人均 GDP 做為願付價格閾值時的淨效益作為輔助指標 建議者提供的情境分析以考量臨床數據 效用 轉移機率 各疾病狀態的醫療成本等因素的不確定性 建議者也應用單因子敏感度分析, 檢視相關參數對於分析結果的影響 基礎分析目標族群平均年齡為 53.9 歲, 男性佔 41.3% 的比例, 參考的文獻是以高雄 屏東地區為主的地區盛行率研究 ; 而 79.28% 為慢性 C 型肝炎病人, 29.72% 為帶償性肝硬化病人則參考 2002 年發表以亞洲地區為主的文獻 慢性 C 型肝炎相關的各疾病狀態間的疾病轉移機率主要來自於日本的文獻, 只有代償不全到肝臟移植和肝臟移植到死亡狀態的轉移機率來自一篇國外探討治療慢性 C 型肝炎成本效果分析模型的文獻回顧 健康生活品質校正權數取用於一篇以臺灣為主的成本效用分析文獻, 但該文獻的效用是引用自國外文獻 成本主要包括藥費 治療監測費用 藥物副作用治療費用 和併發症治療費用等相關照護費用, 皆取自本土既有統計資料或以本土為情境的文獻 藥物費用主要根據建議者和 C 型肝炎治療指引所訂定的標準療程的週數計算 治療期間的監測費用主要來自於衛生福利部以及專家意見 藥物不良反應的花費則只計算 pegylated interferon-alpha/ribavirin 的不良反應花費但只做敏感度分析, 不納入基礎分析或情境分析 C 型肝炎相關的各疾病狀態的治療費用主要以參考本土的文獻再乘上消費者物價指數 臨床療效的參數及安全性差異參數則根據建議者所進行的配對 40/64
(Microsoft Word _ A-\255\327\245\277\263W\251w.doc)
 行政院衛生署中央健康保險局令 發布日期 :101.12.26 健保審字第 1010041241 號 修正 全民健康保險藥品給付規定 第 8 章免疫製劑 Immunologic agents 8.2. 免疫調節劑 Immunomodulators 第 10 章抗微生物劑 Antimicrobial agents 10.7. 抗病毒劑 Antiviral drugs 給付規定, 並自中華民國一百零二年二月一日生效
行政院衛生署中央健康保險局令 發布日期 :101.12.26 健保審字第 1010041241 號 修正 全民健康保險藥品給付規定 第 8 章免疫製劑 Immunologic agents 8.2. 免疫調節劑 Immunomodulators 第 10 章抗微生物劑 Antimicrobial agents 10.7. 抗病毒劑 Antiviral drugs 給付規定, 並自中華民國一百零二年二月一日生效
提案一 報告人:賴貞橞
 全民健康保險藥品給付規定 修正規定 第 10 章抗微生物劑 Antimicrobial agents 修正後給付規定 10.7. 抗病毒劑 Antiviral drugs 10.7.3 Lamivudine( 限使用 Zeffix tablets 100mg);Entecavir ( 如 Baraclude 0.5mg); Telbivudine ( 如 Sebivo 600mg):(92/10/1
全民健康保險藥品給付規定 修正規定 第 10 章抗微生物劑 Antimicrobial agents 修正後給付規定 10.7. 抗病毒劑 Antiviral drugs 10.7.3 Lamivudine( 限使用 Zeffix tablets 100mg);Entecavir ( 如 Baraclude 0.5mg); Telbivudine ( 如 Sebivo 600mg):(92/10/1
F3 F4, HIV HBV HCV (, HCV,,, (F2) (F0~F1) A1 -HCV A1 -HCV B1 -HCV HCV RNA A1 HCV HCV HCV liver cirrhosis LC hepatocellular carcinoma HCC A1
 2940 2015 1 2 1 European Association for the Study of the Liver EASL 2015 HCV Journal of Hepatology GRADE A B C 3 1 2 1 2015 HCV PegIFN-α2a PegIFN-α2b Ribavirin Sofosbuvir Simeprevir Daclatasvir Sofosbuvir/ledipasvir
2940 2015 1 2 1 European Association for the Study of the Liver EASL 2015 HCV Journal of Hepatology GRADE A B C 3 1 2 1 2015 HCV PegIFN-α2a PegIFN-α2b Ribavirin Sofosbuvir Simeprevir Daclatasvir Sofosbuvir/ledipasvir
Zytiga... Zytiga... Zytiga Zytiga Zytiga
 250 本資料僅提供醫護人員衛教使用 ............... Zytiga... Zytiga... Zytiga... 2 3 4 5 6 7 8 9 Zytiga... 10 Zytiga... 10...... 13 18 Zytiga Zytiga 2 25% 3 PSA PSA 3~4 ng/ml PSA bone scan CT scan MRI 4 5 攝護腺癌之治療 治療方面
250 本資料僅提供醫護人員衛教使用 ............... Zytiga... Zytiga... Zytiga... 2 3 4 5 6 7 8 9 Zytiga... 10 Zytiga... 10...... 13 18 Zytiga Zytiga 2 25% 3 PSA PSA 3~4 ng/ml PSA bone scan CT scan MRI 4 5 攝護腺癌之治療 治療方面
或 bilirubin 2.0mg/dL, prothrombin time 延長係以該次檢驗 control 值為準 Ⅱ.Entecavir 每日限使用 1 粒 2. 慢性 B 型肝炎病毒帶原者 HBsAg(+):( 98/11/1) (1) 接受非肝臟之器官移植後,B 型肝炎發作者, 可長期使用
 藥品給付規定 修正對照表 第 10 節抗微生物劑 Antimicrobial agents 修正後給付規定 10.7.3.Lamivudine 100mg( 如 Zeffix);entecavir ( 如 Baraclude);telbivudine 600mg ( 如 Sebivo);tenofovir 300mg ( 如 Viread):( 92/10/1 93/2/1 93/8/1 94/10/1
藥品給付規定 修正對照表 第 10 節抗微生物劑 Antimicrobial agents 修正後給付規定 10.7.3.Lamivudine 100mg( 如 Zeffix);entecavir ( 如 Baraclude);telbivudine 600mg ( 如 Sebivo);tenofovir 300mg ( 如 Viread):( 92/10/1 93/2/1 93/8/1 94/10/1
臨床藥物治療學 Therapeutics of Clinical Drugs 參 C 型肝炎治療目標 (American Association for the Study of Liver Disease, AASLD) C (sustained virologic response, SVR)
 Therapeutics of Clinical Drugs 臨床藥物治療學 Thymalfasin 用於治療 C 型肝炎 光田綜合醫院藥劑部藥師白雅君 賴建名 摘要 C C interferon ribavirin Thymalfasin C phase III thymalfasin C C thymosin α1 thymalfasin 壹 前言 C interferon ribavirin
Therapeutics of Clinical Drugs 臨床藥物治療學 Thymalfasin 用於治療 C 型肝炎 光田綜合醫院藥劑部藥師白雅君 賴建名 摘要 C C interferon ribavirin Thymalfasin C phase III thymalfasin C C thymosin α1 thymalfasin 壹 前言 C interferon ribavirin
賀肝樂膜衣錠 (Zepatier tablet) 醫療科技評估報告 財團法人醫藥品查驗中心 Center For Drug Evaluation 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱 Zepatier tablet 成分 elbasvir/grazoprevir 建議者
 賀肝樂膜衣錠 (Zepatier tablet) 醫療科技評估報告 財團法人醫藥品查驗中心 Center For Drug Evaluation 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱 Zepatier tablet 成分 elbasvir/grazoprevir 建議者 藥品許可證持有商 含量規格劑型 主管機關許可適應症 建議健保給付之適應 症內容 建議健保給付條件 美商默沙東藥廠股份有限公司台灣分公司
賀肝樂膜衣錠 (Zepatier tablet) 醫療科技評估報告 財團法人醫藥品查驗中心 Center For Drug Evaluation 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱 Zepatier tablet 成分 elbasvir/grazoprevir 建議者 藥品許可證持有商 含量規格劑型 主管機關許可適應症 建議健保給付之適應 症內容 建議健保給付條件 美商默沙東藥廠股份有限公司台灣分公司
plx-005/04
 (HCV) (HCC) 3 2 HCV HCV Flaviviridae) RNA 6 HCV ( 1a 2b 3c ) 1 HCV 70% HCV quasispecies HCV HCV ORF 10 NS NS3 / NS5B RNA RNA HCV HCV 100 5min 60 10h WHO HCV 3% 1.7 HCV 3.5 -HCV 3.2% -HCV 3.6% 2.9% 2.5%
(HCV) (HCC) 3 2 HCV HCV Flaviviridae) RNA 6 HCV ( 1a 2b 3c ) 1 HCV 70% HCV quasispecies HCV HCV ORF 10 NS NS3 / NS5B RNA RNA HCV HCV 100 5min 60 10h WHO HCV 3% 1.7 HCV 3.5 -HCV 3.2% -HCV 3.6% 2.9% 2.5%
老人憂鬱症的認識與老人自殺問題
 18-24 25-44 45-64 65 10 8 6 4 2 0 ( 40% 15% Affect Cognition : drive Behavior DSM-V major depressive episode 2 9 5 Electronic Convulsion Therapy; ECT Rabins65 1% Rabins, 1992 20%-30% Blazer, 1994 65 12.9
18-24 25-44 45-64 65 10 8 6 4 2 0 ( 40% 15% Affect Cognition : drive Behavior DSM-V major depressive episode 2 9 5 Electronic Convulsion Therapy; ECT Rabins65 1% Rabins, 1992 20%-30% Blazer, 1994 65 12.9
384 劉俊人許景盛高嘉宏 東與北非地區, 第 5 型在南非, 而第 6 型主要在香港與越南發現 就 C 肝病毒感染的自然史而言, 急性 C 肝病毒感染後有百分之五十五到八十五的人會變成為慢性 C 肝病毒感染 這些慢性 C 肝病毒感染者中有七成的機會在 10 年後變成慢性 C 型肝炎的患者, 變成慢
 專題報導 內科學誌 2012:23:383-391 C 1,2 劉俊人 3 許景盛 1,2 高嘉宏 1 台大醫學院臨床醫學研究所 ; 2 台大醫院內科部暨肝炎研究中心 ; 3 慈濟醫院臺北分院肝膽腸胃科 摘 要 C 型肝炎病毒感染一直是全球公共衛生上的重要課題 慢性 C 型肝炎的治療在近年來已經有了長足的進步, 亞太地區在這個研究領域上也有許多深入的研究與新的發現 本文針對這個主題, 首先就全球慢性
專題報導 內科學誌 2012:23:383-391 C 1,2 劉俊人 3 許景盛 1,2 高嘉宏 1 台大醫學院臨床醫學研究所 ; 2 台大醫院內科部暨肝炎研究中心 ; 3 慈濟醫院臺北分院肝膽腸胃科 摘 要 C 型肝炎病毒感染一直是全球公共衛生上的重要課題 慢性 C 型肝炎的治療在近年來已經有了長足的進步, 亞太地區在這個研究領域上也有許多深入的研究與新的發現 本文針對這個主題, 首先就全球慢性
960110試評改善事項
 慢性 C 型肝炎治療的新進展 佛教大林慈濟醫院 肝膽腸胃科曾志偉醫師 C 型肝炎病毒簡介 C 型肝炎病毒 分類 : 黃病毒科 (Flaviviridae) 單股 RNA 病毒學 9400 nt, 3010-3033 aa 每日病毒產生量 > 10 12 病毒 / 天 以 RNA 為模版之 RNA 聚合酶 高突變率且無 校對 (proofreading) 功能 造成 HCV 變種 ( 類種 quasispecies)
慢性 C 型肝炎治療的新進展 佛教大林慈濟醫院 肝膽腸胃科曾志偉醫師 C 型肝炎病毒簡介 C 型肝炎病毒 分類 : 黃病毒科 (Flaviviridae) 單股 RNA 病毒學 9400 nt, 3010-3033 aa 每日病毒產生量 > 10 12 病毒 / 天 以 RNA 為模版之 RNA 聚合酶 高突變率且無 校對 (proofreading) 功能 造成 HCV 變種 ( 類種 quasispecies)
14 (genome) 可轉譯成一條約含 3000 個胺基酸的多蛋白, 經進一步處理後, 可切割成結構蛋白與非結構蛋白 結構蛋白包括核心蛋白 (C) 和兩個外套糖蛋白 (E1 E2), 非結構蛋白則包括 NS2 NS3 NS4A NS4B NS5A NS5B 1 C 型肝炎病毒在人體內的製造效率極高
 DOI 10.6314/JIMT.2016.27(1).02 2016 27 13-18 C 摘 要 C (pegylated interferon) (ribavirin) (direct-acting antiviral agent, DAA) C 關鍵詞 :C 型肝炎 (Hepatitis C) 直接作用抗病毒藥物 (Direct-acting antiviral agent, DAA) 免用干擾素療法
DOI 10.6314/JIMT.2016.27(1).02 2016 27 13-18 C 摘 要 C (pegylated interferon) (ribavirin) (direct-acting antiviral agent, DAA) C 關鍵詞 :C 型肝炎 (Hepatitis C) 直接作用抗病毒藥物 (Direct-acting antiviral agent, DAA) 免用干擾素療法
 2013~2015 保健食品產業專業人才 供需調查 2011 5 2011529 2012 2013~2015 2012 44.67% 2011 11.96% 2013~2015 ... 1... 1... 5... 10... 12... 13... 14... 19... 20... 22... 24... 12... 19... 21... 22 III IV 1... 1 2... 3
2013~2015 保健食品產業專業人才 供需調查 2011 5 2011529 2012 2013~2015 2012 44.67% 2011 11.96% 2013~2015 ... 1... 1... 5... 10... 12... 13... 14... 19... 20... 22... 24... 12... 19... 21... 22 III IV 1... 1 2... 3
人為疏失 人與人之間的溝通合作, 往往是事故的最終防線, 若能發揮團隊合作的功能, 則比較能克服其他因素所造成的危害
 人為因素與 飛航安全 人為因素 7 7 8 人為因素的類別 H 1972 E. Edward SHELL S S L E software, H handware, E environment, L liveware L SHELL 20 2014 3 495 人為疏失 人與人之間的溝通合作, 往往是事故的最終防線, 若能發揮團隊合作的功能, 則比較能克服其他因素所造成的危害 2014 3 495
人為因素與 飛航安全 人為因素 7 7 8 人為因素的類別 H 1972 E. Edward SHELL S S L E software, H handware, E environment, L liveware L SHELL 20 2014 3 495 人為疏失 人與人之間的溝通合作, 往往是事故的最終防線, 若能發揮團隊合作的功能, 則比較能克服其他因素所造成的危害 2014 3 495
治療血管的雷射 port wine stain 1988 FDA KTP KTP
 您選對雷射了嗎 40 1917 1959 Maiman 1963 20 1983 AndersonParrish 22 2013 5 485 以往須以手術 磨皮等方法才能去除的刺青, 現在用雷射就可以輕易處理 此外, 各種皮膚血管病變 痣 疤痕, 乃至於皺紋的去除, 也可以用雷射來達成 治療血管的雷射 port wine stain 1988 FDA 585 590 595 600 1.5 40 4
您選對雷射了嗎 40 1917 1959 Maiman 1963 20 1983 AndersonParrish 22 2013 5 485 以往須以手術 磨皮等方法才能去除的刺青, 現在用雷射就可以輕易處理 此外, 各種皮膚血管病變 痣 疤痕, 乃至於皺紋的去除, 也可以用雷射來達成 治療血管的雷射 port wine stain 1988 FDA 585 590 595 600 1.5 40 4
愛滋病毒與 C 型肝炎雙重感染之治療新進展 邱彥程 鄭斌男 陳炯瑜 張定宗 成大醫院胃腸肝膽科 前言慢性 C 型肝炎的治療在近幾年來有長足的進步 過去幾年來, 針對非愛滋病毒感染者的慢性 C 型肝炎治療多以長效型干擾素 pegylated interferon 合併雷巴威林 ribavirin 為治
 愛滋病毒與 C 型肝炎雙重感染之治療新進展 邱彥程 鄭斌男 陳炯瑜 張定宗 成大醫院胃腸肝膽科 前言慢性 C 型肝炎的治療在近幾年來有長足的進步 過去幾年來, 針對非愛滋病毒感染者的慢性 C 型肝炎治療多以長效型干擾素 pegylated interferon 合併雷巴威林 ribavirin 為治療的主流 合併有 C 型肝炎病毒的愛滋病毒感染者也是以此為主要的治療方式 和 C 型肝炎單一感染者治療成效相比,
愛滋病毒與 C 型肝炎雙重感染之治療新進展 邱彥程 鄭斌男 陳炯瑜 張定宗 成大醫院胃腸肝膽科 前言慢性 C 型肝炎的治療在近幾年來有長足的進步 過去幾年來, 針對非愛滋病毒感染者的慢性 C 型肝炎治療多以長效型干擾素 pegylated interferon 合併雷巴威林 ribavirin 為治療的主流 合併有 C 型肝炎病毒的愛滋病毒感染者也是以此為主要的治療方式 和 C 型肝炎單一感染者治療成效相比,
( ) (1) (2) (3) (4) 2
 2007 11 29 1. ( ) 2. ( ) 3. 1 ( ) 1. 2. (1) (2) (3) (4) 2 1. (1) (2) 2. ( ) $20,000,000 X1 1 1 $3,000,000 X1 1 1 1,000,000 $12,000,000 $4,000,000 $5,000,000 $10 X1 1 1 $13 (1) ( ) $5,000,000 $8,000,000
2007 11 29 1. ( ) 2. ( ) 3. 1 ( ) 1. 2. (1) (2) (3) (4) 2 1. (1) (2) 2. ( ) $20,000,000 X1 1 1 $3,000,000 X1 1 1 1,000,000 $12,000,000 $4,000,000 $5,000,000 $10 X1 1 1 $13 (1) ( ) $5,000,000 $8,000,000
F A F G F H F F A F G F H doi : / NRD 1032 PK PK 攻防首部曲 在藥品查驗登記時, 必須檢附相關藥動學資料支持藥品的療效與安全性以備核准
 藥物在體內的 PK 攻防 36 藥物動力學 PharmacokineticsADME Absorption Z Disposition Distribution Elimination Metabolism D Excretion T C T C Z pharmacokinetics PK absorption distribution metabolism excretion ADME 2015
藥物在體內的 PK 攻防 36 藥物動力學 PharmacokineticsADME Absorption Z Disposition Distribution Elimination Metabolism D Excretion T C T C Z pharmacokinetics PK absorption distribution metabolism excretion ADME 2015
....V....VII.... VIII
 ....V....VII.... VIII................................. 002... 002... 004... 006... 012... 014... 019.... 022.... 023................................. 026... 026... 027... 039 XIII...043... 043... 045....
....V....VII.... VIII................................. 002... 002... 004... 006... 012... 014... 019.... 022.... 023................................. 026... 026... 027... 039 XIII...043... 043... 045....
0 0 = 1 0 = 0 1 = = 1 1 = 0 0 = 1
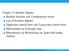 0 0 = 1 0 = 0 1 = 0 1 1 = 1 1 = 0 0 = 1 : = {0, 1} : 3 (,, ) = + (,, ) = + + (, ) = + (,,, ) = ( + )( + ) + ( + )( + ) + = + = = + + = + = ( + ) + = + ( + ) () = () ( + ) = + + = ( + )( + ) + = = + 0
0 0 = 1 0 = 0 1 = 0 1 1 = 1 1 = 0 0 = 1 : = {0, 1} : 3 (,, ) = + (,, ) = + + (, ) = + (,,, ) = ( + )( + ) + ( + )( + ) + = + = = + + = + = ( + ) + = + ( + ) () = () ( + ) = + + = ( + )( + ) + = = + 0
Microsoft Word - Pegasys RP PI_ _clean version
 2006 10 18 2006 12 22 2007 11 14 2007 12 12 2008 05 28 2008 12 11 2010 10 14 2011 02 11 2011 08 04 2012 04 28 2012 12 20 2013 01 14 2014 12 05 2015 03 09 2016 9 27 2016 12 19 2017 05 04 2017 08 16 α-2a
2006 10 18 2006 12 22 2007 11 14 2007 12 12 2008 05 28 2008 12 11 2010 10 14 2011 02 11 2011 08 04 2012 04 28 2012 12 20 2013 01 14 2014 12 05 2015 03 09 2016 9 27 2016 12 19 2017 05 04 2017 08 16 α-2a
戒菸實務個案自助手冊105年Ver.2
 本計劃經費來自 品健康福利捐支應 衛生福利部國民健康署 我 名字 為了 以下理由 1. 2. 3. 4. 5. 決定從 年 月 日起 簽署人 (簽章) 見證人 (簽章) 年 月 日 a 準備戒 V 環境的準備 排除讓自己想吸 自己戒 的環境 V 心理的準備 瞭解自己的吸 的環境 建立能提醒 行為 強化戒 決心 V 身體的準備 評估身體的尼古丁依賴度 必要時找尋 藥物降低戒 戒 的難度
本計劃經費來自 品健康福利捐支應 衛生福利部國民健康署 我 名字 為了 以下理由 1. 2. 3. 4. 5. 決定從 年 月 日起 簽署人 (簽章) 見證人 (簽章) 年 月 日 a 準備戒 V 環境的準備 排除讓自己想吸 自己戒 的環境 V 心理的準備 瞭解自己的吸 的環境 建立能提醒 行為 強化戒 決心 V 身體的準備 評估身體的尼古丁依賴度 必要時找尋 藥物降低戒 戒 的難度
 慢性腎病兒童第7 章兒童慢性腎病的主要臨床癥狀,包括食慾下降 疲勞 生長發育遲緩 高血壓 多尿及腎性骨病等 第 7 章 慢性腎病兒童 * 腎延敏行 積極面對慢性腎病60 醫療上的問題 * 慢性腎病兒童61 腎延敏行 積極面對慢性腎病62 5 6 慢性腎病兒童的身心發展需要 慢性腎病兒童63 腎延敏行 積極面對慢性腎病64 慢性腎病 : : : : : (1) (maltodextrin) (2)
慢性腎病兒童第7 章兒童慢性腎病的主要臨床癥狀,包括食慾下降 疲勞 生長發育遲緩 高血壓 多尿及腎性骨病等 第 7 章 慢性腎病兒童 * 腎延敏行 積極面對慢性腎病60 醫療上的問題 * 慢性腎病兒童61 腎延敏行 積極面對慢性腎病62 5 6 慢性腎病兒童的身心發展需要 慢性腎病兒童63 腎延敏行 積極面對慢性腎病64 慢性腎病 : : : : : (1) (maltodextrin) (2)
1 500 表 1: 各國平均分數
 2012 年多益測驗全球考生資料統計報告 A < 1> 2012 B < 2> 100% 500 2012 2012 / 21 25 (38%) 57% (58%) 25% / 20% 35% 53% 31% 17% / 31% 12% 6 45 1-10% 81% 6 2012 48 3 30% 1 編註 1: 請見 P.15 編註 2: 請見 P.17 1 500 表 1: 各國平均分數 466
2012 年多益測驗全球考生資料統計報告 A < 1> 2012 B < 2> 100% 500 2012 2012 / 21 25 (38%) 57% (58%) 25% / 20% 35% 53% 31% 17% / 31% 12% 6 45 1-10% 81% 6 2012 48 3 30% 1 編註 1: 請見 P.15 編註 2: 請見 P.17 1 500 表 1: 各國平均分數 466
營養補給劑
 格 利 源 展 膠 囊 200 毫 克 本 藥 須 由 醫 師 處 方 使 用, 經 口 服 給 予 LIV-UP CAPSULE 200mg GREENPHARM 衛 署 藥 製 字 第 048152 號 (G-9207) 說 明 Liv-up 膠 囊 內 含 可 溶 於 水 微 溶 於 酒 精 的 白 色 晶 狀 粉 末, 充 填 於 紅 色 不 透 明 的 明 膠 膠 囊 中 每 一 個 膠
格 利 源 展 膠 囊 200 毫 克 本 藥 須 由 醫 師 處 方 使 用, 經 口 服 給 予 LIV-UP CAPSULE 200mg GREENPHARM 衛 署 藥 製 字 第 048152 號 (G-9207) 說 明 Liv-up 膠 囊 內 含 可 溶 於 水 微 溶 於 酒 精 的 白 色 晶 狀 粉 末, 充 填 於 紅 色 不 透 明 的 明 膠 膠 囊 中 每 一 個 膠
Microsoft Word - ACI chapter00-1ed.docx
 前言 Excel Excel - v - 財務管理與投資分析 -Excel 建模活用範例集 5 相關 平衡 敏感 - vi - 前言 模擬 If-Then 規劃 ERP BI - vii - 財務管理與投資分析 -Excel 建模活用範例集 ERP + BI + ERP BI Excel 88 Excel 1. Excel Excel 2. Excel 3. Excel - viii - 前言 1.
前言 Excel Excel - v - 財務管理與投資分析 -Excel 建模活用範例集 5 相關 平衡 敏感 - vi - 前言 模擬 If-Then 規劃 ERP BI - vii - 財務管理與投資分析 -Excel 建模活用範例集 ERP + BI + ERP BI Excel 88 Excel 1. Excel Excel 2. Excel 3. Excel - viii - 前言 1.
表二 105 年國中教育會考英語科閱讀與聽力答對題數對應整體能力等級加標示對照表 閱讀答 對題數 聽力答對題數 待加強待加強待加強待加強待加強待加強待加強待加強待加強待加強待加強待加強
 表一 105 年國中教育會考國文科 社會科與自然科能力等級加標示與答對題數對照表 國文社會自然 A++ 46-48 60-63 51-54 A+ 42-48 44-45 54-63 58-59 46-54 49-50 A 42-43 54-57 46-48 B++ 37-41 45-53 37-45 B+ 20-41 31-36 24-53 38-44 20-45 30-36 B 20-30 24-37
表一 105 年國中教育會考國文科 社會科與自然科能力等級加標示與答對題數對照表 國文社會自然 A++ 46-48 60-63 51-54 A+ 42-48 44-45 54-63 58-59 46-54 49-50 A 42-43 54-57 46-48 B++ 37-41 45-53 37-45 B+ 20-41 31-36 24-53 38-44 20-45 30-36 B 20-30 24-37
38 嬰兒猝死症候群 (SIDS) 急性支氣管炎及急性細支 其他 9, 臺灣地區 總計 0 歲 死亡數 名 原因 Number Crude 名 原因 Number of Deaths Death Rate of Deaths 所有死亡原因 64,
 臺灣地區 總計 0 歲 死亡數 名 原因 Number Crude 名 原因 Number of Deaths Death Rate of Deaths 所有死亡原因 97,979 838.0 所有死亡原因 446 1 惡性腫瘤 28,476 243.6 1 源於周產期的特定病況 195 2 心臟疾病 ( 高血壓性疾病 11,484 98.2 2 先天性畸形變形及染色體 99 3 腦血管疾病 6,980
臺灣地區 總計 0 歲 死亡數 名 原因 Number Crude 名 原因 Number of Deaths Death Rate of Deaths 所有死亡原因 97,979 838.0 所有死亡原因 446 1 惡性腫瘤 28,476 243.6 1 源於周產期的特定病況 195 2 心臟疾病 ( 高血壓性疾病 11,484 98.2 2 先天性畸形變形及染色體 99 3 腦血管疾病 6,980
 46 2011 11 467 數位遊戲式學習系統 7 2011 11 467 47 3 DBGameSys 48 2011 11 467 正規化資料模組 如何配置並儲存電子化資料 以 便減少資料被重覆儲存的程序 DBGameSys的主要功能模組包 學習者 審核評分模組 含 正規化資料模組 審核評分 模組 高分列表模組3大區塊 系統資料庫 在正規化資料模組的執行 高分列表模組 過程中 先要求學習者瀏覽遊戲
46 2011 11 467 數位遊戲式學習系統 7 2011 11 467 47 3 DBGameSys 48 2011 11 467 正規化資料模組 如何配置並儲存電子化資料 以 便減少資料被重覆儲存的程序 DBGameSys的主要功能模組包 學習者 審核評分模組 含 正規化資料模組 審核評分 模組 高分列表模組3大區塊 系統資料庫 在正規化資料模組的執行 高分列表模組 過程中 先要求學習者瀏覽遊戲
第一章 緒論
 8.doc 9483 175-203 中共地方政府 較大的市 建制與地位之探討 摘要 關鍵詞 : 較大的市 設區的市 行政區劃 地級市 地方政府 地方立法 175 壹 前言 1 2 貳 較大的市 設置的背景與意義 1949 10 176 1950 1954 9 20 53 1955 6 9 20 1959 9 17 9 3 1978 177 33 4 5 6 80 7 1976 1979 7 1 20
8.doc 9483 175-203 中共地方政府 較大的市 建制與地位之探討 摘要 關鍵詞 : 較大的市 設區的市 行政區劃 地級市 地方政府 地方立法 175 壹 前言 1 2 貳 較大的市 設置的背景與意義 1949 10 176 1950 1954 9 20 53 1955 6 9 20 1959 9 17 9 3 1978 177 33 4 5 6 80 7 1976 1979 7 1 20
決策題目:
 澄清醫院中港分院慢性 C 型肝炎病毒基因型第一型對於 C 型肝炎全口服小分子藥物治療選擇評估表 收案流程圖 經門診診斷為 Anti HCV(+) 之病患 經住院診斷為 Anti HCV(+) 之病患 抽血檢驗是否符合 HCV 基因型第 1 型之治療 基因型非第 1 型 基因型第 1 型 不收案 收案 醫師於門診詳細解釋治療 過程及用藥選擇 (SDM) 醫師請肝炎個案管理師至 門診協助加強衛教 (SDM)
澄清醫院中港分院慢性 C 型肝炎病毒基因型第一型對於 C 型肝炎全口服小分子藥物治療選擇評估表 收案流程圖 經門診診斷為 Anti HCV(+) 之病患 經住院診斷為 Anti HCV(+) 之病患 抽血檢驗是否符合 HCV 基因型第 1 型之治療 基因型非第 1 型 基因型第 1 型 不收案 收案 醫師於門診詳細解釋治療 過程及用藥選擇 (SDM) 醫師請肝炎個案管理師至 門診協助加強衛教 (SDM)
<C 型 肝 炎 之 治 療 藥 物 新 進 展 Interferon free treatment strategy> 多 變, 讓 疫 苗 的 研 發 遭 到 層 層 的 障 礙, 始 終 無 法 突 破 所 幸 生 物 科 技 在 最 近 十 年 有 了 長 足 的 進 步 科 學 家 們 對
 站 在 巨 人 的 肩 膀 上 看 世 界 C 型 肝 炎 真 的 可 以 治 癒 嗎? 王 鼐 艾 伯 維 藥 品 醫 藥 學 術 處 醫 藥 學 術 顧 問 肝 炎, 一 個 臺 灣 民 眾 耳 熟 能 響 的 疾 病 從 國 父 孫 中 山 先 生 歌 手 薛 岳, 到 青 春 偶 像 安 鈞 璨, 種 種 和 肝 臟 相 關 的 疾 病, 帶 走 了 不 少 我 們 心 目 中 不 少 重
站 在 巨 人 的 肩 膀 上 看 世 界 C 型 肝 炎 真 的 可 以 治 癒 嗎? 王 鼐 艾 伯 維 藥 品 醫 藥 學 術 處 醫 藥 學 術 顧 問 肝 炎, 一 個 臺 灣 民 眾 耳 熟 能 響 的 疾 病 從 國 父 孫 中 山 先 生 歌 手 薛 岳, 到 青 春 偶 像 安 鈞 璨, 種 種 和 肝 臟 相 關 的 疾 病, 帶 走 了 不 少 我 們 心 目 中 不 少 重
SW cdr
 1~2 3 4 5~6 7~8 9~10 11 12 13 14 15 16~18 16 16 17 17 18 18 18 19 19 19 20 21 22 23~26 23 24 24 25 26 27 27 27 : 110V 1 110V 110V 15A 2 3 23 24 4 ( ) 5 6 1 2 26 20 l 1 7 3 4 5 15 17 18 12 7~13 6 ~ 8 ~
1~2 3 4 5~6 7~8 9~10 11 12 13 14 15 16~18 16 16 17 17 18 18 18 19 19 19 20 21 22 23~26 23 24 24 25 26 27 27 27 : 110V 1 110V 110V 15A 2 3 23 24 4 ( ) 5 6 1 2 26 20 l 1 7 3 4 5 15 17 18 12 7~13 6 ~ 8 ~
20 男性勃起功能障礙的成因 勃起功能障礙從原本是一個難以啟齒的不治之症, 轉變成一個容易治療的疾病, 而且成了一個攸關公共衛生的議題
 62 2014 3 495 一粒紅蛋 20 一粒紅蛋 想欲結髮傳子孫無疑明月遇烏雲夫婿耽誤阮青春噯唷一粒紅蛋動心悶夢想享福成雙對哪知洞房空富貴含蕊牡丹無露水噯唷一粒紅蛋引珠淚春野鴛鴦同一衾傷情目屎難得禁掛名夫妻對獨枕噯唷一粒紅蛋擾亂心愛情今生全無望較慘水虌墜落甕堅守活寡十外冬噯唷一粒紅蛋真苦痛 20 男性勃起功能障礙的成因 勃起功能障礙從原本是一個難以啟齒的不治之症, 轉變成一個容易治療的疾病, 而且成了一個攸關公共衛生的議題
62 2014 3 495 一粒紅蛋 20 一粒紅蛋 想欲結髮傳子孫無疑明月遇烏雲夫婿耽誤阮青春噯唷一粒紅蛋動心悶夢想享福成雙對哪知洞房空富貴含蕊牡丹無露水噯唷一粒紅蛋引珠淚春野鴛鴦同一衾傷情目屎難得禁掛名夫妻對獨枕噯唷一粒紅蛋擾亂心愛情今生全無望較慘水虌墜落甕堅守活寡十外冬噯唷一粒紅蛋真苦痛 20 男性勃起功能障礙的成因 勃起功能障礙從原本是一個難以啟齒的不治之症, 轉變成一個容易治療的疾病, 而且成了一個攸關公共衛生的議題
Pegasys vials,PFS Hep B & C_Chinesen.doc
 135 /180 /, 135 /0.5 180 /0.5 Pegasys vials 135mcg/ml, 180 mcg/ml Pegasys prefilled syringes 135mcg/0.5ml, 180 mcg/0.5ml 1. (vial) (prefilled syringe) 1.0ml 135mcg Peginterferon alfa-2a 1.0ml 180mcg Peginterferon
135 /180 /, 135 /0.5 180 /0.5 Pegasys vials 135mcg/ml, 180 mcg/ml Pegasys prefilled syringes 135mcg/0.5ml, 180 mcg/0.5ml 1. (vial) (prefilled syringe) 1.0ml 135mcg Peginterferon alfa-2a 1.0ml 180mcg Peginterferon
Microsoft Word - statistics04-1_doc.docx
 入學新生體檢及異常統計表 (102 學年度 ) 國立成功大學 102 學年度新生體檢表概況 學院別 未檢 比例 不合格 比例 合格 比例 總 文學院 16 4.68 290 88.96 36 11.04 342 理學院 48 9.86 345 78.59 94 21.41 487 工學院 256 12.59 1432 80.54 346 19.46 2034 管理學院 42 5.10 672 85.93
入學新生體檢及異常統計表 (102 學年度 ) 國立成功大學 102 學年度新生體檢表概況 學院別 未檢 比例 不合格 比例 合格 比例 總 文學院 16 4.68 290 88.96 36 11.04 342 理學院 48 9.86 345 78.59 94 21.41 487 工學院 256 12.59 1432 80.54 346 19.46 2034 管理學院 42 5.10 672 85.93
生與死的尊嚴 生與死的尊嚴
 生與死的尊嚴 目錄 生與死的尊嚴 2 認識生命的實相 3 生從何處來? 死往何處去? 8 佛教徒的生死觀 10 如何面對死亡? 如何使得死亡有尊嚴? 20 生與死的尊嚴 生與死的尊嚴 認識生命的實相 認識生命的實相 ( 一 ) 由生命的無奈 無所依賴及無所適從, 轉變為生命的可愛 可貴與自我的肯定 ( 二 ) 生命的出生與死亡, 關係密切, 不可分割 出生之時已確定了死亡的必然到臨 生未必可喜, 死未必可哀,
生與死的尊嚴 目錄 生與死的尊嚴 2 認識生命的實相 3 生從何處來? 死往何處去? 8 佛教徒的生死觀 10 如何面對死亡? 如何使得死亡有尊嚴? 20 生與死的尊嚴 生與死的尊嚴 認識生命的實相 認識生命的實相 ( 一 ) 由生命的無奈 無所依賴及無所適從, 轉變為生命的可愛 可貴與自我的肯定 ( 二 ) 生命的出生與死亡, 關係密切, 不可分割 出生之時已確定了死亡的必然到臨 生未必可喜, 死未必可哀,
愛滋實務與治理的政治 - 綜合論壇 以及面對這一連串以 責任 為架構衍生出來的愛滋政策如何造就了台灣現在的愛滋處境
 愛滋治理與在地行動 愛滋實務與治理的政治 - 綜合論壇 王蘋 ( 主持人 ) 張正學 愛滋 ( )15 愛滋 185 愛滋實務與治理的政治 - 綜合論壇 以及面對這一連串以 責任 為架構衍生出來的愛滋政策如何造就了台灣現在的愛滋處境 2011 186 愛滋治理與在地行動 責任 (MSM) MSM 2011 2 187 愛滋實務與治理的政治 - 綜合論壇 粗糙的年齡劃分 ISO( ) ( :. )!!
愛滋治理與在地行動 愛滋實務與治理的政治 - 綜合論壇 王蘋 ( 主持人 ) 張正學 愛滋 ( )15 愛滋 185 愛滋實務與治理的政治 - 綜合論壇 以及面對這一連串以 責任 為架構衍生出來的愛滋政策如何造就了台灣現在的愛滋處境 2011 186 愛滋治理與在地行動 責任 (MSM) MSM 2011 2 187 愛滋實務與治理的政治 - 綜合論壇 粗糙的年齡劃分 ISO( ) ( :. )!!
中 国 肝 脏 病 杂 志 ( 电 子 版 ) 2010 年 第 2 卷 第 4 期 指 南 55 1 诊 断 1.1 临 床 表 现 肝 纤 维 化 患 者 的 临 床 表 现 无 特 异 性, 差 异 较 大 常 见 的 临 床 表 现 有 : 疲 倦 乏 力 食 欲 不 振 大 便 异 常 肝
 54 指 南 中 国 肝 脏 病 杂 志 ( 电 子 版 ) 2010 年 第 2 卷 第 4 期 肝 纤 维 化 中 西 医 结 合 诊 疗 指 南 中 国 中 西 医 结 合 学 会 肝 病 专 业 委 员 会 肝 纤 维 化 在 国 际 疾 病 分 类 (international classification of disease,icd-10) 中 可 作 为 一 种 病 名 (K74.001),
54 指 南 中 国 肝 脏 病 杂 志 ( 电 子 版 ) 2010 年 第 2 卷 第 4 期 肝 纤 维 化 中 西 医 结 合 诊 疗 指 南 中 国 中 西 医 结 合 学 会 肝 病 专 业 委 员 会 肝 纤 维 化 在 国 际 疾 病 分 类 (international classification of disease,icd-10) 中 可 作 为 一 种 病 名 (K74.001),
Microsoft Word - 文件1
 染牛隻的臨床症狀狀包括情緒不安 敏感 有攻擊性 磨牙 動作失調 後肢無力 躺臥死亡等症狀狀, 死亡後病理解剖, 會發現其腦部組織出 現空洞, 呈現海綿狀狀病變 被製成肉骨粉, 且掺入飼料中餵養牛隻, 因而使牛隻有受到感染的機 會 根據流行行病學調查研究顯示, 牛海綿狀狀腦病不會透過空氣傳播, 也不會因牛與牛之間的直接或間接接觸 ( 經口 鼻 交配 ) 而平行行感 切實檢驗食品安全
染牛隻的臨床症狀狀包括情緒不安 敏感 有攻擊性 磨牙 動作失調 後肢無力 躺臥死亡等症狀狀, 死亡後病理解剖, 會發現其腦部組織出 現空洞, 呈現海綿狀狀病變 被製成肉骨粉, 且掺入飼料中餵養牛隻, 因而使牛隻有受到感染的機 會 根據流行行病學調查研究顯示, 牛海綿狀狀腦病不會透過空氣傳播, 也不會因牛與牛之間的直接或間接接觸 ( 經口 鼻 交配 ) 而平行行感 切實檢驗食品安全
防癌講座 90 HPV CIN 子宮頸的 HPV 感染 HPV HPV HPV HPV HPV HPV CIN HPV 70% 2 HPV 20-30% CIN CIN HPV 1618
 婦癌的防治 何志明 國泰綜合醫院 婦癌中心主任 從子宮頸癌成功防治經驗談起 1750 800 80% 2 (human papillomavirus, HPV) 2-3 30 H P V 10-15% 99.7% 子宮頸癌篩檢 50 30 3 50% 80% 30% 2 防癌講座 90 HPV CIN 子宮頸的 HPV 感染 HPV HPV HPV-16 18 26 31 33 35 39 45 51
婦癌的防治 何志明 國泰綜合醫院 婦癌中心主任 從子宮頸癌成功防治經驗談起 1750 800 80% 2 (human papillomavirus, HPV) 2-3 30 H P V 10-15% 99.7% 子宮頸癌篩檢 50 30 3 50% 80% 30% 2 防癌講座 90 HPV CIN 子宮頸的 HPV 感染 HPV HPV HPV-16 18 26 31 33 35 39 45 51
 24 24. Special Issue 名 人 講 堂 專 題 研 究 表3 新加坡政府對銷售給不同屬性投資人的對沖基金管理指引 25 焦 點 視 界 27 26 市 場 掃 描 證 交 集 錦 資料來源 新加坡金融管理局(Monetary Authority of Singapore)網站 25 機構投資人定義 (1)依銀行法設立的銀行 (2)商業銀行 (3)財務公司 (4)保險公司 (5)信託公司
24 24. Special Issue 名 人 講 堂 專 題 研 究 表3 新加坡政府對銷售給不同屬性投資人的對沖基金管理指引 25 焦 點 視 界 27 26 市 場 掃 描 證 交 集 錦 資料來源 新加坡金融管理局(Monetary Authority of Singapore)網站 25 機構投資人定義 (1)依銀行法設立的銀行 (2)商業銀行 (3)財務公司 (4)保險公司 (5)信託公司
_BK07.ps, page Preflight ( _BK07.indd )
 1 2 3 4 5 6 7 8 9 10 11 12 7.3 家庭變遷對健康的影響 在經濟起伏時 家庭支持十分重要 在 兩地三岸社會政策 一書中 魏雁濱 曾群 在 社會排斥 一文提及一項研究發現 在北歐六國和蘇格蘭 家人支持對防止失業 青年陷入貧窮發揮重要作用 在福利制度相對比北歐較弱的南歐國家如意大利 家庭 和社會網絡對失業者起較大的支持和保護作用 在中國人社會 家庭支持也十分重要 根據本港社會服務聯會
1 2 3 4 5 6 7 8 9 10 11 12 7.3 家庭變遷對健康的影響 在經濟起伏時 家庭支持十分重要 在 兩地三岸社會政策 一書中 魏雁濱 曾群 在 社會排斥 一文提及一項研究發現 在北歐六國和蘇格蘭 家人支持對防止失業 青年陷入貧窮發揮重要作用 在福利制度相對比北歐較弱的南歐國家如意大利 家庭 和社會網絡對失業者起較大的支持和保護作用 在中國人社會 家庭支持也十分重要 根據本港社會服務聯會
Microsoft Word - ch02
 附錄二 相關身心障礙類別 ICD-9-CM 與對應之 ICD-10-CM 障 國際疾病編碼 礙類別 ICD-9-CM ICD-10-CM F20.0 Paranoid schizophrenia 妄想型思覺失調症 ' 性精神病患者 295 295.* 295.** 296 296.* 296.** 297 297.* 298 298.* F20.1 Disorganized schizophrenia
附錄二 相關身心障礙類別 ICD-9-CM 與對應之 ICD-10-CM 障 國際疾病編碼 礙類別 ICD-9-CM ICD-10-CM F20.0 Paranoid schizophrenia 妄想型思覺失調症 ' 性精神病患者 295 295.* 295.** 296 296.* 296.** 297 297.* 298 298.* F20.1 Disorganized schizophrenia
1970 新技術的應用 X = 20 + B 13B δ13c X 1 X
 凡發生過的必留下痕跡 同位素分析的考古應用? 如何考古 06 2013 9 489 經由人骨中碳和氮同位素的分析, 提供考古學家另一個探討古代攝食系統的途徑 另外, 可以藉由鍶同位素分析了解人群的來源與遷移過程 1970 新技術的應用 13 15 13 12 15 14 13 15 13 12 15 13 15 13 X = 20 + B 13B δ13c X 1 X 2013 9 489 07 δ
凡發生過的必留下痕跡 同位素分析的考古應用? 如何考古 06 2013 9 489 經由人骨中碳和氮同位素的分析, 提供考古學家另一個探討古代攝食系統的途徑 另外, 可以藉由鍶同位素分析了解人群的來源與遷移過程 1970 新技術的應用 13 15 13 12 15 14 13 15 13 12 15 13 15 13 X = 20 + B 13B δ13c X 1 X 2013 9 489 07 δ
CO 2 以鄰為壑的台灣建築產業
 6 20114460台灣綠建築政策的成就 台灣的建築產業消耗了大量的水泥, 也排放了很多的營建廢棄物, 建築物的壽命卻嚴重偏低 建築的環保時代已來臨 1992 199212United Nations Commission on Sustainable Development, UNCSD1998 1996 CO 2 以鄰為壑的台灣建築產業 27.22 34 1 6 20114460 7 8 201144604
6 20114460台灣綠建築政策的成就 台灣的建築產業消耗了大量的水泥, 也排放了很多的營建廢棄物, 建築物的壽命卻嚴重偏低 建築的環保時代已來臨 1992 199212United Nations Commission on Sustainable Development, UNCSD1998 1996 CO 2 以鄰為壑的台灣建築產業 27.22 34 1 6 20114460 7 8 201144604
Microsoft Word - Roferon A_CDS 7.0_Redressing site_0617-ROF-01_clean
 0617-ROF-01 -A ( α-2a) Roferon -A 1. 1.1 / 1.2 Roferon-A 1.3 1.4 α-2a α-2a DNA 0.5 ml 3MIU α- 2a Sodium chloride, Ammonium acetate, Benzyl alcohol, polysorbate 80, Glacial acetic acid, sodium hydroxide,
0617-ROF-01 -A ( α-2a) Roferon -A 1. 1.1 / 1.2 Roferon-A 1.3 1.4 α-2a α-2a DNA 0.5 ml 3MIU α- 2a Sodium chloride, Ammonium acetate, Benzyl alcohol, polysorbate 80, Glacial acetic acid, sodium hydroxide,
老人 社 交 活 動 McAuley et al., 2000 Glass 1999 Mendes de Leon ~2 1~ % 10.56% 9.23% 6.05% 24.72% 14.18% 12.12% 影響老人社交活動的因素一 生理功能的改變 Bar
 社交活動對老人的影響 文 / 張麗芳 RN, 新樓醫院護理部督導, 導輔英科技大學護理系研究所進修中 前言 7 28 1993 7 2007 10 65 233 133 10.16 57.6 95 2.4 2005 65 29.52% 65.20% 55.16% Mendes de Leon Glass Berkman 2002 34.1% 43.2% 2005 社交活動的概念一 社交活動的定義 social
社交活動對老人的影響 文 / 張麗芳 RN, 新樓醫院護理部督導, 導輔英科技大學護理系研究所進修中 前言 7 28 1993 7 2007 10 65 233 133 10.16 57.6 95 2.4 2005 65 29.52% 65.20% 55.16% Mendes de Leon Glass Berkman 2002 34.1% 43.2% 2005 社交活動的概念一 社交活動的定義 social
二 診斷 評估與治療流程 1. 基本檢查 A. History taking (Especially family history), physical exams B. Check lipid profile (Total cholesterol, LDL-C, HDL-C, Triglyceri
 一 血脂異常之分類與定義 中華民國血脂異常分類之建議 美國國家膽固醇教育計畫血脂小組血脂肪異常分級 歐洲動脈硬化學會對血脂異常之治療性分類 二 診斷 評估與治療流程 1. 基本檢查 A. History taking (Especially family history), physical exams B. Check lipid profile (Total cholesterol, LDL-C,
一 血脂異常之分類與定義 中華民國血脂異常分類之建議 美國國家膽固醇教育計畫血脂小組血脂肪異常分級 歐洲動脈硬化學會對血脂異常之治療性分類 二 診斷 評估與治療流程 1. 基本檢查 A. History taking (Especially family history), physical exams B. Check lipid profile (Total cholesterol, LDL-C,
1
 1 () () 2 () () 1987 1988 () () 2010 來 理 3 () () () () () 4 () ( ) ( ) 來 理 () 1 5 高中生對手搖杯飲料之成癮度探討 高中生對手搖杯飲料之成癮度探討 以東港海事為例 價格便 宜 14% 離家近 12% 特色茶 飲 店面 19% 設計 3% 品牌 10% 促銷活 動 8% 品質 14% 碳酸 咖啡 6% 2% 服 務 態 度
1 () () 2 () () 1987 1988 () () 2010 來 理 3 () () () () () 4 () ( ) ( ) 來 理 () 1 5 高中生對手搖杯飲料之成癮度探討 高中生對手搖杯飲料之成癮度探討 以東港海事為例 價格便 宜 14% 離家近 12% 特色茶 飲 店面 19% 設計 3% 品牌 10% 促銷活 動 8% 品質 14% 碳酸 咖啡 6% 2% 服 務 態 度
Microsoft Word - Pegasys RP PI-20150309_Clean version
 2006 10 18 2006 12 22 2007 11 14 2007 12 12 2008 05 28 2008 12 11 2010 10 14 2011 02 11 2011 08 04 2012 04 28 2012 12 20 2013 01 14 2014 12 05 2015 03 09 α-2a α α-2a [ ] / [] α-2a Pegasys Peginterferon
2006 10 18 2006 12 22 2007 11 14 2007 12 12 2008 05 28 2008 12 11 2010 10 14 2011 02 11 2011 08 04 2012 04 28 2012 12 20 2013 01 14 2014 12 05 2015 03 09 α-2a α α-2a [ ] / [] α-2a Pegasys Peginterferon
本月專題 科學新聞判讀力 Article.aspx?a= 目前並沒有充足證據證明基改作物會讓人生病或危害環境 109 Greenpeace https://www.you
 / 嚇死我了 這些究竟能不能吃?/ 嚇死我了 這些究竟能不能吃? 文 / 李暉 食安與媒體 2010 73 14 科學研習 OCT 2016 No.55-10 本月專題 科學新聞判讀力 1 2 2014 3 53-3 http://www.ntsec.gov.tw/user/ Article.aspx?a=2657 2016 5 目前並沒有充足證據證明基改作物會讓人生病或危害環境 109 Greenpeace
/ 嚇死我了 這些究竟能不能吃?/ 嚇死我了 這些究竟能不能吃? 文 / 李暉 食安與媒體 2010 73 14 科學研習 OCT 2016 No.55-10 本月專題 科學新聞判讀力 1 2 2014 3 53-3 http://www.ntsec.gov.tw/user/ Article.aspx?a=2657 2016 5 目前並沒有充足證據證明基改作物會讓人生病或危害環境 109 Greenpeace
臺北市及死亡率 - 別 ( 續 1)( 修正 ) ( 二 ) 松山區 中華民國 105 年單 : 人 ; 人 / 十萬人 ;% 所有 1, 所有 所有 惡腫瘤 4
 臺北市及死亡率 - 別 ( 修正 ) ( 一 ) 臺北市 中華民國 105 年單 : 人 ; 人 / 十萬人 ;% 所有 18,039 668.05 33.75 100.00 所有 10,369 80.5 44.60 100.00 所有 7,670 544.83 55.48 100.00 1 惡腫瘤 5,19 193.8 105.00 8.93 惡腫瘤,90 5.9 17.78 8.16 惡腫瘤,99
臺北市及死亡率 - 別 ( 修正 ) ( 一 ) 臺北市 中華民國 105 年單 : 人 ; 人 / 十萬人 ;% 所有 18,039 668.05 33.75 100.00 所有 10,369 80.5 44.60 100.00 所有 7,670 544.83 55.48 100.00 1 惡腫瘤 5,19 193.8 105.00 8.93 惡腫瘤,90 5.9 17.78 8.16 惡腫瘤,99
®
 中 草 药 Chinese Traditional and Herbal Drugs 第 45 卷 第 15 期 214 年 8 月 2277 稳 心 颗 粒 治 疗 心 律 失 常 的 Meta 分 析 * 何 颖, 刘 莹, 邹 爱 英 天 津 中 医 药 大 学 第 二 附 属 医 院, 天 津 15 摘 要 : 利 用 Meta 分 析 法 评 价 稳 心 颗 粒 治 疗 心 律 失 常 的
中 草 药 Chinese Traditional and Herbal Drugs 第 45 卷 第 15 期 214 年 8 月 2277 稳 心 颗 粒 治 疗 心 律 失 常 的 Meta 分 析 * 何 颖, 刘 莹, 邹 爱 英 天 津 中 医 药 大 学 第 二 附 属 医 院, 天 津 15 摘 要 : 利 用 Meta 分 析 法 评 价 稳 心 颗 粒 治 疗 心 律 失 常 的
X 傳統育種技術 分子育種技術 基因改良育種
 06 2015 7 511 72 92? 2010? X 傳統育種技術 1960 1980 30 60 20 分子育種技術 5 10 3 5 基因改良育種 2015 7 511 07 改良後的基因及其生產的蛋白質都需經過嚴格的動物及田間生物安全試驗才會上市, 程序就跟新藥一樣 20 基改產品禁得起考驗 12 2013 1.75 50 1 5 1996 80 2013 156 35 21 6 90 08
06 2015 7 511 72 92? 2010? X 傳統育種技術 1960 1980 30 60 20 分子育種技術 5 10 3 5 基因改良育種 2015 7 511 07 改良後的基因及其生產的蛋白質都需經過嚴格的動物及田間生物安全試驗才會上市, 程序就跟新藥一樣 20 基改產品禁得起考驗 12 2013 1.75 50 1 5 1996 80 2013 156 35 21 6 90 08
經 口 服 以 提 升 運 動 表 現 的 物 質 中, 運 動 禁 藥 是 運 動 員 不 得 使 用 的 物 質, 不 在 這 規 範 中 的 則 可 稱 為 營 養 補 充 劑 運 動 營 養 學 的 應 用 4 3 2013 12 492 25
 運 動 員 的 營 養 與 禁 藥 World Anti-doping Agency, WADA 運 動 營 養 學 運 動 員 與 一 般 人 相 同, 為 了 健 康 會 經 口 攝 取 食 物 與 藥 物, 更 進 一 步 則 希 望 藉 此 提 升 運 動 表 現 24 2013 12 492 經 口 服 以 提 升 運 動 表 現 的 物 質 中, 運 動 禁 藥 是 運 動 員 不 得
運 動 員 的 營 養 與 禁 藥 World Anti-doping Agency, WADA 運 動 營 養 學 運 動 員 與 一 般 人 相 同, 為 了 健 康 會 經 口 攝 取 食 物 與 藥 物, 更 進 一 步 則 希 望 藉 此 提 升 運 動 表 現 24 2013 12 492 經 口 服 以 提 升 運 動 表 現 的 物 質 中, 運 動 禁 藥 是 運 動 員 不 得
Middle East Respiratory Syndrome Coronavirus, MERS-CoV WHO Qatar 2013 MERS MERS 耗費巨大的社會成本 MERS V
 54 2015 1 505 新興的中東呼吸症候群 冠狀病毒 Those who cannot remember the past are condemned to repeat it. 忘記過去的人, 注定要重蹈覆轍 2012 4 Zarqa 13 2 2012 9 WHO Middle East Respiratory Syndrome Coronavirus, MERS 11 MERS 9 2
54 2015 1 505 新興的中東呼吸症候群 冠狀病毒 Those who cannot remember the past are condemned to repeat it. 忘記過去的人, 注定要重蹈覆轍 2012 4 Zarqa 13 2 2012 9 WHO Middle East Respiratory Syndrome Coronavirus, MERS 11 MERS 9 2
ment group was more effective than that of the control group OR = % CI = Conclusion The clinical efficacy of Chinese medic
 33 243 HAART Meta * 1 1 1 1 1 2 3 3 3 1. 530001 2. 538000 3. 530011 highly active anti-retroviral therapy HAART Pubmed HAART randomized controlled trials RCT Jadad RevMan5. 3 Meta 5 RCT 761 Meta HAART
33 243 HAART Meta * 1 1 1 1 1 2 3 3 3 1. 530001 2. 538000 3. 530011 highly active anti-retroviral therapy HAART Pubmed HAART randomized controlled trials RCT Jadad RevMan5. 3 Meta 5 RCT 761 Meta HAART
% % % 獨立 廉正 專業 創新
 101 99 102 101 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 99 102 8 4 34 11 101826 594 71.91% 160 19.37% 72 8.72% 101 100 27 18100 21 101 35 獨立 廉正 專業 創新 1. 7,290 8,677 26,180 26,011 1,272 1,346 142 157 7 7 1,757 1,795
101 99 102 101 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 99 102 8 4 34 11 101826 594 71.91% 160 19.37% 72 8.72% 101 100 27 18100 21 101 35 獨立 廉正 專業 創新 1. 7,290 8,677 26,180 26,011 1,272 1,346 142 157 7 7 1,757 1,795
Microsoft PowerPoint - HCV SZ Nov 2015
 司徒伟基 临床助理教授香港大学内科学系 内科顾问医生香港大学深圳医院 Dr. Wai-Kay Seto MBBS MD FRCP FHKCP FHKAM Clinical Assistant Professor The University of Hong Kong, Hong Kong Consultant HKU-Shenzhen Hospital, Shenzhen HBV 与 HCV 的分别
司徒伟基 临床助理教授香港大学内科学系 内科顾问医生香港大学深圳医院 Dr. Wai-Kay Seto MBBS MD FRCP FHKCP FHKAM Clinical Assistant Professor The University of Hong Kong, Hong Kong Consultant HKU-Shenzhen Hospital, Shenzhen HBV 与 HCV 的分别
3. ( 41 ) 1 ( ) ( ) ( ) 2 (a) (b) ( ) 1 2 負責人是指負責處理保險代理人的保險代理業務的人士 業務代表是指代表保險代理人銷售保險產品的人士 如保險代理人聘用上述人士 ( 例如該保險代理人是法人團體 ), 則其負責人及業務代表須向保險代理登記委員會登記 保險代理
 CB(1)1919/04-05(05) ( ) 2. ( ) 40% 50% 3. ( 41 ) 1 ( ) ( ) ( ) 2 (a) (b) ( ) 1 2 負責人是指負責處理保險代理人的保險代理業務的人士 業務代表是指代表保險代理人銷售保險產品的人士 如保險代理人聘用上述人士 ( 例如該保險代理人是法人團體 ), 則其負責人及業務代表須向保險代理登記委員會登記 保險代理登記委員會在決定某人是否適當人選時,
CB(1)1919/04-05(05) ( ) 2. ( ) 40% 50% 3. ( 41 ) 1 ( ) ( ) ( ) 2 (a) (b) ( ) 1 2 負責人是指負責處理保險代理人的保險代理業務的人士 業務代表是指代表保險代理人銷售保險產品的人士 如保險代理人聘用上述人士 ( 例如該保險代理人是法人團體 ), 則其負責人及業務代表須向保險代理登記委員會登記 保險代理登記委員會在決定某人是否適當人選時,
(Microsoft Word - \303\304\260T57-\265\373\305\262\247\357\252\251\245\2731030207.doc)
 :07-8036783 :http://www.kmhk.kmu.edu.tw/medhome/ 中 華 民 國 一 一 年 十 二 月 第 十 五 卷 第 四 期 小 宗 港 醫 院 的 願 發 行 人 吳 文 正 總 編 輯 : 陳 秀 珊 編 輯 群 : 吳 筱 珈 吳 惠 如 林 瑛 鈴 張 秀 美 張 簡 核 麗 心 旨 成 環 提 真 臨 為 最 優 質 的 全 人 照 護 曁 出 版
:07-8036783 :http://www.kmhk.kmu.edu.tw/medhome/ 中 華 民 國 一 一 年 十 二 月 第 十 五 卷 第 四 期 小 宗 港 醫 院 的 願 發 行 人 吳 文 正 總 編 輯 : 陳 秀 珊 編 輯 群 : 吳 筱 珈 吳 惠 如 林 瑛 鈴 張 秀 美 張 簡 核 麗 心 旨 成 環 提 真 臨 為 最 優 質 的 全 人 照 護 曁 出 版
SOP Waiting Time
 專科門診 for Stable New Bookings at Specialist Out-patient Clinics 2017 年 10 月 1 日至 2018 年 9 月 30 日 1 October 2017 30 September 2018 專科門診診所實施分流制度 22201820182018, 確保病情緊急並需要及早診治的病人獲得優先跟進及治療 新轉介個案通常先由護士甄別, 再經有關專科醫生覆核,
專科門診 for Stable New Bookings at Specialist Out-patient Clinics 2017 年 10 月 1 日至 2018 年 9 月 30 日 1 October 2017 30 September 2018 專科門診診所實施分流制度 22201820182018, 確保病情緊急並需要及早診治的病人獲得優先跟進及治療 新轉介個案通常先由護士甄別, 再經有關專科醫生覆核,
本公司(銀行)銷售○○投信「○○基金」所收取之通路報酬如下:
 20180824 版 ( 都柏林 ) 本公司銷售 ( 都柏林 ) 法盛國際系列 法盛 - 盧米斯賽勒斯高收益債券基金 ( 原名稱 : 法儲銀 - 盧米斯賽勒斯高收益債券型基金 )( 本基金主要係投資於非投資等級之高風險債券 ) 所收取之通路報酬如下 : 台端支付的基金申購手續費不多於 2%, 其中本公司收取不多於 2% 台端支付的基金轉換手續費為 0% 二 基金公司 ( 或總代理人 / 境外基金機構
20180824 版 ( 都柏林 ) 本公司銷售 ( 都柏林 ) 法盛國際系列 法盛 - 盧米斯賽勒斯高收益債券基金 ( 原名稱 : 法儲銀 - 盧米斯賽勒斯高收益債券型基金 )( 本基金主要係投資於非投資等級之高風險債券 ) 所收取之通路報酬如下 : 台端支付的基金申購手續費不多於 2%, 其中本公司收取不多於 2% 台端支付的基金轉換手續費為 0% 二 基金公司 ( 或總代理人 / 境外基金機構
 Special Issue 名 人 講 堂 專 題 研 究 保證金收取 合格之擔保品種類為何 非現金擔保品之折扣率 haircut 為何 CCP是否將會員所繳擔保品用於投資 其孳息是否回饋給會員 限制措施 焦 點 視 界 是否對會員之委託金額 信用 部位及風險訂定限額 會員是否必須對其客戶制定限額 洗價 mark-to-market 之時間及方法為何 結算交割 市 場 掃 描 交割週期 T+1或T+3
Special Issue 名 人 講 堂 專 題 研 究 保證金收取 合格之擔保品種類為何 非現金擔保品之折扣率 haircut 為何 CCP是否將會員所繳擔保品用於投資 其孳息是否回饋給會員 限制措施 焦 點 視 界 是否對會員之委託金額 信用 部位及風險訂定限額 會員是否必須對其客戶制定限額 洗價 mark-to-market 之時間及方法為何 結算交割 市 場 掃 描 交割週期 T+1或T+3
2
 2 了 綠 什 (education for the environment)(how to do environmental protection) 4 環境教育只是環保署的事 環保署是環境教育法的中央主管機關 但所有部會均為 中央目的事業主管機關 在環境教育法生效之前 執行與推廣環境教育最力者包 括教育部 農委會 內政部等 5 , (IUCN, 1977) (, 1977) 7 (UNDESD)
2 了 綠 什 (education for the environment)(how to do environmental protection) 4 環境教育只是環保署的事 環保署是環境教育法的中央主管機關 但所有部會均為 中央目的事業主管機關 在環境教育法生效之前 執行與推廣環境教育最力者包 括教育部 農委會 內政部等 5 , (IUCN, 1977) (, 1977) 7 (UNDESD)
 2 3 13 17 22 26 1 2 8 100738 +86 (10) 8508 5000 +86 (10) 8518 5111 www.kpmg.com.cn 2006 4 2002 2006 1 28% 2006 17 8 500 2006 2006 2006 7 2.5 2 1 500 500 40% 500 10 16 14 12 10 8 6 4 2 2002-2006 5.1 5.9
2 3 13 17 22 26 1 2 8 100738 +86 (10) 8508 5000 +86 (10) 8518 5111 www.kpmg.com.cn 2006 4 2002 2006 1 28% 2006 17 8 500 2006 2006 2006 7 2.5 2 1 500 500 40% 500 10 16 14 12 10 8 6 4 2 2002-2006 5.1 5.9
. HBV DNA lgiu /ml respectively. Statistical difference of was found among the 6 groups χ 2 = P < quantification excepti
 51 5 Vol. 51 No. 5 JOURNAL OF SHANDONG UNIVERSITY HEALTH SCIENCES 2013 5 May 2013 1671-7554 2013 05-0094 - 05 DOI 10. 6040 /j. issn. 1671-7554. 2013. 05. 021 HBV DNA 符晓莉, 王磊, 刘峰 / 250033 研究未经抗病毒治疗干预的慢性乙肝病毒
51 5 Vol. 51 No. 5 JOURNAL OF SHANDONG UNIVERSITY HEALTH SCIENCES 2013 5 May 2013 1671-7554 2013 05-0094 - 05 DOI 10. 6040 /j. issn. 1671-7554. 2013. 05. 021 HBV DNA 符晓莉, 王磊, 刘峰 / 250033 研究未经抗病毒治疗干预的慢性乙肝病毒
 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 243,1052,272 791222101452 2014719 58339347 396634355 196413164 28269 26 27 28 29 () () () () () () () () () () () () () () () () () () ()
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 243,1052,272 791222101452 2014719 58339347 396634355 196413164 28269 26 27 28 29 () () () () () () () () () () () () () () () () () () ()
Pegasys_CDS 12.0_1109_0410-PEGA-01_current
 _CDS 0410-PEGA-3A01 注射劑 135 微公克 /0.5 毫升, /0.5 毫升 pre-filled syringes 135 mcg/0.5 ml, 180 mcg/0.5 ml 1. 說明 1.1 治療 / 藥理分類 免疫刺激劑 / 細胞激素 ATC code: L03A B11 1.2 劑型 為一無菌 可立即使用的注射液, 預先充填於注射針筒內, 供皮下注射使用 : 注射針筒裝
_CDS 0410-PEGA-3A01 注射劑 135 微公克 /0.5 毫升, /0.5 毫升 pre-filled syringes 135 mcg/0.5 ml, 180 mcg/0.5 ml 1. 說明 1.1 治療 / 藥理分類 免疫刺激劑 / 細胞激素 ATC code: L03A B11 1.2 劑型 為一無菌 可立即使用的注射液, 預先充填於注射針筒內, 供皮下注射使用 : 注射針筒裝
台資企業在中國大陸的發展 – 十二五規劃的展望
 & CRETA 財團法人商業發展研究院 2011 10 5 ( & ) 2011.10.05 2 1. ( & ) 2011.10.05 3 GDP 1981-2010 13 ( & ) 2011.10.05 4 GDP ( & ) 2011.10.05 5 ( & ) 2011.10.05 6 GDP 1981-2010 GDP GDP 100% ( & ) 2011.10.05 7 ( & )
& CRETA 財團法人商業發展研究院 2011 10 5 ( & ) 2011.10.05 2 1. ( & ) 2011.10.05 3 GDP 1981-2010 13 ( & ) 2011.10.05 4 GDP ( & ) 2011.10.05 5 ( & ) 2011.10.05 6 GDP 1981-2010 GDP GDP 100% ( & ) 2011.10.05 7 ( & )
中期 12 中期 % 報告期 報告 44 中期 報 年中期報告 中國鋁業股份有限公司
 2016 2016 6 30 6 2016 2016 www.hkex.com.hk www.chalco.com.cn 2 6 8 10 中期 12 中期 12 13 16 22 25 26 27 5% 28 29 29 報告期 29 30 31 31 31 32 35 35 36 38 報告 44 中期 報 46 1 2016 年中期報告 中國鋁業股份有限公司 1. ALUMINUM CORPORATION
2016 2016 6 30 6 2016 2016 www.hkex.com.hk www.chalco.com.cn 2 6 8 10 中期 12 中期 12 13 16 22 25 26 27 5% 28 29 29 報告期 29 30 31 31 31 32 35 35 36 38 報告 44 中期 報 46 1 2016 年中期報告 中國鋁業股份有限公司 1. ALUMINUM CORPORATION
10 中央銀行季刊第三十一卷第一期民國 98 年 3 月 0.84% 1.73% 25.6% GDP 1.52% 0.44% 29.37% 0.90% 2.18% (4) a b c d e f 壹 前言 2004 (WTI) % 200
 能源價格波動對國內物價與經濟活動的影響 9 * 能源價格波動對國內物價與經濟活動的影響 ** 梁啟源 摘 要 (1) (2) (1) 2004~2008 a b c d (2) OPEC 2008 30 30~80 (3) 13% GDP 0.88% 0.34% 12.42% * ** 10 中央銀行季刊第三十一卷第一期民國 98 年 3 月 0.84% 1.73% 25.6% GDP 1.52%
能源價格波動對國內物價與經濟活動的影響 9 * 能源價格波動對國內物價與經濟活動的影響 ** 梁啟源 摘 要 (1) (2) (1) 2004~2008 a b c d (2) OPEC 2008 30 30~80 (3) 13% GDP 0.88% 0.34% 12.42% * ** 10 中央銀行季刊第三十一卷第一期民國 98 年 3 月 0.84% 1.73% 25.6% GDP 1.52%
理性真的普遍嗎 注意力的爭奪戰 科學發展 2012 年 12 月,480 期 13
 12 科學發展 2012 年 12 月,480 期 你可能不知道的媒體影響 劉正山若用 選戰 的角度來看選舉和參與選舉, 你大腦裡情感的作用一定大過理性的作用, 便會很習慣地拿各種媒體或別人的觀點來使自己的選擇合理化 2012 理性真的普遍嗎 注意力的爭奪戰 科學發展 2012 年 12 月,480 期 13 14 科學發展 2012 年 12 月,480 期 agendasetting 報紙和網路新聞的頭版空間有限,
12 科學發展 2012 年 12 月,480 期 你可能不知道的媒體影響 劉正山若用 選戰 的角度來看選舉和參與選舉, 你大腦裡情感的作用一定大過理性的作用, 便會很習慣地拿各種媒體或別人的觀點來使自己的選擇合理化 2012 理性真的普遍嗎 注意力的爭奪戰 科學發展 2012 年 12 月,480 期 13 14 科學發展 2012 年 12 月,480 期 agendasetting 報紙和網路新聞的頭版空間有限,
婴幼儿护理(六).doc
 ...1...1...2...5...9...12...14...16...20...21...25...28 17...32...38...41...42...43...44...45 I II...46...47...48...49 3...49...51...51...52...53...53...56...58...61...64 1...65...66...72 4...73...76...78...80
...1...1...2...5...9...12...14...16...20...21...25...28 17...32...38...41...42...43...44...45 I II...46...47...48...49 3...49...51...51...52...53...53...56...58...61...64 1...65...66...72 4...73...76...78...80
... 03... 10 2... 15...20... 26... 30... 34
 99 ... 03... 10 2... 15...20... 26... 30... 34 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 認知概念發展教具 概念類 1. 理解概念 2. 空間概念 3. 速度概念 4. 專注力 5. 記憶力 6. 數概念 理解概念 空間概念 認知概念發展教具
99 ... 03... 10 2... 15...20... 26... 30... 34 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 認知概念發展教具 概念類 1. 理解概念 2. 空間概念 3. 速度概念 4. 專注力 5. 記憶力 6. 數概念 理解概念 空間概念 認知概念發展教具
完全照護手冊
 20 13.6 9.910 17.8 13.3 20 1996 () 1. 2. 1998 20012000 2014 0800-507272 5 55% 30.1% 16.9% 40.7% 25.3%13.2 72.5%30-6012.1% 3015.4%60 60.8%22.3% 45 2013 3700 37.4% 2-319.8%121 0800-507272 1421 11 5 70% 7
20 13.6 9.910 17.8 13.3 20 1996 () 1. 2. 1998 20012000 2014 0800-507272 5 55% 30.1% 16.9% 40.7% 25.3%13.2 72.5%30-6012.1% 3015.4%60 60.8%22.3% 45 2013 3700 37.4% 2-319.8%121 0800-507272 1421 11 5 70% 7
目錄
 2014 年度 企業社會責任報告 目錄 1 4 2 5 3 7 3.1 7 3.2 8 3.3 8 4 9 4.1 9 4.2 2014 10 4.3 11 5 16 5.1 16 5.2 18 5.3 20 5.4 21 6 22 6.1 22 6.2 23 6.3 24 6.4 25 6.5 26 6.6 27 6.7 27 6.8 27 7 28 7.1 28 7.2 29 7.3 30 7.4
2014 年度 企業社會責任報告 目錄 1 4 2 5 3 7 3.1 7 3.2 8 3.3 8 4 9 4.1 9 4.2 2014 10 4.3 11 5 16 5.1 16 5.2 18 5.3 20 5.4 21 6 22 6.1 22 6.2 23 6.3 24 6.4 25 6.5 26 6.6 27 6.7 27 6.8 27 7 28 7.1 28 7.2 29 7.3 30 7.4
Microsoft Word - Tridentine NL_C.docx
 聖人慶日及節日 五月十一日 聖斐理伯與聖雅各伯 宗徒 慶日 五月二十九日 耶穌升天 節日 五月三十一日 聖母天地元后 慶日 文章分享 淺談拉丁文在天主教會的重要性 緒論 一直以來 教會拉丁語被視為西方文化之基石和羅馬天主教會的官方語言 可是在 近四十年來 這種 天主教徒的特徵 (sensus catholicus) 已從教會禮儀 信友靈修生活 等逐漸褪色 這現象當然與人們 甚至神長和教會機構對拉丁語應用之誤解有關
聖人慶日及節日 五月十一日 聖斐理伯與聖雅各伯 宗徒 慶日 五月二十九日 耶穌升天 節日 五月三十一日 聖母天地元后 慶日 文章分享 淺談拉丁文在天主教會的重要性 緒論 一直以來 教會拉丁語被視為西方文化之基石和羅馬天主教會的官方語言 可是在 近四十年來 這種 天主教徒的特徵 (sensus catholicus) 已從教會禮儀 信友靈修生活 等逐漸褪色 這現象當然與人們 甚至神長和教會機構對拉丁語應用之誤解有關
Chapter 3 Camera Raw Step negative clarity +25 ] P / Step 4 0 ( 下一頁 ) Camera Raw Chapter 3 089
![Chapter 3 Camera Raw Step negative clarity +25 ] P / Step 4 0 ( 下一頁 ) Camera Raw Chapter 3 089 Chapter 3 Camera Raw Step negative clarity +25 ] P / Step 4 0 ( 下一頁 ) Camera Raw Chapter 3 089](/thumbs/50/27027900.jpg) Photoshop CC Camera Raw Photoshop Camera Raw Step 1 3 1 2 3 SCOTT KELBY Step 2 B Camera Raw 088 Chapter 3 Camera Raw Chapter 3 Camera Raw Step 3-4 -100 negative clarity +25 ] P / -75-50 Step 4 0 ( 下一頁
Photoshop CC Camera Raw Photoshop Camera Raw Step 1 3 1 2 3 SCOTT KELBY Step 2 B Camera Raw 088 Chapter 3 Camera Raw Chapter 3 Camera Raw Step 3-4 -100 negative clarity +25 ] P / -75-50 Step 4 0 ( 下一頁
 第一篇文概說第七章公文的用語及標點符號公本篇內容 第一章 緒論 第二章 公文的意義 第三章 公文與高 普 特各類考試 第四章 公文程式之意義及演變 第五章 公文之分類及其行文系統 第六章 公文之結構與行款 第一篇 第一章緒論 003 第一章緒論 等 等 004 最新應用公文 第一篇 第二章公文的意義 005 第二章公文的意義 第一節 一 須為公務員製作之文書 二 須為公務員 職務上 製作之文書 006
第一篇文概說第七章公文的用語及標點符號公本篇內容 第一章 緒論 第二章 公文的意義 第三章 公文與高 普 特各類考試 第四章 公文程式之意義及演變 第五章 公文之分類及其行文系統 第六章 公文之結構與行款 第一篇 第一章緒論 003 第一章緒論 等 等 004 最新應用公文 第一篇 第二章公文的意義 005 第二章公文的意義 第一節 一 須為公務員製作之文書 二 須為公務員 職務上 製作之文書 006
94 Powerlessness of Fulminant Hepatic Failure powerlessness McFarland & McFarlane, 1997/2009 我 還 能 做 什 麼? 做 這 個 有 用 嗎? 我 覺 得 好 無 力! power 2006 Harden
 93 一 位 猛 爆 性 肝 衰 竭 病 人 面 對 無 力 感 之 護 理 經 驗 陳 蘊 珩 楊 惠 玲 * 摘 要 : 本 文 描 述 一 位 病 毒 性 肝 炎 急 性 發 作 導 致 猛 爆 性 肝 衰 竭 病 人, 因 疾 病 過 程 的 無 法 預 測 產 生 無 力 感 之 護 理 經 驗, 護 理 期 間 自 2007 年 11 月 13 日 至 2008 年 1 月 17 日 筆
93 一 位 猛 爆 性 肝 衰 竭 病 人 面 對 無 力 感 之 護 理 經 驗 陳 蘊 珩 楊 惠 玲 * 摘 要 : 本 文 描 述 一 位 病 毒 性 肝 炎 急 性 發 作 導 致 猛 爆 性 肝 衰 竭 病 人, 因 疾 病 過 程 的 無 法 預 測 產 生 無 力 感 之 護 理 經 驗, 護 理 期 間 自 2007 年 11 月 13 日 至 2008 年 1 月 17 日 筆
近幾年來, 更有許多新的標靶治療的小分子藥品問世, 包括作用於 B 細胞內訊息傳遞之 Bruton s tyrosine kinase (BTK) inhibitor ( 例如 :ibrutinib); 作用於 B 細胞的 BCL-2 inhibitor ( 例如 :venetoclax) 等, 此
 慢性淋巴性白血病新治療 1 賴怡雯 前言 慢性淋巴球性白血病 (chronic lymphocytic leukemia, CLL) 為骨髓內淋巴球異常增生 之惡性疾病 臨床上對於白血病 / 血癌, 依照病程分成急性 (acute) 慢性 (chronic), 依照 細胞種類分成淋巴性 (lymphoid) 與骨髓性 (myeloid), 故可大致區分成四大類型 慢性淋 巴性白血病即為白血病 / 血癌四大類型之一,
慢性淋巴性白血病新治療 1 賴怡雯 前言 慢性淋巴球性白血病 (chronic lymphocytic leukemia, CLL) 為骨髓內淋巴球異常增生 之惡性疾病 臨床上對於白血病 / 血癌, 依照病程分成急性 (acute) 慢性 (chronic), 依照 細胞種類分成淋巴性 (lymphoid) 與骨髓性 (myeloid), 故可大致區分成四大類型 慢性淋 巴性白血病即為白血病 / 血癌四大類型之一,
香港聯合交易所有限公司 ( 聯交所 )GEM 的特色 GEM 的定位, 乃為中小型公司提供一個上市的市場, 此等公司相比起其他在主板上市的公司帶有較高投資風險 有意投資的人士應了解投資於該等公司的潛在風險, 並應經過審慎周詳的考慮後方作出投資決定 由於 GEM 上市公司普遍為中小型公司, 在 GEM
 KING FORCE GROUP HOLDINGS LIMITED 冠輝集團控股有限公司 ( 股份代號 :08315) 截至二零一八年三月三十一日止年度的年度業績公佈 本公司 董事 董事會 聯交所 GEM GEM www.hkexnews.hk www.kingforce.com.hk 冠輝集團控股有限公司 陳運逴 GEMGEM www.hkexnews.hk www.kingforce.com.hk
KING FORCE GROUP HOLDINGS LIMITED 冠輝集團控股有限公司 ( 股份代號 :08315) 截至二零一八年三月三十一日止年度的年度業績公佈 本公司 董事 董事會 聯交所 GEM GEM www.hkexnews.hk www.kingforce.com.hk 冠輝集團控股有限公司 陳運逴 GEMGEM www.hkexnews.hk www.kingforce.com.hk
丙型肝炎治疗进展及临床-实验室沟通(南月敏) [兼容模式]
![丙型肝炎治疗进展及临床-实验室沟通(南月敏) [兼容模式] 丙型肝炎治疗进展及临床-实验室沟通(南月敏) [兼容模式]](/thumbs/41/22641217.jpg) 丙 型 肝 炎 诊 疗 进 展 实 验 室 检 查 是 临 床 诊 疗 的 基 石 南 月 敏 教 授 博 士 生 导 师 河 北 省 医 学 会 肝 病 学 分 会 河 北 医 科 大 学 第 三 医 院 中 西 医 结 合 肝 病 科 全 球 HCV 感 染 状 况 1.7 亿 人 感 染 HCV(3%) 美 洲 1310 万 (1.7%) 欧 洲 890 万 (1.03%) 非 洲 3190
丙 型 肝 炎 诊 疗 进 展 实 验 室 检 查 是 临 床 诊 疗 的 基 石 南 月 敏 教 授 博 士 生 导 师 河 北 省 医 学 会 肝 病 学 分 会 河 北 医 科 大 学 第 三 医 院 中 西 医 结 合 肝 病 科 全 球 HCV 感 染 状 况 1.7 亿 人 感 染 HCV(3%) 美 洲 1310 万 (1.7%) 欧 洲 890 万 (1.03%) 非 洲 3190
本報告經文獻查詢到 1 篇 ixekizumab 與 secukinumab 的間接比較結果, 但統計結果 (PASI 75 PASI 90 及 PASI 100) 會因為共同參考品 (etanercept ustekinumab, 或合 併分析 ) 風險統計量 (RD 或 OR), 以及分析方法而
 財團法人醫藥品查驗中心 Center For Drug Evaluation 達癬治注射劑 (Taltz ) 醫療科技評估報告 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱 達癬治注射劑 成分 ixekizumab 建議者 台灣禮來股份有限公司 藥品許可證持有商 同上 含量規格劑型 Ixekizumab 80 mg / 注射劑 主管機關許可適應症 治療適合接受全身性治療的中至重度斑塊性乾癬之成人患者
財團法人醫藥品查驗中心 Center For Drug Evaluation 達癬治注射劑 (Taltz ) 醫療科技評估報告 藥物納入全民健康保險給付建議書 - 藥品專用 資料摘要 藥品名稱 達癬治注射劑 成分 ixekizumab 建議者 台灣禮來股份有限公司 藥品許可證持有商 同上 含量規格劑型 Ixekizumab 80 mg / 注射劑 主管機關許可適應症 治療適合接受全身性治療的中至重度斑塊性乾癬之成人患者
子學習3 電子學習的定位 傳統電子學習 與 新世代電子學習 SAMS 台上講者從左至右 : 吳薇薇女士 羅陸慧英教授 佘孟先生 李芳樂教授 從 電子銀行服務 到 電子學習 題追3 專蹤電
 鄭燕祥教授演講座座無虛席專題追蹤電子學習電子學習如何提升 學與教 模式? 學與教博覽 2010 論壇直擊報道 整理 : 蘇家輝 2 學與教博覽 2010 於本年 7 月 15 日至 17 日假灣仔會議展覽中心舉行, 其中 電子學習提升 學與教 模式 論壇邀請了多位學者 專家和官員就相關話題發表意見, 當中不乏具啟發性的觀點, 值得老師參考和細思 子學習3 電子學習的定位 傳統電子學習 與 新世代電子學習
鄭燕祥教授演講座座無虛席專題追蹤電子學習電子學習如何提升 學與教 模式? 學與教博覽 2010 論壇直擊報道 整理 : 蘇家輝 2 學與教博覽 2010 於本年 7 月 15 日至 17 日假灣仔會議展覽中心舉行, 其中 電子學習提升 學與教 模式 論壇邀請了多位學者 專家和官員就相關話題發表意見, 當中不乏具啟發性的觀點, 值得老師參考和細思 子學習3 電子學習的定位 傳統電子學習 與 新世代電子學習
 2010/03 1. 2. 3. .. . 14 * (Certification) Certification) 1. 2. 3. ( 5~15%) 4. 5. 20% 企業看證照 具加分效果 機械專業證照至今已獲得120家機械相關企業的認同與支持 企業表達認同的具體作法包含 給予獲證考生優先面試的機會 運用此認證 作為公司招募員工時確保所錄取之新 人基本能力的方式 鼓勵員工報考 提升專業能力
2010/03 1. 2. 3. .. . 14 * (Certification) Certification) 1. 2. 3. ( 5~15%) 4. 5. 20% 企業看證照 具加分效果 機械專業證照至今已獲得120家機械相關企業的認同與支持 企業表達認同的具體作法包含 給予獲證考生優先面試的機會 運用此認證 作為公司招募員工時確保所錄取之新 人基本能力的方式 鼓勵員工報考 提升專業能力
貳 肆 公司治理報告 一 組織系統 ( 一 ) 組織結構 ( 二 ) 組織系統圖 14 中華民國 98 年中華郵政年報
 14 16 24 30 24 25 26 26 27 27 28 29 29 一 組織系統二 董事 監察人 總經理 副總經理 各部門及分支機構主管資料三 公司治理運作情形 ( 一 ) 董事會運作情形 ( 二 ) 公司治理運作情形及其與上市上櫃公司治理實務守則差異情形及原因 ( 三 ) 揭露公司治理守則及相關規章之查詢方式 ( 四 ) 揭露其他足以增進對公司治理運作情形瞭解之重要資訊 ( 五 ) 內部控制制度執行狀況
14 16 24 30 24 25 26 26 27 27 28 29 29 一 組織系統二 董事 監察人 總經理 副總經理 各部門及分支機構主管資料三 公司治理運作情形 ( 一 ) 董事會運作情形 ( 二 ) 公司治理運作情形及其與上市上櫃公司治理實務守則差異情形及原因 ( 三 ) 揭露公司治理守則及相關規章之查詢方式 ( 四 ) 揭露其他足以增進對公司治理運作情形瞭解之重要資訊 ( 五 ) 內部控制制度執行狀況
100 年華僑經濟年鑑 2011 華僑經濟年鑑 IT % % % % % WEF
 壹 總論 五 美洲地區經濟總論 ( 一 ) 美洲地區總體經濟情勢分析與展望 North American Free Trade Agreement, NAFTA CUSFTA IMD DR-CAFTA - U.S.-CAFTA-DRFTAALADI 2011 2011 WEF 2011 1 5 2012 1 2011 9.0% 3.5% 2011 3.2% 2010 1.6% 2011 WEF 10
壹 總論 五 美洲地區經濟總論 ( 一 ) 美洲地區總體經濟情勢分析與展望 North American Free Trade Agreement, NAFTA CUSFTA IMD DR-CAFTA - U.S.-CAFTA-DRFTAALADI 2011 2011 WEF 2011 1 5 2012 1 2011 9.0% 3.5% 2011 3.2% 2010 1.6% 2011 WEF 10
一、行政摘要
 2001 12 8-12 5 8522686 1905 prigen@hkpri.org.hk 8522648 4303 http://www.hkpri.org.hk 1...1 1.1...1 1.2...1 1.3...2 2...3 2.1...3 2.2...3 2.3...6 2.4...10 2.5...12 2.6...13 3...15 3.1...15 3.2...15 3.3...21
2001 12 8-12 5 8522686 1905 prigen@hkpri.org.hk 8522648 4303 http://www.hkpri.org.hk 1...1 1.1...1 1.2...1 1.3...2 2...3 2.1...3 2.2...3 2.3...6 2.4...10 2.5...12 2.6...13 3...15 3.1...15 3.2...15 3.3...21
untitled
 169 [ ] spatial uneven events (GIS) (spatial correlations) (spatial statistics) (Croner et al., 2; Aziz et al., 212; Shafie 211) (point pattern analysis) (clustering patterns) (Maheswan and Haining, 24)
169 [ ] spatial uneven events (GIS) (spatial correlations) (spatial statistics) (Croner et al., 2; Aziz et al., 212; Shafie 211) (point pattern analysis) (clustering patterns) (Maheswan and Haining, 24)
1 2 3 7 10 14 20 30 31 32 41 2012/13 43 47 48 51 53 GRI 55 62 2012/13
 合 和 同 心 共 創 可 持 續 發 展 2012/13 年 度 可 持 續 發 展 報 告 1 2 3 7 10 14 20 30 31 32 41 2012/13 43 47 48 51 53 GRI 55 62 2012/13 http://www.hopewellholdings.com/zh-hk/corporate-sustainability/sustainability-report
合 和 同 心 共 創 可 持 續 發 展 2012/13 年 度 可 持 續 發 展 報 告 1 2 3 7 10 14 20 30 31 32 41 2012/13 43 47 48 51 53 GRI 55 62 2012/13 http://www.hopewellholdings.com/zh-hk/corporate-sustainability/sustainability-report
財金資訊-82期.indd
 / ( ) ( ) (waterfall model) (spiral model) 1 (output) (input) 1 www.fisc.com.tw 27 Barry Boehm 1988 2 (prototype) (agile) 2 ( ) 3 3 ( ) 28 / No.82 / 2015.04 (software testing) (peer review) ( ) V ( 4 )
/ ( ) ( ) (waterfall model) (spiral model) 1 (output) (input) 1 www.fisc.com.tw 27 Barry Boehm 1988 2 (prototype) (agile) 2 ( ) 3 3 ( ) 28 / No.82 / 2015.04 (software testing) (peer review) ( ) V ( 4 )
Microsoft PowerPoint - SAGE 2010
 SAGE Journals Online -Communication Studies 大綱 SAGE 簡介 Communication Studies 收錄內容 SJO 平台功能介紹 首頁 瀏覽功能 檢索功能 進階服務 SAGE Content 超過 520 種人文 社會科學 理工 科技領域電子期刊 SAGE 與超過 245 個國際知名的學會合作 ( 包括 American Sociological
SAGE Journals Online -Communication Studies 大綱 SAGE 簡介 Communication Studies 收錄內容 SJO 平台功能介紹 首頁 瀏覽功能 檢索功能 進階服務 SAGE Content 超過 520 種人文 社會科學 理工 科技領域電子期刊 SAGE 與超過 245 個國際知名的學會合作 ( 包括 American Sociological
超捷國際物流股份有限公司
 您的查詢條件為 : 分公司 : 超捷國際物流股份有限公司 高雄 - 高雄出發地 : 高雄港 到達港口 : 香港 出發地到達港口結關日預定開航日預定抵達日運輸時間船名航次船公司碼頭注意事項 Departure Destination Closing ETD Day ETA Transit VesselVoyage Time VoyageCarrierTerminal Remark Keelung Keelung
您的查詢條件為 : 分公司 : 超捷國際物流股份有限公司 高雄 - 高雄出發地 : 高雄港 到達港口 : 香港 出發地到達港口結關日預定開航日預定抵達日運輸時間船名航次船公司碼頭注意事項 Departure Destination Closing ETD Day ETA Transit VesselVoyage Time VoyageCarrierTerminal Remark Keelung Keelung
或 6 NS5A 抑制劑 1 ; 未曾接受 NS3/4A 蛋白酶抑制劑 (PI) 治療 NS3/4A 蛋白酶抑制劑 (PI) 2 ; 未曾接受 NS5A 抑制劑治療 16 週 16 週 12 週 12 週 PRS 3 8 週 12 週 3 PRS 3 16 週 16 週 1. 在
 艾百樂膜衣錠 100 毫克 /40 毫克 (Maviret Film-Coated Tablets 100mg/40mg) 本藥須由醫師處方使用 衛部藥輸字第 027323 號 1 適應症 MAVIRET 適用於治療成人慢性 C 型肝炎病毒 (HCV) 基因型 1 2 3 4 5 或 6 之感染 [ 參見 用法用量 (2.2) 及 臨床試驗 (14) ] 2 用法用量 2.1 開始治療前的檢驗 在開始使用
艾百樂膜衣錠 100 毫克 /40 毫克 (Maviret Film-Coated Tablets 100mg/40mg) 本藥須由醫師處方使用 衛部藥輸字第 027323 號 1 適應症 MAVIRET 適用於治療成人慢性 C 型肝炎病毒 (HCV) 基因型 1 2 3 4 5 或 6 之感染 [ 參見 用法用量 (2.2) 及 臨床試驗 (14) ] 2 用法用量 2.1 開始治療前的檢驗 在開始使用
63 Equifax Experian TransUnion FICO 3 FICO FICO 620 叁 次級房貸歷史淵源 一 次級房貸市場快速擴張的主因 ,
 62 / 壹 前言 Subprime Mortgage 2007 1999 貳 次級房貸的意義 一 以授信的角度 2 3 二 信用評等的角度 FICO 620 FICO Fair Isaac Corporation 35 15 30 10 10 5 300 850 63 Equifax Experian TransUnion FICO 3 FICO FICO 620 叁 次級房貸歷史淵源 一 次級房貸市場快速擴張的主因
62 / 壹 前言 Subprime Mortgage 2007 1999 貳 次級房貸的意義 一 以授信的角度 2 3 二 信用評等的角度 FICO 620 FICO Fair Isaac Corporation 35 15 30 10 10 5 300 850 63 Equifax Experian TransUnion FICO 3 FICO FICO 620 叁 次級房貸歷史淵源 一 次級房貸市場快速擴張的主因
29
 85 年 ~97 年科技計畫 http://sta.epa.gov.tw/report/project.htm Page 1 of 1 2012/5/17 計畫編號 NSC88-EPA-AP640-P01 年度民國 88 年 計畫名稱空氣污染對不同社會階層的影響 - 呼吸道疾病成因的社會學分析 計畫主持人曾敏傑 計畫領域空保處 主辦機關行政院環境保護署 受委託單位中正大學勞工研究所 空氣污染已被證實為呼吸道疾病主要的原因之一,
85 年 ~97 年科技計畫 http://sta.epa.gov.tw/report/project.htm Page 1 of 1 2012/5/17 計畫編號 NSC88-EPA-AP640-P01 年度民國 88 年 計畫名稱空氣污染對不同社會階層的影響 - 呼吸道疾病成因的社會學分析 計畫主持人曾敏傑 計畫領域空保處 主辦機關行政院環境保護署 受委託單位中正大學勞工研究所 空氣污染已被證實為呼吸道疾病主要的原因之一,
, 2
 1 , 2 P.2 HIV P.4 P.5-P.6 P.7 P.8 P.9-P.12 P.13-P.15 P.16 P.17-P.18 P.19-P.23 P.24-P.25 P.26-P.27 P.28-P.35 P.36 P.37 3 HIV Human Immunodeficiency Virus HIV HIV CD40 4 愛滋病的正確名稱是 後天免疫力 缺乏症 Acquired Immune
1 , 2 P.2 HIV P.4 P.5-P.6 P.7 P.8 P.9-P.12 P.13-P.15 P.16 P.17-P.18 P.19-P.23 P.24-P.25 P.26-P.27 P.28-P.35 P.36 P.37 3 HIV Human Immunodeficiency Virus HIV HIV CD40 4 愛滋病的正確名稱是 後天免疫力 缺乏症 Acquired Immune
