什么是蛋白质? 蛋白质 (protein) 是由许多氨基酸 (amino acids) 通过肽键 (peptide bond) 相连 形成的高分子含氮化合物
|
|
|
- 儡榔 明
- 7 years ago
- Views:
Transcription
1 第 1 章 蛋白质的结构与功能 Structure and Function of Protein
2 什么是蛋白质? 蛋白质 (protein) 是由许多氨基酸 (amino acids) 通过肽键 (peptide bond) 相连 形成的高分子含氮化合物
3 蛋白质研究的历史 1833 年, 从麦芽中分离淀粉酶 ; 随后从胃液中分离 到类似胃蛋白酶的物质 1864 年, 血红蛋白被分离并结晶 19 世纪末, 证明蛋白质由氨基酸组成, 并合成了多种短肽 20 世纪初, 发现蛋白质的二级结构 ; 完成胰岛素一级结构测定
4 20 世纪中叶, 各种蛋白质分析技术相继建立, 促进了蛋白质研究迅速发展 ; 1962 年, 确定了血红蛋白的四级结构 20 世纪 90 年代, 功能基因组与蛋白质组研究地展开
5 蛋白质的生物学重要性 1. 蛋白质是生物体重要组成成分分布广 : 所有器官 组织都含有蛋白质 ; 细胞的各个部分都含有蛋白质 含量高 : 蛋白质是细胞内最丰富的有机分子, 占人体干重的 45%, 某些组织含量更高, 例如脾 肺及横纹肌等高达 80%
6 2. 蛋白质具有重要的生物学功能 作为生物催化剂 ( 酶 ) 代谢调节作用 免疫保护作用 物质的转运和存储 运动与支持作用 参与细胞间信息传递 3. 氧化供能
7 第一节 蛋白质的分子组成 The Molecular Component of Protein
8 组成蛋白质的元素 主要有 C H O N 和 S 有些蛋白质含有少量磷或金属元素铁 铜 锌 锰 钴 钼, 个别蛋白质还含有碘
9 蛋白质元素组成的特点各种蛋白质的含氮量很接近, 平均为 16% 由于体内的含氮物质以蛋白质为主, 因此, 只要测定生物样品中的含氮量, 就可以根据以下公式推算出蛋白质的大致含量 : 100 克样品中蛋白质的含量 (g %) = 每克样品含氮克数 /16%
10 一 组成人体蛋白质的 20 种氨基酸 均属于 L α 氨基酸 存在自然界中的氨基酸有 300 余种, 但 组成人体蛋白质的氨基酸仅有 20 种, 且均 属 L- 氨基酸 ( 甘氨酸除外 )
11 C OO R H CH3 C + NH 3 H 甘氨酸丙氨酸 L- 氨基酸的通式
12 二 氨基酸可根据侧链结构和理化性质 进行分类 非极性脂肪族氨基酸 极性中性氨基酸 芳香族氨基酸 酸性氨基酸 碱性氨基酸
13 ( 一 ) 侧链含烃链的氨基酸属于非极性脂肪族氨基酸
14 ( 二 ) 侧链有极性但不带电荷的氨基酸是极性中性氨基酸
15 ( 三 ) 侧链含芳香基团的氨基酸是芳香族氨基酸
16 ( 四 ) 侧链含负性解离基团的氨基酸是酸性氨基酸
17 ( 五 ) 侧链含正性解离基团的氨基酸属于碱性氨基酸
18 几种特殊氨基酸 脯氨酸 ( 亚氨基酸 ) CH 2 CHCOO CH 2 NH + 2 CH 2
19 半胱氨酸 OOC CH CH 2 SH + HS CH 2 CH COO + NH 3 + NH 3 HH + NH 3 OOC CH CH 2 S S CH 2 CH COO + NH 3 + NH 3 二硫键 胱氨酸
20 三 20 种氨基酸具有共同或特异的理化性质 ( 一 ) 氨基酸具有两性解离的性质 两性解离及等电点 氨基酸是两性电解质, 其解离程度取决于所处溶液的酸碱度 等电点 (isoelectric point, pi) 在某一 ph 的溶液中, 氨基酸解离成阳离子和 阴离子的趋势及程度相等, 成为兼性离子, 呈电 中性 此时溶液的 ph 值称为该氨基酸的等电点
21 R CH COOH NH 2 R CH COOH NH + 3 +OH +H + R CH COO NH + 3 +OH +H + R CH COO NH 2 ph<pi ph=pi ph>pi 阳离子 氨基酸的兼性离子 阴离子
22 ( 二 ) 含共轭双键的氨基酸具有紫外吸收性质 色氨酸 酪氨酸的最大吸收峰在 280 nm 附近 大多数蛋白质含有 这两种氨基酸残基, 所 以测定蛋白质溶液 280nm 的光吸收值是分 析溶液中蛋白质含量的 快速简便的方法 芳香族氨基酸的紫外吸收
23 ( 三 ) 氨基酸与茚三酮反应生成蓝紫色化合物 氨基酸与茚三酮水合物共热, 可生成蓝紫色化合物, 其最大吸收峰在 570nm 处 由于此吸收峰值与氨基酸的含量存在正比关系, 因此可作为氨基酸定量分析方法
24 四 蛋白质是由许多氨基酸残基组成 的多肽链 ( 一 ) 氨基酸通过肽键连接而形成肽 (peptide) 肽键 (peptide bond) 是由一个氨基酸的 α- 羧基与另一个氨基酸的 α- 氨基脱水缩合而形成 的化学键
25 O NH 2 CH C H 甘氨酸 + OH O NH CH C H H 甘氨酸 OH HOH O O NH 2 CH C N CH C H H H OH 肽键 甘氨酰甘氨酸
26 肽是由氨基酸通过肽键缩合而形成的化合物 两分子氨基酸缩合形成二肽, 三分子氨基酸缩合则形成三肽 由十个以内氨基酸相连而成的肽称为寡肽 (oligopeptide), 由更多的氨基酸相连形成的肽称多肽 (polypeptide) 肽链中的氨基酸分子因为脱水缩合而基团不全, 被称为氨基酸残基 (residue)
27 多肽链 (polypeptide chain) 是指许多氨 基酸之间以肽键连接而成的一种结构 多肽链有两端 : N 末端 : 多肽链中有游离 α 氨基的一端 C 末端 : 多肽链中有游离 α 羧基的一端
28 N 末端 C 末端 牛核糖核酸酶
29 ( 二 ) 体内存在多种重要的生物活性肽 1. 谷胱甘肽 (glutathione, GSH)
30 GSH 与 GSSG 间的转换 H 2 O 2 2GSH GSH 过氧化物酶 NADP + GSH 还原酶 2H 2 O GSSG NADPH+H +
31 2. 多肽类激素及神经肽 体内许多激素属寡肽或多肽 神经肽 (neuropeptide)
32 第二节 蛋白质的分子结构 The Molecular Structure of Protein
33 蛋白质的分子结构包括 : 一级结构 (primary structure) 二级结构 (secondary structure) 三级结构 (tertiary structure) 四级结构 (quaternary structure) 高级结构
34
35 一 氨基酸的排列顺序决定蛋白质的一级结构 定义 : 蛋白质的一级结构指在蛋白质分子从 N 端至 C 端的氨基酸排列顺序 主要的化学键 : 肽键, 有些蛋白质还包括二硫键
36 一级结构是蛋白质空间构象和特异生物学功能的基础, 但不是决定蛋白质空间构象的唯一因素
37
38 (1) 组成蛋白质的多肽链数目. (2) 多肽链的氨基酸顺序, (3) 多肽链内或链间二硫键的数目和位置 其中最重要的是多肽链的氨基酸顺序, 它 是蛋白质生物功能的基础
39 二 多肽链的局部主链构象为蛋白质 定义 : 二级结构 蛋白质分子中某一段肽链的局部空间 结构, 即该段肽链主链骨架原子的相对空 间位置, 并不涉及氨基酸残基侧链的构 象 主要的化学键 : 氢键
40 ( 一 ) 参与肽键形成的 6 个原子在同一平面上 参与肽键的 6 个原子 C α1 C O N H C α2 位于同一平 面,C α1 和 C α2 在平面上所处的位置为反式 (trans) 构型, 此同 一平面上的 6 个原子构成了所谓的肽单元 (peptide unit)
41 ( 一 ) 参与肽键形成的 6 个原子在同一平面上 参与肽键的 6 个原子 C α1 C O N H C α2 位于同一平面,C α1 和 C α2 在平面上所处的位置为反式 (trans) 构型, 此同一平面上的 6 个原子构成了所谓的肽单元 (peptide unit)
42 多肽链可以看成由 Cα 串联起来的无数个酰胺平面组成
43 ( 二 )α- 螺旋结构是常见的蛋白质二级结构 蛋白质二级结构 α- 螺旋 (α helix) β- 折叠 (β pleated sheet) β- 转角 (β turn) 无规卷曲 (random coil)
44 α- 螺旋
45 1 多肽链中的各个肽平面围绕同一轴旋转, 形成螺旋结构, 螺旋一周, 沿轴上升的距离即螺距为 0.54nm, 含 3.6 个氨基酸残基 ; 两个氨基酸之间的距离 0.15nm. 2 肽链内形成氢键, 氢键的取向几乎与轴平行, 第一个氨基酸残基的酰胺基团的 CO 基与第四个氨基酸残基酰胺基团的 NH 基形成氢键 3 蛋白质分子为右手 α 螺旋
46
47 ( 三 )β- 折叠使多肽链形成片层结构
48 β 折叠 β 折叠是由两条或多条几乎完全伸展的肽链平行排列, 通过链间的氢键交联而形成的 肽链的主链呈锯齿桩折叠构象 1 在 β 折叠中,α, 碳原子总是处于折叠的角上, 氨基酸的 R 基团处于折叠的棱角上并与棱角垂直, 两个氨基酸之间的轴心距为 0.35nm. 2 β 折叠结构的氢键主要是由两条肽链之间形成的 ; 也可以在同一肽链的不同部分之间形成 几乎所有肽键都参与链内氢键的交联, 氢键与链的长轴接近垂直 3β 折叠有两种类型 一种为平行式, 即所有肽链的 N 端都在同一边 另一种为反平行式, 即相邻两条肽链的方向相反
49
50
51 ( 四 )β- 转角和无规卷曲在蛋白质分子中普遍存在 β- 转角 无规卷曲是用来阐述没有确定规律性的那部 分肽链结构
52 β 转角 在 β 转角部分, 由四个氨基酸残基组成. 四个形成转角的残基中, 第三个一般均为甘氨酸残基. 弯曲处的第一个氨基酸残基的 C=O 和第四个残基的 N H 之间形成氢键, 形成一个不很稳定的环 状结构 这类结构主要存在于球状蛋白分子中
53 自由回转 没有一定规律的松散肽链结构, 但仍是紧密有序的稳定结构, 通过主链间及主链与侧链间氢键维持其构象. 不同的蛋白质, 自由回转的数量和形式各不相同. 分两类 : 1 紧密环 2 连接条带
54 ( 五 ) 模体是具有特殊功能的超二级结构 在许多蛋白质分子中, 可发现二个或三个具 有二级结构的肽段, 在空间上相互接近, 形成一 个有规则的二级结构组合, 被称为超二级结构超二级结构 二级结构组合形式有 3 种 :αα: αα,βαβ βαβ,ββ ββ
55
56 二个或三个具有二级结构的肽段, 在空间 上相互接近, 形成一个特殊的空间构象, 称为 模体 (motif) 模体是具有特殊功能的超二级结构
57 模体常见的形式 α- 螺旋 -β 转角 ( 或环 )-α- 螺旋模体 链 -β 转角 - 链模体 链 -β 转角 -α- 螺旋 -β 转角 - 链模体 钙结合蛋白中结合钙离子的模体 锌指结构
58 ( 六 ) 氨基酸残基的侧链对二级结构形成的影响 蛋白质二级结构是以一级结构为基础的 一段肽链其氨基酸残基的侧链适合形成 α- 螺旋 或 β- 折叠, 它就会出现相应的二级结构
59 三 在二级结构基础上多肽链进一步折叠形成蛋白质三级结构 ( 一 ) 三级结构是指整条肽链中全部氨基酸残基的相对空间位置 定义 : 整条肽链中全部氨基酸残基的相对空间位 置 即肽链中所有原子在三维空间的排布位置 主要的化学键 : 疏水键 离子键 氢键和 Van der Waals 力等
60
61 肌红蛋白 (Mb) C 端 N 端
62 ( 二 ) 结构域是三级结构层次上的局部折叠区 分子量较大的蛋白质常可折叠成多个结构较为紧 密的区域, 并各行其功能, 称为结构域 (domain) 结构域通常是几个超二级结构的组合, 对于较小的蛋白质分子, 结构域与三级结构等同, 即这些蛋白为单结构域 结构域一般由 个氨基酸残基组成, 但大小范围可达 个残基 氨基酸可以是连续的, 也可以是不连续的. 结构域之间常形成裂隙, 比较松散, 往往是蛋白质优先被水解的部位 酶的活性中心往往位于两个结构域的界面上. 结构域之间由 铰链区 相连, 使分子构象有一定的柔性, 通过结构域之间的相对运动, 使蛋白质分子实现一定的生物功能 在蛋白质分子内, 结构域可作为结构单位进行相对独立的运动, 水解出来后仍能维持稳定的结构, 甚至保留某些生物活性.
63
64 ( 三 ) 分子伴侣参与蛋白质折叠 分子伴侣 (chaperon) 通过提供一个保护环境从而加速蛋白质折叠成天然构象或形成四级结构 分子伴侣可逆地与未折叠肽段的疏水部分结合随后松开, 如此重复进行可防止错误的聚集发生, 使肽链正确折叠 分子伴侣也可与错误聚集的肽段结合, 使之解聚 后, 再诱导其正确折叠 分子伴侣在蛋白质分子折叠过程中二硫键的正确 形成起了重要的作用
65 四 含有二条以上多肽链的蛋白质具有四级结构 有些蛋白质分子含有二条或多条多肽链, 每一条多肽链都有完整的三级结构, 称为蛋白质的亚基 (subunit subunit) 蛋白质的四级结构是指亚基的种类 数量以及各个亚 基在寡聚蛋白质中的空间排布和亚基间的相互作用 亚基之间的结合主要是氢键和离子键
66 寡聚蛋白 许多蛋白质是由两个或两个以上独立的三级结构通过非共价键 结合成的多聚体, 称为寡聚蛋白 寡聚蛋白中的每个独立三级结构单元称为亚基 如, 血红蛋白的四级结构得测定由佩鲁茨 1958 年完成, 其结构要点为 : 球状蛋白, 寡聚蛋白, 含四个亚基两条 α 链, 两条 β 链,α2β2, α 链 :141: 个残基 ; β 链 :146: 个残基分子量 含四个血红素辅基亲水性侧链基团在分子表面, 疏水性基团在分子内部
67 由 2 个亚基组成的蛋白质四级结构中, 若亚基分子 结构相同, 称之为同二聚体 (homodimer), 若亚基分子 结构不同, 则称之为异二聚体 (heterodimer) 血红蛋白的四级结构
68
69 一级结构 二级结构 超二级结构 结构域 三级结构 亚基 四级结构
70 维系蛋白质分子的一级结构 : 肽键 二硫键 维系蛋白质分子的二级结构 : 氢键 维系蛋白质分子的三级结构 : 疏水相互作用力 氢键 范德华力 盐键 维系蛋白质分子的四级结构 : 范德华力 盐键 a 盐键 ( 离子键 ) d 范德华力 b 氢键 e 二硫键 c 疏水相互作用力 f 酯键
71 氢键 范德华力 疏水相互作用力 盐键, 均为次级键 氢键 范德华力虽然键能小, 但数量大 疏水相互作用力对维持三级结构特别重要 盐键数量小 二硫键对稳定蛋白质构象很重要, 二硫键越多, 蛋白质分子构象越稳定 离子键 氢键 范德华力 疏水相互作用力
72 五 蛋白质的分类 根据蛋白质组成成分 : 单纯蛋白质 结合蛋白质 = 蛋白质部分 + 非蛋白质部分 根据蛋白质形状 : 纤维状蛋白质 球状蛋白质
73 六 蛋白质组学 ( 一 ) 蛋白质组学基本概念 蛋白质组是指一种细胞或一种生物所表 达的全部蛋白质, 即 一种基因组所表达的 全套蛋白质
74 ( 二 ) 蛋白质组学研究技术平台 蛋白质组学是高通量, 高效率的研究 : 双向电泳分离样品蛋白质 蛋白质点的定位 切取 蛋白质点的质谱分析 ( 三 ) 蛋白质组学研究的科学意义
75 第三节 蛋白质结构与功能的关系 The Relation of Structure and Function of Protein
76 一 蛋白质一级结构是高级结构与功能的基础 ( 一 ) 一级结构是空间构象的基础 二硫键 牛核糖核酸酶的一级结构
77 天然状态, 有催化活性 去除尿素 β- 巯基乙醇 尿素 β- 巯基乙醇 非折叠状态, 无活性
78 ( 二 ) 一级结构相似的蛋白质具有相似的高级结构与功能 胰岛素 A5 氨基酸残基序号 A6 A10 B30 人 Thr Ser Ile Thr 猪 Thr Ser Ile Ala 狗 Thr Ser Ile Ala 兔 Thr Gly Ile Ser 牛 Ala Gly Val Ala 羊 Ala Ser Val Ala 马 Thr Ser Ile Ala
79 ( 三 ) 氨基酸序列提供重要的生物化学信息 一些广泛存在于生 物界的蛋白质如细胞色 素 (cytochrome C),, 比较 它们的一级结构, 可以 帮助了解物种进化间的 关系
80 ( 四 ) 重要蛋白质的氨基酸序列改变可引起疾病 例 : 镰刀形红细胞贫血 HbA β 肽链 N val his leu thr pro glu glu C(146) HbS β 肽链 N val his leu thr pro val glu C(146) 这种由蛋白质分子发生变异所导致的疾病, 称为 分子病
81
82 二 蛋白质的功能依赖特定空间结构 ( 一 ) 血红蛋白亚基与肌红蛋白结构相似 肌红蛋白 / 血红蛋白含有血红素辅基 血红素结构
83 肌红蛋白 (myoglobin,mb) 肌红蛋白是一个只有三级结构的单链蛋白质, 有 8 段 α- 螺旋结构 血红素分子中的两个丙酸侧链以离子键形式与肽链中的两个碱性氨基酸侧链上的正电荷相连, 加之肽链中的 F8 组氨酸残基还与 Fe 2+ 形成配位结合, 所以血红素辅基与蛋白质部分稳定结合
84
85 肌红蛋白的三级结构 哺乳动物肌肉中储氧的蛋白质 由一条多肽链 ( 珠蛋白 ) 和一个血红素辅基组成 球状分子, 单结构域 8 段直的 α- 螺旋组成, 分别命名为 A B C H, 拐弯处是由 1-8 个氨基酸组成的松散肽段 ( 无规卷曲 ) 4 个 Pro 残基各自处在一个拐弯处, 另外 4 个是 Ser Thr Asn Ile 血红素辅基, 扁平状, 结合在肌红蛋白表面的一个洞穴内
86 血红蛋白 (hemoglobin hemoglobin,hb Hb) 血红蛋白具有 4 个亚基 组成的四级结构, 每个亚基 可结合 1 个血红素并携带 1 分 子氧 Hb 亚基之间通过 8 对盐 键, 使 4 个亚基紧密结合而 形成亲水的球状蛋白
87 ( 二 ) 血红蛋白亚基构象变化可影响亚基与氧结合 Hb 与 Mb 一样能可逆地与 O 2 结合, Hb 与 O 2 结合后称为氧合 Hb 氧合 Hb 占总 Hb 的百分数 ( 称百分饱和度称 ) 随 O 2 浓度变化而改变
88 别构效应 又称变构效应, 是指寡聚蛋白与配基结合, 改变蛋白质构象, 导致蛋白质生物活性改变的现象. 它是细胞内最简单的调节方式. 例 : 血红蛋白的别构效应 一个亚基与氧结合后, 引起该亚基构象改变进而引起另三个亚基的构象改变, 整个分子构象改变与氧的结合能力增加.
89 肌红蛋白 (Mb) 和血红蛋白 (Hb Hb) 的氧解离曲线
90
91 血红素与氧结合后, 铁原子半径变小, 就能进入卟啉环的小孔中, 继而引起肽链位置的变动 O 2
92 协同效应 (cooperativity cooperativity) 一个寡聚体蛋白质的一个亚基与其配体结合后, 能影响此寡聚体中另一个亚基与配体结合能力的现 象, 称为协同效应协同效应 如果是促进作用则称为正协同效应 (positive cooperativity) 如果是抑制作用则称为负协同效应 (negative cooperativity)
93 ( 三 ) 蛋白质构象改变可引起疾病 蛋白质构象疾病 : 若蛋白质的折叠发生 错误, 尽管其一级结构不变, 但蛋白质的构 象发生改变, 仍可影响其功能, 严重时可导 致疾病发生
94 蛋白质构象改变导致疾病的机理 : 有些蛋 白质错误折叠后相互聚集, 常形成抗蛋白水解 酶的淀粉样纤维沉淀, 产生毒性而致病, 表现 为蛋白质淀粉样纤维沉淀的病理改变 这类疾病包括 : 人纹状体脊髓变性病 老 年痴呆症 亨停顿舞蹈病 疯牛病等
95 疯牛病中的蛋白质构象改变 疯牛病是由朊病毒蛋白 (prion protein, PrP) 引起的一组人和动物神经退行性病变 正常的 PrP 富含 α 螺旋, 称为 PrP c PrP c 在某种未知蛋白质的作用下可转变成全为 β 折叠的 PrP sc, 从而致病 PrP c α 螺旋 正常 PrP sc β 折叠 疯牛病
96 第四节 蛋白质的理化性质 The Physical and Chemical Characters of Protein
97 一 蛋白质具有两性电离的性质 蛋白质分子除两端的氨基和羧基可解离外, 氨基酸残基侧链中某些基团, 在一定的溶液 ph 条 件下都可解离成带负电荷或正电荷的基团 蛋白质的等电点 ( isoelectric point, pi) 当蛋白质溶液处于某一 ph 时, 蛋白质解离成 正 负离子的趋势相等, 即成为兼性离子, 净电 荷为零, 此时溶液的 ph 称为蛋白质的等电点
98 二 蛋白质具有胶体性质 蛋白质属于生物大分子之一, 分子量可自 1 万 至 100 万 KD 之巨, 其分子的直径可达 1~100nm 100nm, 为胶粒范围之内 蛋白质胶体稳定的因素 : 颗粒表面电荷 水化膜
99 水化膜 带正电荷的蛋白质 酸 碱 在等电点的蛋白质 碱 酸 带负电荷的蛋白质 脱水作用 脱水作用 脱水作用 碱 酸 带正电荷的蛋白质 不稳定的蛋白质颗粒 带负电荷的蛋白质 溶液中蛋白质的聚沉
100 三 蛋白质空间结构破坏而引起变性 蛋白质的变性 (denaturation) 在某些物理和化学因素作用下, 其特定的 空间构象被破坏, 也即有序的空间结构变成无 序的空间结构, 从而导致其理化性质改变和生 物活性的丧失
101 变性的本质 : 破坏非共价键和二硫键, 不改变蛋白 质的一级结构 造成变性的因素 : 如加热 乙醇等有机溶剂 强酸 强 碱 重金属离子及生物碱试剂等
102 应用举例 : 临床医学上, 变性因素常被应用来消毒及 灭菌 此外, 防止蛋白质变性也是有效保存蛋白质 制剂 ( 如疫苗等 ) 的必要条件
103 若蛋白质变性程度较轻, 去除变性因素 后, 蛋白质仍可恢复或部分恢复其原有的构 象和功能, 称为复性 (renaturation renaturation)
104 天然状态, 有催化活性 去除尿素 β- 巯基乙醇 尿素 β- 巯基乙醇 非折叠状态, 无活性
105 蛋白质沉淀 在一定条件下, 蛋白疏水侧链暴露在外, 肽链融会相互缠绕继而聚集, 因而从溶液中析出 变性的蛋白质易于沉淀, 有时蛋白质发生沉淀, 但并不变性 蛋白质的凝固作用 (protein coagulation) 蛋白质变性后的絮状物加热可变成比较坚固 的凝块, 此凝块不易再溶于强酸和强碱中
106 四 蛋白质在紫外光谱区有特征性吸收峰 由于蛋白质分子中含有共轭双键的酪氨酸 和色氨酸, 因此在 280nm 波长处有特征性吸收 峰 蛋白质的 OD280 与其浓度呈正比关系, 因 此可作蛋白质定量测定
107 五 应用蛋白质呈色反应可测定蛋白质 蛋白质经水解后产生的氨基酸也可发生茚三酮反应 蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热, 呈现紫色或红色, 此反应称为双缩脲反应, 双缩脲反应可用来检测蛋白质水解 程度 溶液含量 1. 茚三酮反应 (ninhydrin reaction) 2. 双缩脲反应 (biuret reaction)
108 第五节 蛋白质的分离纯化与结构分析 The Separation and Purification and Structure Analysis of Protein
109 一 透析及超滤法可去除蛋白质溶液中的小分子化合物 透析 (dialysis) 利用透析袋把大分子蛋白质与小分子化合物分开的方法 超滤法应用正压或离心力使蛋白质溶液透过有一定截留分子量的超滤膜, 达到浓缩蛋白质溶液的目的
110 二 丙酮沉淀 盐析及免疫沉淀是常用的蛋白质沉淀方法 使用丙酮沉淀时, 必须在 0~4 低温下进行, 丙酮用量一般 10 倍于蛋白质溶液体积 蛋白质被丙酮沉淀后, 应立即分离 除了丙酮以外, 也可用乙醇沉淀 盐析 (salt precipitation) 是将硫酸铵 硫酸钠或氯化钠等加入蛋白质溶液, 使蛋白质表面电荷被中和以及水化膜被破坏, 导致蛋白质沉淀
111 免疫沉淀法 : 将某一纯化蛋白质免疫动物可获得抗该蛋白的特异抗体 利用特异抗体识别相应的抗原蛋白, 并形成抗原抗体复合物的性质, 可从蛋白质混合溶液中分离获得抗原蛋白
112 三 利用荷电性质可用电泳法将蛋白质分离 蛋白质在高于或低于其 pi 的溶液中为带电的颗粒, 在电场中能向正极或负极移动 这种通过蛋白质在电场中泳动而达到分离各种蛋白质的技术, 称为电泳 (elctrophoresis) 根据支撑物的不同, 可分为薄膜电泳 凝胶电泳等
113 几种重要的蛋白质电泳 : SDS 聚丙烯酰胺凝胶电泳, 常用于蛋白质分子量的测定 等电聚焦电泳, 通过蛋白质等电点的差异而分离蛋白质的电泳方法 双向凝胶电泳是蛋白质组学研究的重要技术
114 四 应用相分配或亲和原理可将蛋白质进行层析分离 层析 (chromatography) 分离蛋白质的原理待分离蛋白质溶液 ( 流动相 ) 经过一个固态物质 ( 固定相 ) 时, 根据溶液中待分离的蛋白质颗粒大小 电荷多少及亲和力等, 使待分离的蛋白质组分在两相中反复分配, 并以不同速度流经固定相而达到分离蛋白质的目的
115 蛋白质分离常用的层析方法 离子交换层析 : 利用各蛋白质的电荷量及性质不同进行分离 凝胶过滤 (gel filtration) 又称分子筛层析, 利用各蛋白质分子大小不同分离
116
117
118 五 利用蛋白质颗粒沉降行为不同可进行超速离心分离 超速离心法 (ultracentrifugation) 既可以用来分离纯化蛋白质也可以用作测定蛋白质的分子量 蛋白质在离心场中的行为用沉降系数 (sedimentation coefficient, S) 表示, 沉降系数与蛋白质的密度和形状相关
119 因为沉降系数 S 大体上和分子量成正比关系, 故可应用超速离心法测定蛋白质分子量, 但对分子形状的高度不对称的大多数纤维状蛋白质不适用
120 六 应用化学或反向遗传学方法可分析 多肽链的氨基酸序列 分析已纯化蛋白质的氨基酸残基组成 测定多肽链的氨基末端与羧基末端为何种氨基酸残基 把肽链水解成片段, 分别进行分析 测定各肽段的氨基酸排列顺序, 一般采用 Edman 降解法 一般需用数种水解法, 并分析出各肽段中的氨基酸 顺序, 然后经过组合排列对比, 最终得出完整肽链中氨 基酸顺序的结果
121 通过核酸来推演蛋白质中的氨基酸序列 分离编码蛋白质的基因 测定 DNA 序列 排列出 mrna 序列 按照三联密码的原则推演出氨基酸的序列
122 七 应用物理学 生物信息学原理 可进行蛋白质空间结构测定 二级结构测定通常采用圆二色光谱 (circular dichroism, CD) 测定溶液状态下的蛋白质二级结构含量 α- 螺旋的 CD 峰有 222nm 处的负峰 208nm 处的负峰和 198 nm 处的正峰三个成分 ; 而 β- 折叠的 CD 谱不很固定
123 三级结构测定 X 射线衍射法 (X ray diffraction) 和核磁共振技术 (nuclear magnetic resonance, NMR) 是研究蛋白质三维空间结构最准确的方法
124 根据蛋白质的氨基酸序列预测其三维空间结构 : 同源模建 : 将待研究的序列与已知结构的同源蛋白质序列对齐 补偿氨基酸替补 插入和缺失 通过模建和能量优化计算, 产生目标序列三维结构 序列相似性越高, 预测的模型也越准确 折叠识别 : 通过预测二级结构 预测折叠方式和参考其它蛋白的空间结构, 从而产生目标序列的三维结构 从无到有 : 根据单个氨基酸形成二级结构的倾向, 加上各种作用力力场信息, 直接产生目标序列三维结构
125
126
127
128 2. 蛋白质的一级结构的测定 蛋白质氨基酸顺序的测定是蛋白质化学研究的基础 自从 1953 年 F.Sanger 测定了胰岛素的一级结构以来, 现在已经有上千种不同蛋白质的一级结构被测定 (1) 测定蛋白质的一级结构的要求 A. A. 样品必需纯 (>97% 以上 ); B. B. 知道蛋白质的分子量 ; C. C. 知道蛋白质由几个亚基组成 ; D. D. 测定蛋白质的氨基酸组成 ; 并根据分子量计算每种氨基酸的个数 E. E. 测定水解液中的氨量, 计算酰胺的含量
129 (2) 测定步骤 1 多肽链的拆分 : 由多条多肽链组成的蛋白质分子, 必须先进行拆分 几条多肽链借助非共价键连接在一起, 称为寡聚蛋白质, 如, 血红蛋白为四聚体, 烯醇化酶为二聚体 ; 可用 8mol/L 尿素或 6mol/L 盐酸胍处理, 即可分开多肽链 ( 亚基 ). 2 测定蛋白质分子中多肽链的数目 : 通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间的关系, 即可确定多肽链的数目 3 二硫键的断裂 : 几条多肽链通过二硫键交联在一起 可在可用 8mol/L 尿素或 6mol/L 盐酸胍存在下, 用过量的 β- 巯基乙醇处理, 使二硫键还原为巯基, 然后用烷基化试剂保护生成的巯基, 以防止它重新被氧化 可以通过加入盐酸胍方法解离多肽链之间的非共价力 ; 应用过甲酸氧化法或巯基还原法拆分多肽链间的二硫键
130 巯基的保护 OOC CHCH 2 SH NH 3 + O ICH 2 CNH 2 O CH 2 OCCl CH 2 Cl OOC CHCH 2 S OCCH 2 NH 3 + O OOC CHCH 2 S CH 2 NH 3 + OOC CHCH 2 S CH 2 CNH 2 NH 3 + O 4 测定每条多肽链的氨基酸组成, 并计算出氨基酸成分的分子比 ; 5 分析多肽链的 N- 末端和 C- 末端 末端氨基酸的测定 : 多肽链端基氨基酸分为两类,N 端氨基酸和 C 端氨基酸 在肽链氨基酸顺序分析中, 最重要的是 N 端氨基酸分析法 末端氨基酸测定的主要方法有 :
131 6 多肽链断裂成多个肽段, 可采用两种或多种不同的断裂方法将多肽样品断裂成两套或多套肽段或肽碎片, 并将其分离开来 多肽的选择性降解的方法有 : A. 酶解法 : 胰蛋白酶, 糜蛋白酶, 胃蛋白酶, 嗜热菌蛋白酶, 羧肽酶和氨肽酶 B. 化学法 : 溴化氰水解法, 它能选择性地切割由甲硫氨酸的羧基所形成的肽键 C H 3 S : C H 2 C H 2 N H C H C N H C H C C H 3 S + C N O R O + B r C + N B r C H 2 C H 2 O N H C H C N H C H C R O C H 2 C H 3 S C N C H 2 O R O N H C H C N H C H C + H 2 O C H 2 C H 2 O R O N H C H C O H 3 N + C H C + 高丝氨酸内酯
132 7 测定每个肽段的氨基酸顺序 8 确定肽段在多肽链中的次序 : 利用两套或多套肽段的氨基酸顺序彼此间的交错重叠, 拼凑出整条多肽链的氨基酸顺序 9 确定原多肽链重二硫键的位置 : 一般采用胃蛋白酶处理没有断开二硫键的多肽链, 再利用双向电泳技术分离出各个肽段, 用过甲酸处理后, 将每个肽段进行组成及顺序分析, 然后同其它方法分析的肽段进行比较, 确定二硫键的位置
第 1 章 蛋白质的结构与功能 Structure and Function of Protein
 第 1 章 蛋白质的结构与功能 Structure and Function of Protein 什么是蛋白质? 蛋白质 (protein) 是由许多氨基 酸 (amino acids) 通过肽键 (peptide bond) 相连形成的高分子含氮化合物 蛋白质研究的历史 1833 年, 从麦芽中分离淀粉酶 ; 随后从胃液中 分离到类似胃蛋白酶的物质 1864 年, 血红蛋白被分离并结晶 19 世纪末,
第 1 章 蛋白质的结构与功能 Structure and Function of Protein 什么是蛋白质? 蛋白质 (protein) 是由许多氨基 酸 (amino acids) 通过肽键 (peptide bond) 相连形成的高分子含氮化合物 蛋白质研究的历史 1833 年, 从麦芽中分离淀粉酶 ; 随后从胃液中 分离到类似胃蛋白酶的物质 1864 年, 血红蛋白被分离并结晶 19 世纪末,
人体是如此构成的
 第四节 蛋白质的结构与功能 Structure and Function of Protein 人体是如此构成的 The major objective of biochemistry is the complete understanding, at the molecular level, of all of the chemistry processes associated with living
第四节 蛋白质的结构与功能 Structure and Function of Protein 人体是如此构成的 The major objective of biochemistry is the complete understanding, at the molecular level, of all of the chemistry processes associated with living
(1) 脂 肪 族 氨 基 酸 (2) 芳 香 族 氨 基 酸 : 苯 丙 氨 酸 色 氨 酸 酪 氨 酸 (3) 杂 环 氨 基 酸 : 脯 氨 酸 组 氨 酸 3 按 侧 基 R 基 与 水 的 关 系 分 : (1) 非 极 性 氨 基 酸 : 有 甘 氨 酸 丙 氨 酸 缬 氨 酸 亮 氨
 第 四 章 氨 基 酸 与 蛋 白 质 1 掌 握 蛋 白 质 的 基 本 构 成 单 体 : 氨 基 酸 的 结 构 特 点, 从 各 氨 基 酸 的 结 构 特 点 上 理 解 氨 基 酸 的 分 类 2 掌 握 氨 基 酸 的 理 化 性 质, 重 点 掌 握 两 性 电 离 与 等 电 点 含 义 茚 三 酮 反 应 及 其 应 用 3 掌 握 氨 基 酸 纸 层 析 的 原 理 第 一 节
第 四 章 氨 基 酸 与 蛋 白 质 1 掌 握 蛋 白 质 的 基 本 构 成 单 体 : 氨 基 酸 的 结 构 特 点, 从 各 氨 基 酸 的 结 构 特 点 上 理 解 氨 基 酸 的 分 类 2 掌 握 氨 基 酸 的 理 化 性 质, 重 点 掌 握 两 性 电 离 与 等 电 点 含 义 茚 三 酮 反 应 及 其 应 用 3 掌 握 氨 基 酸 纸 层 析 的 原 理 第 一 节
! " # +(!"# $%& (!"!#$%& (&%!)*) +,)) )!#$%&+!$%-./! $*0! +,)) 1*23!% %*2$*23 1!%%*$*2,2#%!,) )4542*$ *0!2$*1*#,$*&2!! 1!%%*$*2 $#!"!)!" "
 !""# $!"#$"%&!""#!"#$%&% ()*$+, (-!"*(.+/(0*+1"2 ()*!% +(* $ #& $"$! $ + + $ + + $ + $!,! $*,&$""-!*,&$""-,*,&$""- 789, )! %.! %.! %.! % :;
!""# $!"#$"%&!""#!"#$%&% ()*$+, (-!"*(.+/(0*+1"2 ()*!% +(* $ #& $"$! $ + + $ + + $ + $!,! $*,&$""-!*,&$""-,*,&$""- 789, )! %.! %.! %.! % :;
 H N H CH 2 要 C要 COOH NH 2 H HN CH 2 要 C要 COOH N NH 2 R 1 O R 2 H 2 N 要 C 要 C 要 OH+H 要 N 要 C 要 COOH -H 2O R 1 O R 2 H 2 N 要 C 要 C 要 N 要 C 要 COOH H H H 氨基酸 H 肽键 H H 氧分压高 Hb-Fe 2+ +O 2 Hb-Fe 2+ -O 2
H N H CH 2 要 C要 COOH NH 2 H HN CH 2 要 C要 COOH N NH 2 R 1 O R 2 H 2 N 要 C 要 C 要 OH+H 要 N 要 C 要 COOH -H 2O R 1 O R 2 H 2 N 要 C 要 C 要 N 要 C 要 COOH H H H 氨基酸 H 肽键 H H 氧分压高 Hb-Fe 2+ +O 2 Hb-Fe 2+ -O 2
第一节蛋白质通论
 第一节蛋白质通论 蛋白质 (protein) 是生活细胞内含量最丰富 功能最复杂的生物大分子, 并参与了几乎所有的生命活动和生命过程 一. 蛋白质在机体中的重要作用 催化作用运输作用调节作用运动作用防御作用营养作用结构蛋白 高效专一地催化机体内几乎所有 的反应 专一运输各种小分子和离子 调节机体代谢活动 负责机体的运动 防御异体侵入机体 作为氨基酸的贮库, 用于生长发育所需或某些物质与蛋白质结合而被贮存
第一节蛋白质通论 蛋白质 (protein) 是生活细胞内含量最丰富 功能最复杂的生物大分子, 并参与了几乎所有的生命活动和生命过程 一. 蛋白质在机体中的重要作用 催化作用运输作用调节作用运动作用防御作用营养作用结构蛋白 高效专一地催化机体内几乎所有 的反应 专一运输各种小分子和离子 调节机体代谢活动 负责机体的运动 防御异体侵入机体 作为氨基酸的贮库, 用于生长发育所需或某些物质与蛋白质结合而被贮存
Microsoft PowerPoint - bioinfo_hebau22.ppt
 第二章 生物学基础 ( 一 ) 生物的分类 ( 二 ) 生物大分子 ( 三 ) 中心法则 第二节 生物大分子 主要内容 : 生物大分子 1. 细胞结构 ( 从染色体到 DNA) 2. 糖类 (D- 核糖 D-2- 脱氧核糖 ) 3. 脂类 ( 磷脂 ) 4. 蛋白质 ( 氨基酸 蛋白质及其结构 ) 5. 核酸 ( 核苷酸 脱氧核糖核酸 DNA 和 核糖核酸 RNA) 一 细胞结构 cell 真核生物细胞
第二章 生物学基础 ( 一 ) 生物的分类 ( 二 ) 生物大分子 ( 三 ) 中心法则 第二节 生物大分子 主要内容 : 生物大分子 1. 细胞结构 ( 从染色体到 DNA) 2. 糖类 (D- 核糖 D-2- 脱氧核糖 ) 3. 脂类 ( 磷脂 ) 4. 蛋白质 ( 氨基酸 蛋白质及其结构 ) 5. 核酸 ( 核苷酸 脱氧核糖核酸 DNA 和 核糖核酸 RNA) 一 细胞结构 cell 真核生物细胞
i
 i i ii 1 2 3 4 % N) 5 50.0 AMINO ACID #64 [modified by Administrator] IntAmp_1 nc 40.0 30.0 20.0 10.0 0.0-10.0 1 - ala - 10.483 2 - thr - 11.107 3 - gly - 11.872 4 - val - 13.458 5 - ser - 14.903 6 - pro
i i ii 1 2 3 4 % N) 5 50.0 AMINO ACID #64 [modified by Administrator] IntAmp_1 nc 40.0 30.0 20.0 10.0 0.0-10.0 1 - ala - 10.483 2 - thr - 11.107 3 - gly - 11.872 4 - val - 13.458 5 - ser - 14.903 6 - pro
Microsoft PowerPoint - chap14.ppt [兼容模式]
![Microsoft PowerPoint - chap14.ppt [兼容模式] Microsoft PowerPoint - chap14.ppt [兼容模式]](/thumbs/104/162090199.jpg) 生物信息学 第十四章结构生物信息学 GLUT1 2014,12 次跨膜,N45T & E329Q 突变体 2015 年 GLUT3 GLUTs 作用机制 蛋白质的结构与功能 蛋白质的结构 主要由一级序列所决定 蛋白质的功能 主要由三级结构所决定 球蛋白 (Globular proteins): 疏水的内核 & 亲水的表面 膜蛋白 (Membrane proteins): 特定的疏水表面 亚稳态 (marginally
生物信息学 第十四章结构生物信息学 GLUT1 2014,12 次跨膜,N45T & E329Q 突变体 2015 年 GLUT3 GLUTs 作用机制 蛋白质的结构与功能 蛋白质的结构 主要由一级序列所决定 蛋白质的功能 主要由三级结构所决定 球蛋白 (Globular proteins): 疏水的内核 & 亲水的表面 膜蛋白 (Membrane proteins): 特定的疏水表面 亚稳态 (marginally
Microsoft PowerPoint - 第二章 蛋白质.ppt
 第二章蛋白质 第一节 组成蛋白质的构件单位 20 种常见的蛋白质氨基酸 一 常见的蛋白质氨基酸的特征 1 通式: COOH COO - H 2 N C H + H 3 N C H R 不带电形式 R ( 两性离子形式 ) 与羧基相邻的 α- 碳原子上都有一个氨基, 因而称为 α- 氨基酸 2 构型 除甘氨酸外的氨基酸 分子中的 α- 碳原子都为不对称碳原子 都具有旋光性 氨基酸的构型是以距羧基最近的手性
第二章蛋白质 第一节 组成蛋白质的构件单位 20 种常见的蛋白质氨基酸 一 常见的蛋白质氨基酸的特征 1 通式: COOH COO - H 2 N C H + H 3 N C H R 不带电形式 R ( 两性离子形式 ) 与羧基相邻的 α- 碳原子上都有一个氨基, 因而称为 α- 氨基酸 2 构型 除甘氨酸外的氨基酸 分子中的 α- 碳原子都为不对称碳原子 都具有旋光性 氨基酸的构型是以距羧基最近的手性
PowerPoint Presentation
 第十四章氨基酸 蛋白质和核酸 组成生命体系的物质很多, 如激素 维生素 氨基酸 磷脂 单糖等生物小分子, 以及蛋白质 核酸 多糖等生物大分子, 但最基本的物质是蛋白质 (proteins) 和核酸 (nucleic acids), 它们存在于所有的生物体中 蛋白质是一切生命活动的承担者, 生物体内从二氧化碳的水合 ( 即光合作用 ) 到核酸的复制等等的生命活动过程几乎都与蛋白质有关 蛋白质含一条或多条多肽
第十四章氨基酸 蛋白质和核酸 组成生命体系的物质很多, 如激素 维生素 氨基酸 磷脂 单糖等生物小分子, 以及蛋白质 核酸 多糖等生物大分子, 但最基本的物质是蛋白质 (proteins) 和核酸 (nucleic acids), 它们存在于所有的生物体中 蛋白质是一切生命活动的承担者, 生物体内从二氧化碳的水合 ( 即光合作用 ) 到核酸的复制等等的生命活动过程几乎都与蛋白质有关 蛋白质含一条或多条多肽
<4D F736F F D20B5DA322D36D5C220B4F0B0B820B0B1BBF9CBE1BACDB5B0B0D7D6CAB5C4BDE1B9B9>
 第 2-6 章氨基酸和蛋白质的结构和功能答案 一 填空 1.20, 非极性, 极性, 疏水, 亲水, 赖, 精, 天, 冬 2. 酪氨酸 ( 或 Tyr), 苯丙氨酸 ( 或 Phe), 色氨酸 ( 或 Trp) 3.-OH,-SH,-COOH,N,NH 4. 氨基, 紫红, 亮黄 5. 肽, 氢键, 二硫键, 疏水作用 ( 键 ), 范德华力, 二硫键 6. 谷, 缬, 极, 非极 7. 异硫氰酸苯酯,
第 2-6 章氨基酸和蛋白质的结构和功能答案 一 填空 1.20, 非极性, 极性, 疏水, 亲水, 赖, 精, 天, 冬 2. 酪氨酸 ( 或 Tyr), 苯丙氨酸 ( 或 Phe), 色氨酸 ( 或 Trp) 3.-OH,-SH,-COOH,N,NH 4. 氨基, 紫红, 亮黄 5. 肽, 氢键, 二硫键, 疏水作用 ( 键 ), 范德华力, 二硫键 6. 谷, 缬, 极, 非极 7. 异硫氰酸苯酯,
蛋白质部分
 核酸及蛋白质化学 杨在清 生命科学技术学院 蛋白质部分 第一章蛋白质组成及结构 第一节组成蛋白质的氨基酸第二节蛋白质的一级结构与进化第三节蛋白质的空间结构第四节蛋白质各级结构之间的关系第五节球状蛋白质构象的运动 第一节组成蛋白质的氨基酸 根据侧链结构和性质的不同分为 : 1. 脂肪族氨基酸 2. 芳香族氨基酸 3. 羟基氨基酸与含硫氨基酸 4. 酸性氨基酸及其酰胺 5. 碱性氨基酸另外, 蛋白质中还常含有修饰氨基酸
核酸及蛋白质化学 杨在清 生命科学技术学院 蛋白质部分 第一章蛋白质组成及结构 第一节组成蛋白质的氨基酸第二节蛋白质的一级结构与进化第三节蛋白质的空间结构第四节蛋白质各级结构之间的关系第五节球状蛋白质构象的运动 第一节组成蛋白质的氨基酸 根据侧链结构和性质的不同分为 : 1. 脂肪族氨基酸 2. 芳香族氨基酸 3. 羟基氨基酸与含硫氨基酸 4. 酸性氨基酸及其酰胺 5. 碱性氨基酸另外, 蛋白质中还常含有修饰氨基酸
未命名-1
 1 2 3 4 5 6 7 8 9 10 11 12 ss a c y e vg 13 14 15 16 17 18 19 H 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 发现生命的螺旋 克里克在提出 中心法则 时曾指出 遗传信息是沿 D N A - R N A - 蛋白质的方向流动的 遗传信息不可能从 R N A 回到 D N
1 2 3 4 5 6 7 8 9 10 11 12 ss a c y e vg 13 14 15 16 17 18 19 H 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 发现生命的螺旋 克里克在提出 中心法则 时曾指出 遗传信息是沿 D N A - R N A - 蛋白质的方向流动的 遗传信息不可能从 R N A 回到 D N
 器之 间 向一致时为正 相反时则为负 ③大量电荷的定向移动形成电 流 单个电荷的定向移动同样形成电流 3 电势与电势差 1 陈述概念 电场中某点处 电荷的电势能 E p 与电荷量 q Ep 的比值叫做该点处的电势 表达式为 V 电场中两点之间的 q 电势之差叫做电势差 表达式为 UAB V A VB 2 理解概念 电势差是电场中任意两点之间的电势之差 与参考点的选择无关 电势是反映电场能的性质的物理量
器之 间 向一致时为正 相反时则为负 ③大量电荷的定向移动形成电 流 单个电荷的定向移动同样形成电流 3 电势与电势差 1 陈述概念 电场中某点处 电荷的电势能 E p 与电荷量 q Ep 的比值叫做该点处的电势 表达式为 V 电场中两点之间的 q 电势之差叫做电势差 表达式为 UAB V A VB 2 理解概念 电势差是电场中任意两点之间的电势之差 与参考点的选择无关 电势是反映电场能的性质的物理量
材料导报 研究篇 年 月 下 第 卷第 期 种球的制备 单步溶胀法制备分子印迹聚合物微球 洗脱处理 种子溶胀聚合机理 种球用量的影响
 水相中 组氨酸单分散分子印迹聚合物微球的合成 表征及其识别性能研究 李思平等 李思平 徐伟箭 较佳工艺条件下 在水性体系中选用无皂乳液聚合法制得的单分散微米级聚苯乙烯微球为种球 分别以组氨酸 甲基丙烯酸 或丙烯酸胺 乙二醇二甲基丙烯酸酯 为模板分子 功能单体和交联剂 合成了 组氨酸分子印迹聚合物微球 研究了形貌 粒径及其分布以及模板分子与功能单体之间的相互作用 分别以 激光粒度分析仪紫外分光光度法和红外光谱表征功能单体与交联剂之间的共聚情况
水相中 组氨酸单分散分子印迹聚合物微球的合成 表征及其识别性能研究 李思平等 李思平 徐伟箭 较佳工艺条件下 在水性体系中选用无皂乳液聚合法制得的单分散微米级聚苯乙烯微球为种球 分别以组氨酸 甲基丙烯酸 或丙烯酸胺 乙二醇二甲基丙烯酸酯 为模板分子 功能单体和交联剂 合成了 组氨酸分子印迹聚合物微球 研究了形貌 粒径及其分布以及模板分子与功能单体之间的相互作用 分别以 激光粒度分析仪紫外分光光度法和红外光谱表征功能单体与交联剂之间的共聚情况
 乔永民 黄长江 于 年 月在汕头湾采集了 个表层沉积物样品 测定了它们的细粒级组分 总有机质 铝 铁 锰 铜 锌 铅 镉 铬 镍 钴的含量 对其分布特征及其彼此之间相关性进行了分析 并以南 海陆架区重金属含量为背景值计算了汕头湾表层沉积物重金属元素的富集系数 结果表明 铁 锰 铜 锌 铅 镉 铬 镍 钴的含量范围分别为 其分布由汕头湾上游的榕江口至湾口呈波浪状递减 锰除外 汕头湾表层沉积物中各重金属
乔永民 黄长江 于 年 月在汕头湾采集了 个表层沉积物样品 测定了它们的细粒级组分 总有机质 铝 铁 锰 铜 锌 铅 镉 铬 镍 钴的含量 对其分布特征及其彼此之间相关性进行了分析 并以南 海陆架区重金属含量为背景值计算了汕头湾表层沉积物重金属元素的富集系数 结果表明 铁 锰 铜 锌 铅 镉 铬 镍 钴的含量范围分别为 其分布由汕头湾上游的榕江口至湾口呈波浪状递减 锰除外 汕头湾表层沉积物中各重金属
生物医学技能-western blot.ppt
 SDS PAGE AND WESTERN BLOTTING Western Blot Western blots allow investigators to determine the molecular weight of a protein and to measure relative amounts of the protein present in different samples.
SDS PAGE AND WESTERN BLOTTING Western Blot Western blots allow investigators to determine the molecular weight of a protein and to measure relative amounts of the protein present in different samples.
新建 Microsoft PowerPoint 演示文稿.ppt
 G+ G+ G- b 作用机制 不可逆地结合到细菌核糖体 50S亚基 的靶位上 抑制细菌蛋白质合成?14元大环内酯类阻断 肽酰基t RNA移位?16元大环内酯类抑制 肽酰基的转移反应?与50S亚基上的L27 L22蛋白质结合 促使 肽酰基t RNA从核糖体 上解离 对哺乳动物核糖体无影响 erythromycin erythromycin erythromycin 5% 5% clarithromycin
G+ G+ G- b 作用机制 不可逆地结合到细菌核糖体 50S亚基 的靶位上 抑制细菌蛋白质合成?14元大环内酯类阻断 肽酰基t RNA移位?16元大环内酯类抑制 肽酰基的转移反应?与50S亚基上的L27 L22蛋白质结合 促使 肽酰基t RNA从核糖体 上解离 对哺乳动物核糖体无影响 erythromycin erythromycin erythromycin 5% 5% clarithromycin
tbjx0121ZW.PDF
 1 a a b a (9+2 b - ) a c - 9 2 ( ( ) a 90 ) ( ( ) b - ) 10 (9+2 ) a b - ( ) a c - 2 ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) () ( ) ( ) ( ) ( 1 2 ) ( ) ( 3 () 0.3mm 2 ( ) 2 10 ( ) ( ) ( ) 2 10 ( )
1 a a b a (9+2 b - ) a c - 9 2 ( ( ) a 90 ) ( ( ) b - ) 10 (9+2 ) a b - ( ) a c - 2 ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) () ( ) ( ) ( ) ( 1 2 ) ( ) ( 3 () 0.3mm 2 ( ) 2 10 ( ) ( ) ( ) 2 10 ( )
材料 方法
 生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
生物技术通报 姜燕 采用鼠抗人血红蛋白 单克隆抗体 和胶体金标记鼠抗人血红蛋白 单克隆抗体 及对照抗体羊抗鼠 利用双抗体免疫夹心反应原理特异性地结合人血红蛋白抗原 在 内可得到胶体金显色结果的原理研制便潜血单克 隆一步法胶体金检测试卡 用于诊断因各种原因引起的消化道出血疾病 应用杂交瘤技术制备两株鼠抗人血红蛋白 抗 体 方法检测 效价 免疫胶体金技术制备胶体金检测试卡 法检测 效价的结果显示 鼠抗人
 程汉良 夏德全 吴婷婷 孟学平 吉红九 董志国 陈淑吟 对文蛤 青蛤 硬壳蛤 江户布目蛤 薄片镜蛤 和菲律宾蛤仔 种帘蛤科贝类和 个地理种 群文蛤 大连 连云港 湛江 防城港 的细胞色素 氧化酶亚基 基因片段的核苷酸序列进行了分析 以探讨这一序列在种质鉴定 种群遗传结构和分子系统发生研究中的应用价值 测序结果 表明 所有物种扩增片段长度均为 序列 含量 明显高于 含量 物种间共有变异位点 个 其中简约信息位点
程汉良 夏德全 吴婷婷 孟学平 吉红九 董志国 陈淑吟 对文蛤 青蛤 硬壳蛤 江户布目蛤 薄片镜蛤 和菲律宾蛤仔 种帘蛤科贝类和 个地理种 群文蛤 大连 连云港 湛江 防城港 的细胞色素 氧化酶亚基 基因片段的核苷酸序列进行了分析 以探讨这一序列在种质鉴定 种群遗传结构和分子系统发生研究中的应用价值 测序结果 表明 所有物种扩增片段长度均为 序列 含量 明显高于 含量 物种间共有变异位点 个 其中简约信息位点
材料! 方法! # 基因的扩增及其序列分析
 生物技术通报 黄艳燕 黄靖华 卢福芝 孙靓 彭立新 周兴 黄日波 利用 的方法从鼠李糖乳杆菌基因组 中扩增到 乳酸脱氢酶基因 并连接到载体 上 构建表达质粒 将重组质粒 转化大肠杆菌 重组菌株经 诱导表达 电泳分 析表明 在大肠杆菌中实现了表达 表达产物的分子量约为 同时采用紫外分光光度法测定 乳酸脱氢酶的酶活 测得重组菌株的 乳酸脱氢酶活力为 最适反应温度为 最适 乳酸脱氢酶 克隆 表达 鼠李糖乳杆菌
生物技术通报 黄艳燕 黄靖华 卢福芝 孙靓 彭立新 周兴 黄日波 利用 的方法从鼠李糖乳杆菌基因组 中扩增到 乳酸脱氢酶基因 并连接到载体 上 构建表达质粒 将重组质粒 转化大肠杆菌 重组菌株经 诱导表达 电泳分 析表明 在大肠杆菌中实现了表达 表达产物的分子量约为 同时采用紫外分光光度法测定 乳酸脱氢酶的酶活 测得重组菌株的 乳酸脱氢酶活力为 最适反应温度为 最适 乳酸脱氢酶 克隆 表达 鼠李糖乳杆菌
习题要点 : 组成蛋白质的基本单位 L- 氨基酸 ( 种类 三字英文缩写符号 基本结构 分类 : 非极性疏水性氨基酸 极性中性氨基酸 酸性氨基酸 碱性氨基酸 氨基酸的光吸收性质 酸碱性质 重要的化学反应, 包括与茚三酮反应 Sanger 反应和 Edman 反应 第三节肽 1. 肽与肽键 2. 肽的
 基础生物化学 教学大纲 一 基本信息 课程名称 基础生物化学 课程编号 BIOL2401 英文名称 General Biochemistry 课程类型 学科基础课 总学时 36 理论学时 36 实验学时 实践学时 学 分 2 预修课程 普通生物学, 有机化学 适用对象 生物类专业 近代生物化学主要是在分子水平上研究生物体的化学本质及其在生命活动过程中的 化学变化规律 基础生物化学 课程是我校生物类专业学生的学科基础课,
基础生物化学 教学大纲 一 基本信息 课程名称 基础生物化学 课程编号 BIOL2401 英文名称 General Biochemistry 课程类型 学科基础课 总学时 36 理论学时 36 实验学时 实践学时 学 分 2 预修课程 普通生物学, 有机化学 适用对象 生物类专业 近代生物化学主要是在分子水平上研究生物体的化学本质及其在生命活动过程中的 化学变化规律 基础生物化学 课程是我校生物类专业学生的学科基础课,
酸檸檬?鹼檸檬??食物的酸鹼性.doc
 篇 名 : 酸 檸 檬? 鹼 檸 檬? 食 物 的 酸 鹼 性 作 者 : 何 國 維 國 立 埔 里 高 工 化 工 科 二 年 乙 班 指 導 老 師 : 余 志 輝 老 師 壹 前 言 食 物, 是 人 類 每 天 的 能 量 的 來 源, 無 論 酸 甜 苦 辣, 各 式 各 樣 的 食 物 隨 處 可 見, 頗 具 豐 富 性 及 變 化 性, 令 人 食 指 大 動 但 是, 日 前 科
篇 名 : 酸 檸 檬? 鹼 檸 檬? 食 物 的 酸 鹼 性 作 者 : 何 國 維 國 立 埔 里 高 工 化 工 科 二 年 乙 班 指 導 老 師 : 余 志 輝 老 師 壹 前 言 食 物, 是 人 類 每 天 的 能 量 的 來 源, 無 論 酸 甜 苦 辣, 各 式 各 樣 的 食 物 隨 處 可 見, 頗 具 豐 富 性 及 變 化 性, 令 人 食 指 大 動 但 是, 日 前 科
煤 炭 学 报 仪器与药品 黏土矿物的提纯 黏土样品的制备 红外光谱 分析 射线衍射 分析 射线光电子能谱 分析
 张明青 刘炯天 单爱琴 刘汉湖 为了深刻认识煤泥水中 同黏土矿物颗粒之间的相互作用 笔者用 溶液在不同 值条件下分别同高岭土和蒙脱土作用 测定黏土作用前后的 射线衍射 红外光谱和 射线光电子能谱 实验证实了在 溶液中 在黏土表面以静电形式吸附 在 溶液中 以 沉淀和静电形式吸附 此外 在 以上的溶液中还可能存在一 羟基络合吸附形式 提出了 沉淀吸附和一羟基络合吸附的吸附过程模式 黏土颗粒表面的 沉淀使颗粒间形成的非选择性
张明青 刘炯天 单爱琴 刘汉湖 为了深刻认识煤泥水中 同黏土矿物颗粒之间的相互作用 笔者用 溶液在不同 值条件下分别同高岭土和蒙脱土作用 测定黏土作用前后的 射线衍射 红外光谱和 射线光电子能谱 实验证实了在 溶液中 在黏土表面以静电形式吸附 在 溶液中 以 沉淀和静电形式吸附 此外 在 以上的溶液中还可能存在一 羟基络合吸附形式 提出了 沉淀吸附和一羟基络合吸附的吸附过程模式 黏土颗粒表面的 沉淀使颗粒间形成的非选择性
10 蛋白质结构与功能的关系
 第 6 章 蛋白质的功能与进化 主要内容 一 蛋白质功能的多样性二 血红蛋白的结构三 血红蛋白的功能 : 转运氧四 血红蛋白分子病五 免疫球蛋白六 氨基酸序列与生物学功能 一 蛋白质功能的多样性 催化 ( 酶 ) 调节 ( 激素 ) 转运 ( 血红蛋白 膜转运蛋白 ) 贮存 ( 卵清蛋白 ) 运动 ( 肌动蛋白 肌球蛋白 ) 结构成分 ( 角蛋白 胶原蛋白 ) 支架作用 ( 支架蛋白 : 在细胞应答激素和生长因子的复杂途径中起作用
第 6 章 蛋白质的功能与进化 主要内容 一 蛋白质功能的多样性二 血红蛋白的结构三 血红蛋白的功能 : 转运氧四 血红蛋白分子病五 免疫球蛋白六 氨基酸序列与生物学功能 一 蛋白质功能的多样性 催化 ( 酶 ) 调节 ( 激素 ) 转运 ( 血红蛋白 膜转运蛋白 ) 贮存 ( 卵清蛋白 ) 运动 ( 肌动蛋白 肌球蛋白 ) 结构成分 ( 角蛋白 胶原蛋白 ) 支架作用 ( 支架蛋白 : 在细胞应答激素和生长因子的复杂途径中起作用
第一章 化学反应中的质量关系和能量关系
 第 章酸碱反应和沉淀反应习题参考答案 解 :(1)pHlg (H )1.00 ()0.050mol HOA 溶液中, HOA H OA 平 /(mol ) 0.050 (H ) (OA ) a 1.8 (HOA ) 0.050 (H ) 9.5 mol ph lg (H ).0. 解 :(1)pH 1.00 (H ) 0.mol ph.00 (H ) 0.0mol 等体积混合后 :(H ) (0.mol
第 章酸碱反应和沉淀反应习题参考答案 解 :(1)pHlg (H )1.00 ()0.050mol HOA 溶液中, HOA H OA 平 /(mol ) 0.050 (H ) (OA ) a 1.8 (HOA ) 0.050 (H ) 9.5 mol ph lg (H ).0. 解 :(1)pH 1.00 (H ) 0.mol ph.00 (H ) 0.0mol 等体积混合后 :(H ) (0.mol
 张红丽 等 部分功能域基因的原核表达与分析 第6期 发表序列 AY819650 同源性为 100 与国外 10 株 同源性为 98畅 8 有 13 个碱基发生了突 变 其中 4 个是有意义的突变 这 4 个有意义的 突变分别为第 257 位 T C 第 505 位 A C 第 908 位 A G 第 1012 位 G C 图 4 这些差异可 能是捻转血矛线虫株间存在地域差异所致 2畅 5 HPS 原核表达与鉴定
张红丽 等 部分功能域基因的原核表达与分析 第6期 发表序列 AY819650 同源性为 100 与国外 10 株 同源性为 98畅 8 有 13 个碱基发生了突 变 其中 4 个是有意义的突变 这 4 个有意义的 突变分别为第 257 位 T C 第 505 位 A C 第 908 位 A G 第 1012 位 G C 图 4 这些差异可 能是捻转血矛线虫株间存在地域差异所致 2畅 5 HPS 原核表达与鉴定
第四章 蛋白质的营养
 第 四 章 蛋 白 质 的 营 养 蛋 白 质 一 词, 源 于 希 腊 字 Proteios, 其 意 是 最 初 的 第 一 重 要 的 ; 蛋 白 质 是 细 胞 的 重 要 组 成 成 份, 在 生 命 过 程 中 起 着 重 要 的 作 用, 涉 及 动 物 代 谢 的 大 部 分 与 生 命 攸 关 的 化 学 反 应 不 同 种 类 动 物 都 有 自 己 特 定 的 多 种 不 同
第 四 章 蛋 白 质 的 营 养 蛋 白 质 一 词, 源 于 希 腊 字 Proteios, 其 意 是 最 初 的 第 一 重 要 的 ; 蛋 白 质 是 细 胞 的 重 要 组 成 成 份, 在 生 命 过 程 中 起 着 重 要 的 作 用, 涉 及 动 物 代 谢 的 大 部 分 与 生 命 攸 关 的 化 学 反 应 不 同 种 类 动 物 都 有 自 己 特 定 的 多 种 不 同
 黄寿松等 儿种植物中的过氧化物酶同工酶分析 图版 两种不同凝胶系统同工酶谱的比较 7 凝胶系统分离的酶谱 V 0 凝胶系统分离的酶谱 材料 一高梁 亨加利 发芽 3天的全苗 V一水稻 银坊 发芽 4天的全苗 2 正极向电泳时过硫酸 按 澳 酚蓝 和过氧化物 酶同工酶 带的位置 a 同工酶带 b 澳酚蓝 c 过硫酸按 材料 高梁 亨加利 发芽 6天的全苗 3 预电泳和未预电泳凝胶分离的酶谱比较 一未预电泳凝胶分离的同工酶谱
黄寿松等 儿种植物中的过氧化物酶同工酶分析 图版 两种不同凝胶系统同工酶谱的比较 7 凝胶系统分离的酶谱 V 0 凝胶系统分离的酶谱 材料 一高梁 亨加利 发芽 3天的全苗 V一水稻 银坊 发芽 4天的全苗 2 正极向电泳时过硫酸 按 澳 酚蓝 和过氧化物 酶同工酶 带的位置 a 同工酶带 b 澳酚蓝 c 过硫酸按 材料 高梁 亨加利 发芽 6天的全苗 3 预电泳和未预电泳凝胶分离的酶谱比较 一未预电泳凝胶分离的同工酶谱
 生命科学研究 房 蓓 武泰存 王景安 以玉米沈单 号为材料 用溶液培养的方法研究了缺锌 低锌和正常供锌对玉米生长发育的影响 进一步明确了一定量低锌比缺锌对玉米的伤害更大 并对其 同工酶谱及蛋白质表达进行了分析 结果表明 一定浓度的低锌培养使玉米生长受抑及受害最重 且地上部分比地下部分更敏感 低锌和缺锌处理时 种同工酶的酶谱和蛋白表达与正常供锌时均有明显的差异 尤其在一定量低锌浓度时 有些同工酶的表达增强或被特异性诱导
生命科学研究 房 蓓 武泰存 王景安 以玉米沈单 号为材料 用溶液培养的方法研究了缺锌 低锌和正常供锌对玉米生长发育的影响 进一步明确了一定量低锌比缺锌对玉米的伤害更大 并对其 同工酶谱及蛋白质表达进行了分析 结果表明 一定浓度的低锌培养使玉米生长受抑及受害最重 且地上部分比地下部分更敏感 低锌和缺锌处理时 种同工酶的酶谱和蛋白表达与正常供锌时均有明显的差异 尤其在一定量低锌浓度时 有些同工酶的表达增强或被特异性诱导
 CH2OHCHOH4 CHO + 2[AgNH 32 ]OH 6CO + 6H O C H O + 6O 2 2 6 12 6 2 H+ C H O n +nh O nc H O 6 10 5 2 6 12 6 ù 6 10 5 2 6 12 6 C H O n + nh O nc H O C H O C H OH + O 2C H OH + 2CO 6 12 6 2 5 2 CH COOH +
CH2OHCHOH4 CHO + 2[AgNH 32 ]OH 6CO + 6H O C H O + 6O 2 2 6 12 6 2 H+ C H O n +nh O nc H O 6 10 5 2 6 12 6 ù 6 10 5 2 6 12 6 C H O n + nh O nc H O C H O C H OH + O 2C H OH + 2CO 6 12 6 2 5 2 CH COOH +
蛋白质的吸附、变性和膜污染.ppt
 蛋白质的吸附 变性及污染防治 引起通量下降的主要原因 蛋白质的吸附过程 膜过程的污染防治与清洗 引起通量下降的原因 时间 通量 蛋白质的一般性质 蛋白质是由许多氨基酸通过肽键相连而成的高分子物质, 各种蛋白质中氨基酸的组成排列顺序和肽链的立体结构都各不相同 蛋白质分子中氨基酸残基的连接方式和排列顺序就是蛋白质的化学结构 ( 也叫一级结构 ) 其中 R 1,R 2,R 3,R 4 代表各种氨基酸含有不同基团的侧链,
蛋白质的吸附 变性及污染防治 引起通量下降的主要原因 蛋白质的吸附过程 膜过程的污染防治与清洗 引起通量下降的原因 时间 通量 蛋白质的一般性质 蛋白质是由许多氨基酸通过肽键相连而成的高分子物质, 各种蛋白质中氨基酸的组成排列顺序和肽链的立体结构都各不相同 蛋白质分子中氨基酸残基的连接方式和排列顺序就是蛋白质的化学结构 ( 也叫一级结构 ) 其中 R 1,R 2,R 3,R 4 代表各种氨基酸含有不同基团的侧链,
<4D F736F F F696E74202D20B5DAD2BBBDDA20B0B1BBF9CBE1D3EBB5B0B0D7D6CAB5C4D2BBBCB6BDE1B9B92E >
 蛋白质的结构 第一章蛋白质 第一节氨基酸与蛋白质的一级结构 氨基酸 第二节蛋白质的二级结构和纤维状蛋白质 肽平面 第三节蛋白质的三级结构和肌红蛋白 结构域 超二级结构 第四节蛋白质的四级结构和血红蛋白 亚基 第一节氨基酸和蛋白质的一级结构 一 常见蛋白质氨基酸的结构通式 案例 1: 从生物化学角度, 为什么猫要吃老鼠? (1) 猫自身不能合成牛磺酸, 而老鼠和鱼的体内含有丰富的牛磺酸 (2) 如果猫缺乏牛磺酸会怎样?
蛋白质的结构 第一章蛋白质 第一节氨基酸与蛋白质的一级结构 氨基酸 第二节蛋白质的二级结构和纤维状蛋白质 肽平面 第三节蛋白质的三级结构和肌红蛋白 结构域 超二级结构 第四节蛋白质的四级结构和血红蛋白 亚基 第一节氨基酸和蛋白质的一级结构 一 常见蛋白质氨基酸的结构通式 案例 1: 从生物化学角度, 为什么猫要吃老鼠? (1) 猫自身不能合成牛磺酸, 而老鼠和鱼的体内含有丰富的牛磺酸 (2) 如果猫缺乏牛磺酸会怎样?
多肽知识手册.doc
 多 肽 基 础 知 识 问 答 目 录 1. 什 么 是 多 肽? 2. 多 肽 的 来 源 有 哪 些? 3. 多 肽 的 保 存 应 该 注 意 的 因 素? 4. 多 肽 怎 样 溶 解? 5. 多 肽 的 纯 度 测 定 6. 多 肽 的 纯 度 和 多 肽 的 净 含 量 的 区 别? 7. 冻 干 粉 状 多 肽 除 了 净 含 量 外, 还 包 含 哪 些 物 质? 8. 多 肽 的
多 肽 基 础 知 识 问 答 目 录 1. 什 么 是 多 肽? 2. 多 肽 的 来 源 有 哪 些? 3. 多 肽 的 保 存 应 该 注 意 的 因 素? 4. 多 肽 怎 样 溶 解? 5. 多 肽 的 纯 度 测 定 6. 多 肽 的 纯 度 和 多 肽 的 净 含 量 的 区 别? 7. 冻 干 粉 状 多 肽 除 了 净 含 量 外, 还 包 含 哪 些 物 质? 8. 多 肽 的
<4D6963726F736F667420576F7264202D203130332D322DA57CA7DEA447B14D2DBDC3A5CDBB50C540B27AC3FEB14DA440B8D5C344>
 103- 衛 生 與 護 理 類 專 業 科 目 ( 一 ) 1. 有 關 原 始 生 物 起 源 的 演 化 大 方 向 中, 下 列 何 者 正 確? (A) 由 好 氧 厭 氧 (B) 由 構 造 複 雜 構 造 簡 單 (C) 由 異 營 自 營 (D) 由 多 細 胞 單 細 胞. 植 物 的 莖 頂 及 根 尖 細 胞 利 用 能 量 進 行 細 胞 分 裂, 與 下 列 何 種 生 命
103- 衛 生 與 護 理 類 專 業 科 目 ( 一 ) 1. 有 關 原 始 生 物 起 源 的 演 化 大 方 向 中, 下 列 何 者 正 確? (A) 由 好 氧 厭 氧 (B) 由 構 造 複 雜 構 造 簡 單 (C) 由 異 營 自 營 (D) 由 多 細 胞 單 細 胞. 植 物 的 莖 頂 及 根 尖 細 胞 利 用 能 量 進 行 細 胞 分 裂, 與 下 列 何 種 生 命
<4D F736F F F696E74202D20C9FAC3FCB7D6CEF6BBAFD1A72D352D312E BBCE6C8DDC4A3CABD5D>
 什么是蛋白质? 蛋白质 (protein) 是由多个氨基酸 (amino acids) 通过肽键 (peptide bond) 相连形成的大分子含氮化合物 氨基酸和蛋白质分析 蛋白质的组成 : 蛋白质由很多的 AA 单体以肽键结合而成的具有一定空间结构的含氮有机化合物, 有的含有 P S Cu Fe I 等元素, 分子量高达数万 ~ 数百万 含氮是蛋白质区别于其它有机化合物的主要标志 蛋白质系数 :
什么是蛋白质? 蛋白质 (protein) 是由多个氨基酸 (amino acids) 通过肽键 (peptide bond) 相连形成的大分子含氮化合物 氨基酸和蛋白质分析 蛋白质的组成 : 蛋白质由很多的 AA 单体以肽键结合而成的具有一定空间结构的含氮有机化合物, 有的含有 P S Cu Fe I 等元素, 分子量高达数万 ~ 数百万 含氮是蛋白质区别于其它有机化合物的主要标志 蛋白质系数 :
.., + +, +, +, +, +, +,! # # % ( % ( / 0!% ( %! %! % # (!) %!%! # (!!# % ) # (!! # )! % +,! ) ) &.. 1. # % 1 ) 2 % 2 1 #% %! ( & # +! %, %. #( # ( 1 (
 ! # %! % &! # %#!! #! %!% &! # (!! # )! %!! ) &!! +!( ), ( .., + +, +, +, +, +, +,! # # % ( % ( / 0!% ( %! %! % # (!) %!%! # (!!# % ) # (!! # )! % +,! ) ) &.. 1. # % 1 ) 2 % 2 1 #% %! ( & # +! %, %. #(
! # %! % &! # %#!! #! %!% &! # (!! # )! %!! ) &!! +!( ), ( .., + +, +, +, +, +, +,! # # % ( % ( / 0!% ( %! %! % # (!) %!%! # (!!# % ) # (!! # )! % +,! ) ) &.. 1. # % 1 ) 2 % 2 1 #% %! ( & # +! %, %. #(
# % & ) ) & + %,!# & + #. / / & ) 0 / 1! 2
 !!! #! # % & ) ) & + %,!# & + #. / / & ) 0 / 1! 2 % ) 1 1 3 1 4 5 % #! 2! 1,!!! /+, +!& 2! 2! / # / 6 2 6 3 1 2 4 # / &!/ % ). 1!!! &! & 7 2 7! 7 6 7 3 & 1 2 % # ) / / 8 2 6,!!! /+, +! & 2 9! 3 1!! % %
!!! #! # % & ) ) & + %,!# & + #. / / & ) 0 / 1! 2 % ) 1 1 3 1 4 5 % #! 2! 1,!!! /+, +!& 2! 2! / # / 6 2 6 3 1 2 4 # / &!/ % ). 1!!! &! & 7 2 7! 7 6 7 3 & 1 2 % # ) / / 8 2 6,!!! /+, +! & 2 9! 3 1!! % %
绪论
 动 物 营 养 学 教 案 (2004 版 ) 主 讲 教 师 : 陈 代 文 教 授 王 康 宁 教 授 周 安 国 教 授 张 克 英 教 授 周 小 秋 教 授 授 课 专 业 : 动 物 科 学 草 学 动 物 生 物 技 术 学 时 :60 1 绪 论 目 的 要 求 掌 握 营 养 与 营 养 学 的 概 念 动 物 营 养 学 的 目 的 与 任 务 ; 了 解 动 物 营 养 在 动
动 物 营 养 学 教 案 (2004 版 ) 主 讲 教 师 : 陈 代 文 教 授 王 康 宁 教 授 周 安 国 教 授 张 克 英 教 授 周 小 秋 教 授 授 课 专 业 : 动 物 科 学 草 学 动 物 生 物 技 术 学 时 :60 1 绪 论 目 的 要 求 掌 握 营 养 与 营 养 学 的 概 念 动 物 营 养 学 的 目 的 与 任 务 ; 了 解 动 物 营 养 在 动
PowerPoint ²³ø
 1. ( prokaryotic cell ) ( nucleus ) ( bacteria ) ( Escherichia coli ) 2. (eukaryotic cell ) ( nucleus ) ( fungi ) ( yeast ) (nucleotide) S (pentose) B (nitrogenous base) P (phosphate group) (pentose)
1. ( prokaryotic cell ) ( nucleus ) ( bacteria ) ( Escherichia coli ) 2. (eukaryotic cell ) ( nucleus ) ( fungi ) ( yeast ) (nucleotide) S (pentose) B (nitrogenous base) P (phosphate group) (pentose)
2016 暨南大学 713 生物化学 B 考研专业课复习全书 编辑推荐 五洲暨大考研网是聚英教育旗下子品牌, 专业做暨南大学考研专业课辅导资料, 以其严谨 专业 信息精准等广受考研学子称赞 五洲暨大考研网秉持专注 责任 诚信原则, 倾情推出了 暨南大学考研专业课复习全书 系列丛书, 本书系统全面总结
 五洲暨大考研网坚持 专业人做专业事, 为广大考研学子奉献 专业作品! 推荐指数 : 基本信息 教材名称 2016 暨南大学 713 生物化学 B 考研专业课复习全书 ( 含真题与答案 ) 编著 聚英教育组编 页数 455 页 字数 358 千字 开本 16 开 出版日期 2015 年 3 月 购买网址 http://www.passjnu.com/product-168.aspx 咨询电话 :0592-2060051,2060052
五洲暨大考研网坚持 专业人做专业事, 为广大考研学子奉献 专业作品! 推荐指数 : 基本信息 教材名称 2016 暨南大学 713 生物化学 B 考研专业课复习全书 ( 含真题与答案 ) 编著 聚英教育组编 页数 455 页 字数 358 千字 开本 16 开 出版日期 2015 年 3 月 购买网址 http://www.passjnu.com/product-168.aspx 咨询电话 :0592-2060051,2060052
 第 八 章 蛋 白 质 的 酶 促 降 解 和 氨 基 酸 代 谢 第 一 节 蛋 白 质 的 酶 促 降 解 第 二 节 氨 基 酸 的 分 解 与 转 化 第 三 节 氨 及 氨 基 酸 的 生 物 合 成 本 章 重 点 难 点 : 1 氨 基 酸 的 脱 氨 基 作 用 方 式 及 作 用 机 制 2 α 酮 酸 的 代 谢 方 式 3 体 内 氨 的 来 源 和 氨 的 转 运 4 一 碳
第 八 章 蛋 白 质 的 酶 促 降 解 和 氨 基 酸 代 谢 第 一 节 蛋 白 质 的 酶 促 降 解 第 二 节 氨 基 酸 的 分 解 与 转 化 第 三 节 氨 及 氨 基 酸 的 生 物 合 成 本 章 重 点 难 点 : 1 氨 基 酸 的 脱 氨 基 作 用 方 式 及 作 用 机 制 2 α 酮 酸 的 代 谢 方 式 3 体 内 氨 的 来 源 和 氨 的 转 运 4 一 碳
+
 ~ 1 ~ ~ 2 ~ 1-1 UHPLC-SEC 法对治疗性抗体的分析 TSKgel UP-SW3 UHPLC HPLC A TSKgel UP-SW3 2 μm (4.6 mm ID. 15 cm B UHPLC-SEC 1.7 μm (4.6 mm ID. 15 cm mmol/l (ph 6.7 + 2SO4 mmol/l Na +.5 % NaN3.35 ml/ 25 UV 28 nm 5
~ 1 ~ ~ 2 ~ 1-1 UHPLC-SEC 法对治疗性抗体的分析 TSKgel UP-SW3 UHPLC HPLC A TSKgel UP-SW3 2 μm (4.6 mm ID. 15 cm B UHPLC-SEC 1.7 μm (4.6 mm ID. 15 cm mmol/l (ph 6.7 + 2SO4 mmol/l Na +.5 % NaN3.35 ml/ 25 UV 28 nm 5
<4D F736F F F696E74202D20312DC9FABBAFBCBCCAF5D0F7C2DB205BD6BBB6C15D>
 生物化学技术 Biochemical technique 倪培华 http://www.shsmu.edu.cn/ 定义研究生物体的化学组成 结构 功能以及在生命活动中化学物质的代谢 调节控制等的实验方法 Chapter 1 分离生物大分子的制备法 Separation method for the preparation of biological macromolecules 分离 电泳 (Electrophoresis)
生物化学技术 Biochemical technique 倪培华 http://www.shsmu.edu.cn/ 定义研究生物体的化学组成 结构 功能以及在生命活动中化学物质的代谢 调节控制等的实验方法 Chapter 1 分离生物大分子的制备法 Separation method for the preparation of biological macromolecules 分离 电泳 (Electrophoresis)
第一章 前言
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 21%?? 18% 6 78 6% 8% 10% 12% 16% 38 39 98% 92% 72% 50% 25% 6 5 4 3 2 1 100 90 80 60 70 50 40 30 20
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 21%?? 18% 6 78 6% 8% 10% 12% 16% 38 39 98% 92% 72% 50% 25% 6 5 4 3 2 1 100 90 80 60 70 50 40 30 20
第 章 氨基酸、蛋白质、核酸
 第十六章蛋白质和核酸 知识目标 熟悉氨基酸 蛋白质的结构和命名 掌握氨基酸 蛋白质的性质 第一节蛋白质的化学组成 一 蛋白质的元素组成根据对蛋白质的元素分析表明 : 碳 50%~55% 氢 6%~8% 氧 19%~24% 氮 13%~19% 除此四种元素外, 大多数蛋白质还含有硫, 有的还含有磷 碘等 一切蛋白质均含有氮, 并 且大多数蛋白质含氮量比较接近, 平均 16%, 这是蛋白质元素组成的一个重要特点
第十六章蛋白质和核酸 知识目标 熟悉氨基酸 蛋白质的结构和命名 掌握氨基酸 蛋白质的性质 第一节蛋白质的化学组成 一 蛋白质的元素组成根据对蛋白质的元素分析表明 : 碳 50%~55% 氢 6%~8% 氧 19%~24% 氮 13%~19% 除此四种元素外, 大多数蛋白质还含有硫, 有的还含有磷 碘等 一切蛋白质均含有氮, 并 且大多数蛋白质含氮量比较接近, 平均 16%, 这是蛋白质元素组成的一个重要特点
untitled
 1-1 1-2 1-3 1-4 1-5 1-6 1-7 01 1-8 1-1 1-2 1. 2. 3. 4. 5. 6. 1-3 1-4 2 01 1-5 1 (Teaspoon, t) = 5 g 1 (Tablespoon, T) = 15 g 1 (Cup, C) = 240 g = 16 T 1 = 500 g 1 = 600 g = 16 1 = 37.5 g 1 (Pound, lb)
1-1 1-2 1-3 1-4 1-5 1-6 1-7 01 1-8 1-1 1-2 1. 2. 3. 4. 5. 6. 1-3 1-4 2 01 1-5 1 (Teaspoon, t) = 5 g 1 (Tablespoon, T) = 15 g 1 (Cup, C) = 240 g = 16 T 1 = 500 g 1 = 600 g = 16 1 = 37.5 g 1 (Pound, lb)
10 生物有机化合物
 10 生 物 有 机 化 合 物 内 容 提 要 糖 氨 基 酸 蛋 白 质 核 酸 等 是 生 命 中 不 可 缺 少 的 物 质, 了 解 这 类 生 物 有 机 化 合 物 的 结 构 极 其 性 能 是 非 常 重 要 的 本 章 主 要 介 绍 碳 水 化 合 物 氨 基 酸 蛋 白 质 核 酸 的 基 本 知 识 学 会 利 用 前 面 所 学 的 有 机 化 学 知 识 来 处 理 生
10 生 物 有 机 化 合 物 内 容 提 要 糖 氨 基 酸 蛋 白 质 核 酸 等 是 生 命 中 不 可 缺 少 的 物 质, 了 解 这 类 生 物 有 机 化 合 物 的 结 构 极 其 性 能 是 非 常 重 要 的 本 章 主 要 介 绍 碳 水 化 合 物 氨 基 酸 蛋 白 质 核 酸 的 基 本 知 识 学 会 利 用 前 面 所 学 的 有 机 化 学 知 识 来 处 理 生
Microsoft Word 陈伟婵-二校
 6 10 Vol. 6 No. 10 2015 10 Journal of Food Safety and Quality Oct., 2015 陈伟婵 1 1,, 曾少葵 2*, 吴文龙 (1., 524088; 2. ( ), 524088) 1 摘要 : 目的 (Chlamys nobilis) 方法 -18, 结果 60 d,,, 81% 结论 -18 60 d,, 关键词 : ; ; Effect
6 10 Vol. 6 No. 10 2015 10 Journal of Food Safety and Quality Oct., 2015 陈伟婵 1 1,, 曾少葵 2*, 吴文龙 (1., 524088; 2. ( ), 524088) 1 摘要 : 目的 (Chlamys nobilis) 方法 -18, 结果 60 d,,, 81% 结论 -18 60 d,, 关键词 : ; ; Effect
 Fe O + 3CO = 2Fe + 3CO 2 3 2 160 256 1500 x 160 1500 = 2 56 x 2 = 56 1500 x 160 = 1050 x x 100 12 38 12 100 38 316 = = =. x x 1000 37 2 137 2 37 2 1000 137 2 271 = = =.... 36 100 40 100 40 36
Fe O + 3CO = 2Fe + 3CO 2 3 2 160 256 1500 x 160 1500 = 2 56 x 2 = 56 1500 x 160 = 1050 x x 100 12 38 12 100 38 316 = = =. x x 1000 37 2 137 2 37 2 1000 137 2 271 = = =.... 36 100 40 100 40 36
46 33 (1 6 )40 min ; 20.1% 0.2mol/L 20 min(1 4 ) ; 75 5h6000r/min 10min 2.2 阿胶的提取 d min min(1 6 ) % 2.3 低铁饲料的配制 AIN-93M
 33 2 2014 4 CHINESE JOURNAL OF MARINE DRUGS Vol.33 No.2 April2014 * * ( 266003) : 从罗非鱼皮中提取了明胶 并以驴皮中提取的阿胶为阳性对照 在对比研究两者理化性质的基础上 研究了两者对缺铁性贫血的改善效果 采用饲喂低铁饲料辅助尾静脉放血的方法制备大鼠缺铁 性贫血模型 灌胃不同剂量的阿胶和罗非鱼皮明胶 罗非鱼明胶和阿胶的紫外最大吸收峰都在
33 2 2014 4 CHINESE JOURNAL OF MARINE DRUGS Vol.33 No.2 April2014 * * ( 266003) : 从罗非鱼皮中提取了明胶 并以驴皮中提取的阿胶为阳性对照 在对比研究两者理化性质的基础上 研究了两者对缺铁性贫血的改善效果 采用饲喂低铁饲料辅助尾静脉放血的方法制备大鼠缺铁 性贫血模型 灌胃不同剂量的阿胶和罗非鱼皮明胶 罗非鱼明胶和阿胶的紫外最大吸收峰都在
 第一章 图 1 1 传染病的特征 9 T h1 T h2 细胞调节机制简图 正调节 负调节 细胞因子与细菌的相互作用机制目前尚未完全明了 有实验表明 细胞因子与细菌之间 存在有互利和互抑双重效应 例如 T N Fα 和 IFNγ 可抑制放线菌的生长而 IL 6 的作用则 反之 IL 1 2 和 GM CSF 可促进某些致病性大肠杆菌生长而 IL 1ra 可抑制之 研究表 明 某些致病性大肠杆菌有与
第一章 图 1 1 传染病的特征 9 T h1 T h2 细胞调节机制简图 正调节 负调节 细胞因子与细菌的相互作用机制目前尚未完全明了 有实验表明 细胞因子与细菌之间 存在有互利和互抑双重效应 例如 T N Fα 和 IFNγ 可抑制放线菌的生长而 IL 6 的作用则 反之 IL 1 2 和 GM CSF 可促进某些致病性大肠杆菌生长而 IL 1ra 可抑制之 研究表 明 某些致病性大肠杆菌有与
Microsoft Word - 多肽水解氨基酸测定 doc
 测试报告 样品信息 样品名称 多肽水解氨基酸测定 编号 W20140504-001 样品重量 \ 剂型 \ 收样日期 2014/05/04 测试期间 2014/05/04-05/08 样品描述 测试需求 测试成分 含测 参考标准 参考标准高效液相色谱法标样有 仪器信息 测试仪器高效液相色谱仪仪器型号安捷伦 1260 色谱条件 : 色谱柱 : 流动相 : 检测波长 : 月旭 Amino Acid,4.6
测试报告 样品信息 样品名称 多肽水解氨基酸测定 编号 W20140504-001 样品重量 \ 剂型 \ 收样日期 2014/05/04 测试期间 2014/05/04-05/08 样品描述 测试需求 测试成分 含测 参考标准 参考标准高效液相色谱法标样有 仪器信息 测试仪器高效液相色谱仪仪器型号安捷伦 1260 色谱条件 : 色谱柱 : 流动相 : 检测波长 : 月旭 Amino Acid,4.6
《生命科学概论》讲义
 第二章 生物的化学组成 教学要求 : 生命的一个共同特征的化学成学的同一性, 即生物体具有相同的元素组成, 具有相同的构建生命的功能和结构单位 细胞的生物大分子种类, 生物大分子有相同的单体组成, 蛋白质的单体包括相同的 20 种氨基酸, 核酸包括 8 种核苷酸 基于这种同一性, 在分子层次上了解 探索生命成为目前生命科学的研究重点, 例如人类基因组计划的实施, 就是要对人类的遗传信息的载体 DNA
第二章 生物的化学组成 教学要求 : 生命的一个共同特征的化学成学的同一性, 即生物体具有相同的元素组成, 具有相同的构建生命的功能和结构单位 细胞的生物大分子种类, 生物大分子有相同的单体组成, 蛋白质的单体包括相同的 20 种氨基酸, 核酸包括 8 种核苷酸 基于这种同一性, 在分子层次上了解 探索生命成为目前生命科学的研究重点, 例如人类基因组计划的实施, 就是要对人类的遗传信息的载体 DNA
第七章蛋白质的酶促 降解和 AA 代谢 第一节 蛋白质的酶促降解 食物中摄取的 Pr 组成机体细胞的 Pr Pr 水解 E AA 细胞内合成的 Pr 肽酶 蛋白酶
 第七章蛋白质的酶促 降解和 AA 代谢 第一节 蛋白质的酶促降解 第二节 AA 的分解与转化 第三节 氨基酸的生物合成 第七章蛋白质的酶促 降解和 AA 代谢 第一节 蛋白质的酶促降解 食物中摄取的 Pr 组成机体细胞的 Pr Pr 水解 E AA 细胞内合成的 Pr 肽酶 蛋白酶 一 肽酶 肽酶 : 肽链外切酶, 可分别从多肽链的游离羧基端或游离氨基端逐个水解 AA 的 E 氨肽酶 : 从多肽链氨基端逐个水解
第七章蛋白质的酶促 降解和 AA 代谢 第一节 蛋白质的酶促降解 第二节 AA 的分解与转化 第三节 氨基酸的生物合成 第七章蛋白质的酶促 降解和 AA 代谢 第一节 蛋白质的酶促降解 食物中摄取的 Pr 组成机体细胞的 Pr Pr 水解 E AA 细胞内合成的 Pr 肽酶 蛋白酶 一 肽酶 肽酶 : 肽链外切酶, 可分别从多肽链的游离羧基端或游离氨基端逐个水解 AA 的 E 氨肽酶 : 从多肽链氨基端逐个水解
<4D F736F F F696E74202D203720B7D6D7D3C9FACEEFD1A720B5DACBC4D5C2206D524E41B5C4B7ADD2EB20C3DCC2EBD7D3BACD74524E412E >
 分子生物学 第四章生物信息的传递 ( 下 ) 从 RNA 到蛋白质 第一节遗传密码 三联子第二节 TRNA 第三节核糖体 夏玉琼 10/18/2017 2 中心法则 http://jpkc.szpt.edu.cn/2007/swhx/resource_content.asp?id=1619 3 从 RNA 到蛋白质 :mrna 翻译成蛋白质 mrna trna 核糖体 (ribosome) https://www.news-medical.net/life-sciences/dna-translation.aspx
分子生物学 第四章生物信息的传递 ( 下 ) 从 RNA 到蛋白质 第一节遗传密码 三联子第二节 TRNA 第三节核糖体 夏玉琼 10/18/2017 2 中心法则 http://jpkc.szpt.edu.cn/2007/swhx/resource_content.asp?id=1619 3 从 RNA 到蛋白质 :mrna 翻译成蛋白质 mrna trna 核糖体 (ribosome) https://www.news-medical.net/life-sciences/dna-translation.aspx
 福建农林大学硕士学位论文番茄抗叶霉菌相关基因的鉴定及 TRV 16K 基因的功能分析姓名 : 郑璐平申请学位级别 : 硕士专业 : 分子病毒学指导教师 : 吴祖建 ; 蔡新忠 20070401 番茄抗叶霉菌相关基因的鉴定及 TRV 16K 基因的功能分析 作者 : 郑璐平
福建农林大学硕士学位论文番茄抗叶霉菌相关基因的鉴定及 TRV 16K 基因的功能分析姓名 : 郑璐平申请学位级别 : 硕士专业 : 分子病毒学指导教师 : 吴祖建 ; 蔡新忠 20070401 番茄抗叶霉菌相关基因的鉴定及 TRV 16K 基因的功能分析 作者 : 郑璐平
7 北京大学学报 医学版 # +94* 4 ' % 论著!! "# $ #% %"&!%'!! $ "( )& * $ +,-.)/ ) 01 " * ). " 2")3 )01 ( /" 433% /1 " 0 "51 " -.)/$ 6',)") 4.))%) 0
 论著!! "# $ #% %"&!%'!! $ "( )& * $ +,-.)/ ) 01 " * ). " 2")3 )01 ( /" 433% /1 " 0 "51 " -.)/$ 6',)") 4.))%) 0 ".. " - 23 )"." ( ).)") 4. " ' $ 7 " #$%"$8 &' + +." 0"3 / 3 3( 0 ) %.% "(% 2). +.) ")( ) (
论著!! "# $ #% %"&!%'!! $ "( )& * $ +,-.)/ ) 01 " * ). " 2")3 )01 ( /" 433% /1 " 0 "51 " -.)/$ 6',)") 4.))%) 0 ".. " - 23 )"." ( ).)") 4. " ' $ 7 " #$%"$8 &' + +." 0"3 / 3 3( 0 ) %.% "(% 2). +.) ")( ) (
儿科学 儿科学 儿科学 儿科学 儿科学 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 儿科学 ( 专业学位 ) 耳鼻咽喉科学 ( 专业学位 ) 非定向 全国统考
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生上线考生名单 准考证号 报考专业 外语政治 业务 1 业务 2 总分 报考类别 考试方式 备注 103357000912484 72 72 242 0 386 非定向 全国统考 103357000912003 71 72 242 0 385 非定向 全国统考 103357000911503 77 73 234 0 384 非定向 全国统考 103357000911098
2016 暨南大学 712 生物化学 A 考研专业课复习全书 编辑推荐 五洲暨大考研网是聚英教育旗下子品牌, 专业做暨南大学考研专业课辅导资料, 以其严谨 专业 信息精准等广受考研学子称赞 五洲暨大考研网秉持专注 责任 诚信原则, 倾情推出了 暨南大学考研专业课复习全书 系列丛书, 本书系统全面总结
 五洲暨大考研网坚持 专业人做专业事, 为广大考研学子奉献 专业作品! 推荐指数 : 基本信息 教材名称 2016 暨南大学 712 生物化学 A 考研专业课复习全书 ( 含真题与答案 ) 编著 聚英教育组编 页数 445 页 字数 288 千字 开本 16 开 出版日期 2015 年 3 月 购买网址 http://www.passjnu.com/product-113.aspx 咨询电话 :0592-2060051,2060052
五洲暨大考研网坚持 专业人做专业事, 为广大考研学子奉献 专业作品! 推荐指数 : 基本信息 教材名称 2016 暨南大学 712 生物化学 A 考研专业课复习全书 ( 含真题与答案 ) 编著 聚英教育组编 页数 445 页 字数 288 千字 开本 16 开 出版日期 2015 年 3 月 购买网址 http://www.passjnu.com/product-113.aspx 咨询电话 :0592-2060051,2060052
错误折叠与蛋白质构象病
 错误折叠与蛋白质构象病 生物物理系 2005 级硕士研究生刘莹 摘要 : 许多疾病的发生是由蛋白质错误折叠引起的, 这类疾病被称为蛋白质错误折叠病 蛋白质突变 泛素 - 蛋白酶和自噬功能的失常与蛋白质错误折叠的发生, 异常蓄积和聚集有关 本文综述了蛋白质错误折叠和聚集的机制和部分蛋白质构象病产生的机理 关键词 : 蛋白质错误折叠 ; 分子伴侣 ; 泛素 - 蛋白酶系统 ; 溶酶体途径 ;Prion;
错误折叠与蛋白质构象病 生物物理系 2005 级硕士研究生刘莹 摘要 : 许多疾病的发生是由蛋白质错误折叠引起的, 这类疾病被称为蛋白质错误折叠病 蛋白质突变 泛素 - 蛋白酶和自噬功能的失常与蛋白质错误折叠的发生, 异常蓄积和聚集有关 本文综述了蛋白质错误折叠和聚集的机制和部分蛋白质构象病产生的机理 关键词 : 蛋白质错误折叠 ; 分子伴侣 ; 泛素 - 蛋白酶系统 ; 溶酶体途径 ;Prion;
魟 鱼 肝 铁 蛋 白 和 马 脾 铁 蛋 白 经
 林 青 陈 平 季 学 涛 柯 才 焕 黄 河 清 魟 鱼 肝 铁 蛋 白 和 马 脾 铁 蛋 白 经 210 分析化学 第 38卷 图 2 在不同 ph 条件下 SZLF的透射电子 显微镜图 (弱酸处理 ) F ig. 2 TEM m ap o f SZLF under the condition o f d iffe rent ph ( trea tm ent of w eak ac id ity
林 青 陈 平 季 学 涛 柯 才 焕 黄 河 清 魟 鱼 肝 铁 蛋 白 和 马 脾 铁 蛋 白 经 210 分析化学 第 38卷 图 2 在不同 ph 条件下 SZLF的透射电子 显微镜图 (弱酸处理 ) F ig. 2 TEM m ap o f SZLF under the condition o f d iffe rent ph ( trea tm ent of w eak ac id ity
第十三章 蛋白质的合成-翻译
 蛋白质的生物合成 --- 翻译 (translation) 翻译 ( 蛋白质的生物合成 ):) 以氨基酸氨基酸为原料 以 mrna 为模板 以 trna 为运载工具 以核糖体核糖体为合成场所 起始 延长 终止各阶段蛋白因子蛋白因子参与 合成后加工成为有活性蛋白质 2 第一节参与蛋白质生物合成的物质 氨基酸 mrna trna 核糖体 酶及蛋白质因子 ATP GTP 3 一 mrna 与遗传密码 遗传密码
蛋白质的生物合成 --- 翻译 (translation) 翻译 ( 蛋白质的生物合成 ):) 以氨基酸氨基酸为原料 以 mrna 为模板 以 trna 为运载工具 以核糖体核糖体为合成场所 起始 延长 终止各阶段蛋白因子蛋白因子参与 合成后加工成为有活性蛋白质 2 第一节参与蛋白质生物合成的物质 氨基酸 mrna trna 核糖体 酶及蛋白质因子 ATP GTP 3 一 mrna 与遗传密码 遗传密码
标题
 第 36 卷第 2 期西南大学学报 ( 自然科学版 ) 2014 年 2 月 Vol.36 No.2 JournalofSouthwestUniversity (NaturalScienceEdition) Feb. 2014 文章编号 :1673 9868(2014)2 0007 07 单链 PEG 化重组人干扰素 ω 1 的结构和性能表征 潘红春, 杨琴, 苏秋菊, 刘丽, 刘红 1. 西南大学药学院,
第 36 卷第 2 期西南大学学报 ( 自然科学版 ) 2014 年 2 月 Vol.36 No.2 JournalofSouthwestUniversity (NaturalScienceEdition) Feb. 2014 文章编号 :1673 9868(2014)2 0007 07 单链 PEG 化重组人干扰素 ω 1 的结构和性能表征 潘红春, 杨琴, 苏秋菊, 刘丽, 刘红 1. 西南大学药学院,
第 期 甘金华等 强力霉素人工抗原的合成与抗体制备 材料与方法 试剂及溶液
 第 卷第 期 年 月 食品与生物技术学报 强力霉素人工抗原的合成与抗体制备 甘金华 邓薇 李进平 艾晓辉 中国水产科学研究院长江水产研究所 湖北荆州 武汉纺织大学环境与城建学院 湖北武汉 采用改进的碳二亚胺两步法将强力霉素半抗原与载体蛋白 连接制备强力霉素 牛血清白蛋白 人工免疫抗原 并用同样方法将强力霉素与载体蛋白 连接制备人强力霉素 卵清白蛋白 人工包被抗原 经紫外扫描分析和动物免疫试验证实 强力霉素人工抗原合成成功
第 卷第 期 年 月 食品与生物技术学报 强力霉素人工抗原的合成与抗体制备 甘金华 邓薇 李进平 艾晓辉 中国水产科学研究院长江水产研究所 湖北荆州 武汉纺织大学环境与城建学院 湖北武汉 采用改进的碳二亚胺两步法将强力霉素半抗原与载体蛋白 连接制备强力霉素 牛血清白蛋白 人工免疫抗原 并用同样方法将强力霉素与载体蛋白 连接制备人强力霉素 卵清白蛋白 人工包被抗原 经紫外扫描分析和动物免疫试验证实 强力霉素人工抗原合成成功
Protein Structures
 Protein Structures Visualization 生物信息学导论 http://bis.zju.edu.cn/download/protein_structure/ 周银聪 foxandzhou@gmail.com Dec 21,2015 PDB Protein Data Bank Pymol From wikipedia 一级结构 一级结构 : 指多肽链中氨基酸的排列顺序, 每个氨基酸由肽键连接,
Protein Structures Visualization 生物信息学导论 http://bis.zju.edu.cn/download/protein_structure/ 周银聪 foxandzhou@gmail.com Dec 21,2015 PDB Protein Data Bank Pymol From wikipedia 一级结构 一级结构 : 指多肽链中氨基酸的排列顺序, 每个氨基酸由肽键连接,
<4D F736F F F696E74202D203720B7D6D7D3C9FACEEFD1A720B5DACBC4D5C2206D524E41B5C4B7ADD2EB20C3DCC2EBD7D3BACD74524E41>
 分子生物学 第四章生物信息的传递 ( 下 ) 从 RNA 到蛋白质 第一节遗传密码 三联子第二节 TRNA 第三节核糖体 夏玉琼 2013-09-17 2 中心法则 http://jpkc.szpt.edu.cn/2007/swhx/resource_content.asp?id=1619 3 DNA mrna 蛋白质 DNA 的复制 解旋 引发 复制 终止 mrna 的转录 模板识别 转录起始 转录延伸
分子生物学 第四章生物信息的传递 ( 下 ) 从 RNA 到蛋白质 第一节遗传密码 三联子第二节 TRNA 第三节核糖体 夏玉琼 2013-09-17 2 中心法则 http://jpkc.szpt.edu.cn/2007/swhx/resource_content.asp?id=1619 3 DNA mrna 蛋白质 DNA 的复制 解旋 引发 复制 终止 mrna 的转录 模板识别 转录起始 转录延伸
 价样 品 川 振 荡汉 取 叮 盛极 曲 的 示差 溶 出脉 具 体 方 法 见 有 机质 含 量 用 丘 林 法 测 定 沉积 物 的 矿 物 组 成 由 本 所 地质 室 测 数 据 由厦 门 大 学 海 洋 系 洪 家 珍 同志 提 供 三 各站 位 于表 谱 分析仪 进行 微 米膜 滤 后 分 斯 其 酿 可溶 部 分 的 含 鼠 零 用 冲测定 卷 报 分析 三 定 学 洋 海 表示 结
价样 品 川 振 荡汉 取 叮 盛极 曲 的 示差 溶 出脉 具 体 方 法 见 有 机质 含 量 用 丘 林 法 测 定 沉积 物 的 矿 物 组 成 由 本 所 地质 室 测 数 据 由厦 门 大 学 海 洋 系 洪 家 珍 同志 提 供 三 各站 位 于表 谱 分析仪 进行 微 米膜 滤 后 分 斯 其 酿 可溶 部 分 的 含 鼠 零 用 冲测定 卷 报 分析 三 定 学 洋 海 表示 结
PowerPoint 演示文稿
 生命科学导论 上海交通大学生命科学与技术学院 College of Life Science and Biotechnology Shanghai Jiao Tong University http://bioscience.sjtu.edu.cn 第二讲 构造生物体的基本元件 从生物小分子到生物大分子 一 生物小分子与生物大分子的关系二 生物小分子简介三 生物大分子的形成四 生物大分子的高级结构
生命科学导论 上海交通大学生命科学与技术学院 College of Life Science and Biotechnology Shanghai Jiao Tong University http://bioscience.sjtu.edu.cn 第二讲 构造生物体的基本元件 从生物小分子到生物大分子 一 生物小分子与生物大分子的关系二 生物小分子简介三 生物大分子的形成四 生物大分子的高级结构
第 期 牛文翰等 模板辅助合成氮掺杂的多孔碳基氧还原电催化剂的研究进展!"#$ %&' ' () * +,,,,,,( *,( - -, ( '+, *, -,,, +, ',,. /, ',,+, " $ 2 * ' /+ / / / (+ 5 (/(
 第 # 卷第 # 期 # 年 月 =2>3(8 &27& "432"? @543A B 1%&# &&&( %&# 8-*%&&# & - % # CD%1/)* / % # # & # 9&,%&# " &%&./01 &-. # 9& ; ##&&&&&&&&&&&&&&&&&&&&&&& ( -& ; # #; ; & &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& 9CC1/)*
第 # 卷第 # 期 # 年 月 =2>3(8 &27& "432"? @543A B 1%&# &&&( %&# 8-*%&&# & - % # CD%1/)* / % # # & # 9&,%&# " &%&./01 &-. # 9& ; ##&&&&&&&&&&&&&&&&&&&&&&& ( -& ; # #; ; & &&&&&&&&&&&&&&&&&&&&&&&&&&&&&&& 9CC1/)*
 大 学 化 学 第 卷 第 期 年 月 微 囊化技 术 在 生 物 医 学 中的 应 用 俞 耀 庭 陈 长 治 南 开 大学分 子 生物研 究 所 本 文 概 述 了微囊 固 定化技术基 本 应 用 原 理 摘要 的生 物 血液 相溶性 及 通透 性能 胞 在治 疗 肾 衰 肝 衰 及 清除 人体 内 中毒药物 般 性介 绍 微 囊 人 工 细 胞 的 一 般制 备方 法 各种 膜 材 料 对 人
大 学 化 学 第 卷 第 期 年 月 微 囊化技 术 在 生 物 医 学 中的 应 用 俞 耀 庭 陈 长 治 南 开 大学分 子 生物研 究 所 本 文 概 述 了微囊 固 定化技术基 本 应 用 原 理 摘要 的生 物 血液 相溶性 及 通透 性能 胞 在治 疗 肾 衰 肝 衰 及 清除 人体 内 中毒药物 般 性介 绍 微 囊 人 工 细 胞 的 一 般制 备方 法 各种 膜 材 料 对 人
632 第 32 卷 解性方面的研究 [4], 且研究的不够深入. 鉴于此, 文中对不同提取工艺制备的核桃蛋白的化学组成 亚基组成 二级结构 氨基酸组成进行研究和分析, 以期对今后核桃蛋白产品的加工提供参考. 1 材料与方法 1 1 材料与设备核桃购于新疆石河子市农贸市场, 为新疆簿皮核桃品种. 试
![632 第 32 卷 解性方面的研究 [4], 且研究的不够深入. 鉴于此, 文中对不同提取工艺制备的核桃蛋白的化学组成 亚基组成 二级结构 氨基酸组成进行研究和分析, 以期对今后核桃蛋白产品的加工提供参考. 1 材料与方法 1 1 材料与设备核桃购于新疆石河子市农贸市场, 为新疆簿皮核桃品种. 试 632 第 32 卷 解性方面的研究 [4], 且研究的不够深入. 鉴于此, 文中对不同提取工艺制备的核桃蛋白的化学组成 亚基组成 二级结构 氨基酸组成进行研究和分析, 以期对今后核桃蛋白产品的加工提供参考. 1 材料与方法 1 1 材料与设备核桃购于新疆石河子市农贸市场, 为新疆簿皮核桃品种. 试](/thumbs/93/113305617.jpg) 2011 年 11 月 Nov.2011 第 32 卷第 6 期 Vol.32 No.6 doi:10.3969/j.isn.1671-7775.2011.06.003 不同提取工艺制备的核桃蛋白的组成与结构特征 毛晓英 1,2 1, 华欲飞 (1. 江南大学食品科学与技术国家重点实验室, 江苏无锡 214122;2. 石河子大学食品学院, 新疆石河子 832003) 摘要 : 研究了碱溶酸沉工艺和酸沉工艺制备的核桃蛋白产品的组成和结构特征的变化.
2011 年 11 月 Nov.2011 第 32 卷第 6 期 Vol.32 No.6 doi:10.3969/j.isn.1671-7775.2011.06.003 不同提取工艺制备的核桃蛋白的组成与结构特征 毛晓英 1,2 1, 华欲飞 (1. 江南大学食品科学与技术国家重点实验室, 江苏无锡 214122;2. 石河子大学食品学院, 新疆石河子 832003) 摘要 : 研究了碱溶酸沉工艺和酸沉工艺制备的核桃蛋白产品的组成和结构特征的变化.
厦门大学学位论文原创性声明 兹呈交的学位论文, 是本人在导师指导下独立完成的研究成果 本人在论文写作中参考的其他个人或集体的研究成果, 均在文中以明确方式标明 本人依法享有和承担 由此论文而产生的权利和责任 声明人 ( 签名 ): 年月日 1
 学校编码 :10384 分类号 密级 学号 :B200226012 UDC 厦门大学博士学位论文 南美白对虾 N- 乙酰 -β-d- 氨基葡萄糖苷酶的研究 Studies on the N-Acetyl-β-D-glucosaminidase from Prawn (Penaeus vannamei) 谢晓兰 指导教师姓名 : 陈清西 教授 厦门大学生命科学学院 专业名称 : 生物化学与分子生物学
学校编码 :10384 分类号 密级 学号 :B200226012 UDC 厦门大学博士学位论文 南美白对虾 N- 乙酰 -β-d- 氨基葡萄糖苷酶的研究 Studies on the N-Acetyl-β-D-glucosaminidase from Prawn (Penaeus vannamei) 谢晓兰 指导教师姓名 : 陈清西 教授 厦门大学生命科学学院 专业名称 : 生物化学与分子生物学
性 科 学 性 启 发 性 先 进 性 和 适 用 性 等 原 则 选 用 教 材, 选 用 的 教 材 应 符 合 课 程 教 学 大 纲, 能 够 反 映 学 科 发 展 脉 络 和 趋 势, 满 足 学 校 相 应 专 业 人 才 培 养 的 需 要 第 八 条 任 课 教 师 应 按 照 学
 上 海 交 通 大 学 教 师 教 学 工 作 规 范 (2015 年 5 月 19 日 由 上 海 交 通 大 学 教 学 指 导 委 员 会 会 议 通 过 修 订 ) 为 了 规 范 教 师 的 教 学 行 为, 维 护 正 常 的 教 学 秩 序, 建 设 优 良 的 教 风 学 风, 促 进 教 学 质 量 的 不 断 提 高, 根 据 中 华 人 民 共 和 国 教 师 法 及 其 他
上 海 交 通 大 学 教 师 教 学 工 作 规 范 (2015 年 5 月 19 日 由 上 海 交 通 大 学 教 学 指 导 委 员 会 会 议 通 过 修 订 ) 为 了 规 范 教 师 的 教 学 行 为, 维 护 正 常 的 教 学 秩 序, 建 设 优 良 的 教 风 学 风, 促 进 教 学 质 量 的 不 断 提 高, 根 据 中 华 人 民 共 和 国 教 师 法 及 其 他
,.2018, 38,.1 :1, 220 ( ) 140, ;2,,,;3,,,, >180 ( ) >120,,, [10] :,,,,,,,, ( ), [6,11],,,,,, ( ), ( Ⅱ ),,, ( -6),,,,, -,, [2],, [12],, (
![,.2018, 38,.1 :1, 220 ( ) 140, ;2,,,;3,,,, >180 ( ) >120,,, [10] :,,,,,,,, ( ), [6,11],,,,,, ( ), ( Ⅱ ),,, ( -6),,,,, -,, [2],, [12],, ( ,.2018, 38,.1 :1, 220 ( ) 140, ;2,,,;3,,,, >180 ( ) >120,,, [10] :,,,,,,,, ( ), [6,11],,,,,, ( ), ( Ⅱ ),,, ( -6),,,,, -,, [2],, [12],, (](/thumbs/91/107403329.jpg) 2018 1 38 1,.2018, 38,.1 1 (2017 ),, :,, -:_@.;,, -:@.. ;,, -:@.;,, - :5588@126. [] ; ; ; :10.3969 /..1002-1949.2018.01.001 ( - ), ( ) ( ),,,, 25.2%, 2.7 [1],1% ~2% [2],, 6.9%, 90 11% 37%, 1 /4 [3] 12
2018 1 38 1,.2018, 38,.1 1 (2017 ),, :,, -:_@.;,, -:@.. ;,, -:@.;,, - :5588@126. [] ; ; ; :10.3969 /..1002-1949.2018.01.001 ( - ), ( ) ( ),,,, 25.2%, 2.7 [1],1% ~2% [2],, 6.9%, 90 11% 37%, 1 /4 [3] 12
A. 两种激素都是由八肽环和三肽侧链构成的多肽类化合物 B. 氨基酸之间脱水缩合形成的水分子中氢全部来自氨基 C. 肽链中游离氨基的数目与参与构成肽链的氨基酸种类无关 D. 两种激素间因 2 个氨基酸种类不同导致生理功能不同 答案 D 解析 由图解可知, 两种激素都是由六环肽和三肽侧链构成的多肽化合
 1.(2018 江苏卷,1) 下列关于糖类的叙述, 正确的是 ( ) A. 单糖可以被进一步水解为更简单的化合物 B. 构成淀粉 糖原和纤维素的单体均为果糖 C. 细胞识别与糖蛋白中蛋白质有关, 与糖链无关 D. 糖类是大多数植物体干重中含量最多的化合物 答案 D 2.(2018 江苏卷,2) 脂质与人体健康息息相关, 下列叙述错误的是 ( ) A. 分布在内脏器官周围的脂肪具有缓冲作用 B. 蛇毒中的磷脂酶因水解红细胞膜蛋白而导致溶血
1.(2018 江苏卷,1) 下列关于糖类的叙述, 正确的是 ( ) A. 单糖可以被进一步水解为更简单的化合物 B. 构成淀粉 糖原和纤维素的单体均为果糖 C. 细胞识别与糖蛋白中蛋白质有关, 与糖链无关 D. 糖类是大多数植物体干重中含量最多的化合物 答案 D 2.(2018 江苏卷,2) 脂质与人体健康息息相关, 下列叙述错误的是 ( ) A. 分布在内脏器官周围的脂肪具有缓冲作用 B. 蛇毒中的磷脂酶因水解红细胞膜蛋白而导致溶血
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 病理学与病理生理学 病理学与病理生理学
 2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
2017 年医学院 ( 含转化院 遗传所 ) 硕士研究生入学考成绩 准考证号 报考专业 外语政治业务 1 业务 2 总成绩 备注 103357000912484 病理学与病理生理学 72 72 242 0 386 103357000912003 病理学与病理生理学 71 72 242 0 385 103357000911503 病理学与病理生理学 77 73 234 0 384 103357000911098
考生编号政治政治分外语外语分科目 1 科目 1 分科目 2 科目 2 分总分专业代码专业名称考试方式报名号 思想政治理论缺考英语一 45 生物综合 38 生理学缺考 药理学全国统考 思想政治理论
 100019008910001 思想政治理论缺考英语一 45 生物综合 38 生理学缺考 83 078006 药理学全国统考 110190172 100019008910002 思想政治理论 61 英语一缺考药学综合 ( 缺考生理学 51 112 078006 药理学全国统考 110199187 100019008910003 思想政治理论缺考英语一缺考生物综合缺考 生物化学与分子生物学 缺考 --
100019008910001 思想政治理论缺考英语一 45 生物综合 38 生理学缺考 83 078006 药理学全国统考 110190172 100019008910002 思想政治理论 61 英语一缺考药学综合 ( 缺考生理学 51 112 078006 药理学全国统考 110199187 100019008910003 思想政治理论缺考英语一缺考生物综合缺考 生物化学与分子生物学 缺考 --
<4D6963726F736F667420506F776572506F696E74202D20A960A6CCA5CDA7DEAB4FB0B7A4B6B2D02DC2B2B3F82E707074205BACDBAE65BCD2A6A15D>
 創 辦 人 智 慧 感 言 新 芳 奈 米 科 技 宇 宙 的 誕 生 創 造 了 萬 物 奈 米 科 學 以 實 踐 真 理 為 目 的 不 是 以 利 益 為 權 利 讓 自 己 盲 然 又 可 憐 盡 善 盡 美 永 遠 是 發 明 人 的 夢 想 創 造 人 生 智 慧 的 附 加 價 值 恆 河 世 界 亦 如 微 塵 知 無 常 覺 究 竟 即 所 創 造 元 始 自 然 無 為 發 明
創 辦 人 智 慧 感 言 新 芳 奈 米 科 技 宇 宙 的 誕 生 創 造 了 萬 物 奈 米 科 學 以 實 踐 真 理 為 目 的 不 是 以 利 益 為 權 利 讓 自 己 盲 然 又 可 憐 盡 善 盡 美 永 遠 是 發 明 人 的 夢 想 創 造 人 生 智 慧 的 附 加 價 值 恆 河 世 界 亦 如 微 塵 知 無 常 覺 究 竟 即 所 創 造 元 始 自 然 無 為 發 明
内部刊物 注意保存
 新 高 考 新 思 维 部 刊 物 注 意 保 存 常 德 市 高 三 教 学 工 作 简 报 2015 年 第 3 期 主 管 : 常 德 市 教 育 局 主 办 : 常 德 市 教 科 院 本 期 责 任 编 辑 : 余 亚 洲 肖 焕 之 特 刊 导 读 1. 鼎 城 区 教 研 室 积 极 引 领 各 校 备 战 2016 年 新 高 考 2 2. 如 何 把 握 复 习 课 教 学 中 的
新 高 考 新 思 维 部 刊 物 注 意 保 存 常 德 市 高 三 教 学 工 作 简 报 2015 年 第 3 期 主 管 : 常 德 市 教 育 局 主 办 : 常 德 市 教 科 院 本 期 责 任 编 辑 : 余 亚 洲 肖 焕 之 特 刊 导 读 1. 鼎 城 区 教 研 室 积 极 引 领 各 校 备 战 2016 年 新 高 考 2 2. 如 何 把 握 复 习 课 教 学 中 的
中国科学技术大学 材料工程 05 校外调剂 0870 化学工程 吉林大学 应用化学 05 校外调剂 0870 化学工程 四川大学 制药
 045700000787 东北大学 07030 分析化学 05 校外调剂 07030 无机化学 68 66 94 04 34 063700000004 沈阳药科大学 07030 分析化学 04 校内跨专业调剂 070303 有机化学 73 56 9 00 30 0007008903 北京大学 0780Z 药学类 05 校外调剂 070303 有机化学 75 67 09 8 4 085750830 苏州大学
045700000787 东北大学 07030 分析化学 05 校外调剂 07030 无机化学 68 66 94 04 34 063700000004 沈阳药科大学 07030 分析化学 04 校内跨专业调剂 070303 有机化学 73 56 9 00 30 0007008903 北京大学 0780Z 药学类 05 校外调剂 070303 有机化学 75 67 09 8 4 085750830 苏州大学
2 鲍大鹏, 等 : 灵芝中真菌免疫调节蛋白 LZ 8 和 LZ 9 的比较分析 过敏反应等免疫调节作用 [2], 且对机体正常细胞和组织的毒性极小, 已成为天然产物研究的热点之一 真菌免疫调节蛋白的同源性很高, 氨基酸序列相似性在 54% 100%, 包含 个氨基酸残基, 分子量在
![2 鲍大鹏, 等 : 灵芝中真菌免疫调节蛋白 LZ 8 和 LZ 9 的比较分析 过敏反应等免疫调节作用 [2], 且对机体正常细胞和组织的毒性极小, 已成为天然产物研究的热点之一 真菌免疫调节蛋白的同源性很高, 氨基酸序列相似性在 54% 100%, 包含 个氨基酸残基, 分子量在 2 鲍大鹏, 等 : 灵芝中真菌免疫调节蛋白 LZ 8 和 LZ 9 的比较分析 过敏反应等免疫调节作用 [2], 且对机体正常细胞和组织的毒性极小, 已成为天然产物研究的热点之一 真菌免疫调节蛋白的同源性很高, 氨基酸序列相似性在 54% 100%, 包含 个氨基酸残基, 分子量在](/thumbs/93/112780930.jpg) 7 上海农业学报 A A S DOI? j 7 文章编号 的比较分析 灵芝中真菌免疫调节蛋白 鲍大鹏 白 睿 高英女 李 燕 王 莹 国家食用菌工程技术研究中心 农业部南方食用菌资源利用重点实验室 上海市农业遗传育种重点开放实验室 6 上海市农业科学院食用菌研究所 上海 上海海洋大学食品学院 上海 摘 要 利用生物信息学方法从蛋白质基本理化特性蛋白质三维结构以及蛋白表面电荷性质等方面 对 进行了预测和比较分析
7 上海农业学报 A A S DOI? j 7 文章编号 的比较分析 灵芝中真菌免疫调节蛋白 鲍大鹏 白 睿 高英女 李 燕 王 莹 国家食用菌工程技术研究中心 农业部南方食用菌资源利用重点实验室 上海市农业遗传育种重点开放实验室 6 上海市农业科学院食用菌研究所 上海 上海海洋大学食品学院 上海 摘 要 利用生物信息学方法从蛋白质基本理化特性蛋白质三维结构以及蛋白表面电荷性质等方面 对 进行了预测和比较分析
964 应用化学第 30 卷 水平下进行优化 CPCM 计算中的水溶剂参数, 如介电常数 溶剂半径, 采用程序提供的默认值 全部计 [19] 算均采用 Gausian03 软件包完成 Cr 3+ 和 Cr 6+ 分别采用自旋多重度设为 5 4 和 1 2 结果与分析 GSH 是柔性分子, 在气相和液
![964 应用化学第 30 卷 水平下进行优化 CPCM 计算中的水溶剂参数, 如介电常数 溶剂半径, 采用程序提供的默认值 全部计 [19] 算均采用 Gausian03 软件包完成 Cr 3+ 和 Cr 6+ 分别采用自旋多重度设为 5 4 和 1 2 结果与分析 GSH 是柔性分子, 在气相和液 964 应用化学第 30 卷 水平下进行优化 CPCM 计算中的水溶剂参数, 如介电常数 溶剂半径, 采用程序提供的默认值 全部计 [19] 算均采用 Gausian03 软件包完成 Cr 3+ 和 Cr 6+ 分别采用自旋多重度设为 5 4 和 1 2 结果与分析 GSH 是柔性分子, 在气相和液](/thumbs/91/106659851.jpg) 第 30 卷第 8 期 应用化学 Vol.30Is.8 2013 年 8 月 CHINESEJOURNALOFAPPLIEDCHEMISTRY Aug.2013 密度泛函研究不同价态金属铬离子与谷胱甘肽相互作用 a,b 刘建华 李 a 燕 a 王海军 ( a 江南大学化工与材料工程学院无锡 214122; b 宜宾学院化学与化工学院宜宾 644000) 摘要采用密度泛函 DFT/B3LYP 方法,
第 30 卷第 8 期 应用化学 Vol.30Is.8 2013 年 8 月 CHINESEJOURNALOFAPPLIEDCHEMISTRY Aug.2013 密度泛函研究不同价态金属铬离子与谷胱甘肽相互作用 a,b 刘建华 李 a 燕 a 王海军 ( a 江南大学化工与材料工程学院无锡 214122; b 宜宾学院化学与化工学院宜宾 644000) 摘要采用密度泛函 DFT/B3LYP 方法,
材料 方法
 生物技术通报 张发洲 杨慧兰 为了构建单纯疱疹病毒 型 感染细胞多肽 真核表达质粒 应用 技术从 株 的基因组中扩增 基因 并连接至真核表达载体 对阳性克隆进行菌落 酶切和测序鉴定后 成功构建了重 组质粒 用 转染试剂盒将重组质粒 转染至 细胞中 并用 及 检测其表达情况 结果显示 基因在 细胞中得到正确表达 真核表达质粒 的构建成功 为进 一步研究 对宿主细胞的影响奠定了基础 单纯疱疹病毒 型 感染细胞多肽
生物技术通报 张发洲 杨慧兰 为了构建单纯疱疹病毒 型 感染细胞多肽 真核表达质粒 应用 技术从 株 的基因组中扩增 基因 并连接至真核表达载体 对阳性克隆进行菌落 酶切和测序鉴定后 成功构建了重 组质粒 用 转染试剂盒将重组质粒 转染至 细胞中 并用 及 检测其表达情况 结果显示 基因在 细胞中得到正确表达 真核表达质粒 的构建成功 为进 一步研究 对宿主细胞的影响奠定了基础 单纯疱疹病毒 型 感染细胞多肽
2007
 77 266071 http / /www. qdpub. com 13335059110 0532 85814750 85814611-8664 2006 9 7 2006 9 7 16 787mm 1092mm 7. 5 190 ISBN 7-5436 - 2241-6 7. 50 0532 85814926 0532 85814611-8628 2007 1!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
77 266071 http / /www. qdpub. com 13335059110 0532 85814750 85814611-8664 2006 9 7 2006 9 7 16 787mm 1092mm 7. 5 190 ISBN 7-5436 - 2241-6 7. 50 0532 85814926 0532 85814611-8628 2007 1!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
黄金时期 ( 本世纪初 ): 后基因组时期我国科学家的贡献 :1965 年, 人工合成全生物活性结晶牛胰岛素 :1981 年, 人工合成具有生物活性的酵母丙氨酰 trna: 参与了人类基因组计划 (1%) 等等 ( 三 ) 生物化学与分子生物学及各专业的关系分子生物学 (Molecular Biol
 普通生物化学 ( 上篇 ) 绪论重点 : 生物化学的概念 研究内容 ; 生物化学的研究发展简史 ; 生物化学与分子生物学及各专业的关系 ( 一 ) 生物化学的概念 研究内容概念 : 生物化学 (Biochemistry) 介于生物与化学之间的边缘学科, 研究活细胞和有机体中存在的各种化学成分及其所参与的化学反应, 是研究生命现象化学基础的一门科学 研究内容 : 静态生物化学 : 构成生物体的基本物质
普通生物化学 ( 上篇 ) 绪论重点 : 生物化学的概念 研究内容 ; 生物化学的研究发展简史 ; 生物化学与分子生物学及各专业的关系 ( 一 ) 生物化学的概念 研究内容概念 : 生物化学 (Biochemistry) 介于生物与化学之间的边缘学科, 研究活细胞和有机体中存在的各种化学成分及其所参与的化学反应, 是研究生命现象化学基础的一门科学 研究内容 : 静态生物化学 : 构成生物体的基本物质
标题
 第 39 卷第 9 期西南大学学报 ( 自然科学版 ) 2017 年 9 月 Vol.39 No.9 JournalofSouthwestUniversity (NaturalScienceEdition) Seṗ 2017 DOI:10.13718/j.cnki.xdzk.2017.09.019 1 基于木瓜蛋白酶过氧化物酶活性检测谷胱甘肽 庞妍娇, 于媛媛, 郑鹄志, 隆异娟 西南大学化学化工学院,
第 39 卷第 9 期西南大学学报 ( 自然科学版 ) 2017 年 9 月 Vol.39 No.9 JournalofSouthwestUniversity (NaturalScienceEdition) Seṗ 2017 DOI:10.13718/j.cnki.xdzk.2017.09.019 1 基于木瓜蛋白酶过氧化物酶活性检测谷胱甘肽 庞妍娇, 于媛媛, 郑鹄志, 隆异娟 西南大学化学化工学院,
蛋白质生物合成
 蛋白质生物合成 一级要求 单选题 1 真核生物在蛋白质生物合成中的启始 trn 是 亮氨酸 Trna 丙氨酸 trn 赖氨酸 trn 甲酰蛋氨酸 trn 蛋氨酸 trn 2 原核生物蛋白质生物合成中肽链延长所需的能量来源于 TP GTP GP UTP TP 3 哺乳动物核蛋白体大亚基的沉降常数是 40S 70S 30S 80S 60S 4 下列关于氨基酸密码的叙述哪一项是正确的 由 N 链中相邻的三个核苷酸组成
蛋白质生物合成 一级要求 单选题 1 真核生物在蛋白质生物合成中的启始 trn 是 亮氨酸 Trna 丙氨酸 trn 赖氨酸 trn 甲酰蛋氨酸 trn 蛋氨酸 trn 2 原核生物蛋白质生物合成中肽链延长所需的能量来源于 TP GTP GP UTP TP 3 哺乳动物核蛋白体大亚基的沉降常数是 40S 70S 30S 80S 60S 4 下列关于氨基酸密码的叙述哪一项是正确的 由 N 链中相邻的三个核苷酸组成
%! # # % % & # ( ) ( +, & +, +, & +, & +, +, &!
 %! # # % % & # ( ) ( +, & +, +, & +, & +, +, &! & &./ 0 # #1 # 2! +, 3 4 4 +,!!!! 4 4 4 4 4 56 7 89 #! 4! 4 4! 4 4! 14 #: 2 4! +,! +, 14 4 ; < = ( 4 < = +14 # : 1 1 4 # : : 3 # (4,! / +, +, +, > +,? 3
%! # # % % & # ( ) ( +, & +, +, & +, & +, +, &! & &./ 0 # #1 # 2! +, 3 4 4 +,!!!! 4 4 4 4 4 56 7 89 #! 4! 4 4! 4 4! 14 #: 2 4! +,! +, 14 4 ; < = ( 4 < = +14 # : 1 1 4 # : : 3 # (4,! / +, +, +, > +,? 3
<4D F736F F F696E74202D D5E6BACBC9FACEEFB5C4BBF9D2F2B1EDB4EFD3EBB5F7BFD820A3A8B6FEA3A9>
 分子生物学 第八章基因的表达与调控 ( 下 ) 真核基因表达调控模式 第二节真核基因表达的转录水平调控 夏玉琼 2013-11 2 真核细胞的基因表达与原核细胞的不同点 一条成熟的 mrna 链只能翻译一条多肽链 DNA 与组蛋白和非组蛋白结合, 小部分裸露 DNA 大部分不转录 有序地根据生长发育阶段的需要进行 DNA 片段重排 基因转录的调节区很大 转录和翻译有严格的空间间隔 基因只有经过复杂的成熟和剪接过程,
分子生物学 第八章基因的表达与调控 ( 下 ) 真核基因表达调控模式 第二节真核基因表达的转录水平调控 夏玉琼 2013-11 2 真核细胞的基因表达与原核细胞的不同点 一条成熟的 mrna 链只能翻译一条多肽链 DNA 与组蛋白和非组蛋白结合, 小部分裸露 DNA 大部分不转录 有序地根据生长发育阶段的需要进行 DNA 片段重排 基因转录的调节区很大 转录和翻译有严格的空间间隔 基因只有经过复杂的成熟和剪接过程,
生物化学习题(答案不太全)
 1 2 1 2 3 4 5 6 7 8 a- b- 9 10 11 R 12 13 NH2 COOH 14 N- C- 15 16 17 18 1. 2. 3. 4.a- 1 A B C D E 1( ) A B C D E 2 ( ) A B C D E 3 ( ) A B C ADP D 1 3 E 4 ( ) A IMP B AMP C GMP D XMP E ATP 5 SCOA ( ) A
1 2 1 2 3 4 5 6 7 8 a- b- 9 10 11 R 12 13 NH2 COOH 14 N- C- 15 16 17 18 1. 2. 3. 4.a- 1 A B C D E 1( ) A B C D E 2 ( ) A B C D E 3 ( ) A B C ADP D 1 3 E 4 ( ) A IMP B AMP C GMP D XMP E ATP 5 SCOA ( ) A
! "! " (!!!"$ $ %!" %!"!& (& )*!(++,)-.) / $)!"$ % " &!"$!"$!"$ $ ( & ) * +!"$ % &.0 & " ( + %!"$! "!"$!/3 1!6" $!"$!"$!"!>!"!! G-& -. 5)-& $/
 !"" $!"!""!"$%&% ()*$+, (-!"*(.+/(0*+1"2 $%&!$ (% % %$& %&( ) ( ) ) ( ) ( )! ) ( (!"""+!!!"""+! ) 9:; (& 9;
!"" $!"!""!"$%&% ()*$+, (-!"*(.+/(0*+1"2 $%&!$ (% % %$& %&( ) ( ) ) ( ) ( )! ) ( (!"""+!!!"""+! ) 9:; (& 9;
# ( + + # + # 6 +,! + # +! +, + # ( + ) ( + ( + ) + 7! + # + /8 + ) ( +! + #. + ( +, +! + # + # + + ( ! ( + ) ( + ) +, + ( + 9% +! +, + ( +
 ! ## % & (! ) # (! + ) (, ( + ) ( +! ( + + # + #! + ( + + ( + ) ( + + ( + # + ) +! ( + ( + # +! ( + ) + # ( + ) + # +! ( +. + / 0. + ( + # + # + +, + ) + + ) + 1!, ( 2 1 # 3 )! # ( 4 5 #3 (! # ( 4 # #
! ## % & (! ) # (! + ) (, ( + ) ( +! ( + + # + #! + ( + + ( + ) ( + + ( + # + ) +! ( + ( + # +! ( + ) + # ( + ) + # +! ( +. + / 0. + ( + # + # + +, + ) + + ) + 1!, ( 2 1 # 3 )! # ( 4 5 #3 (! # ( 4 # #
Qubit-DNA RNA 总浓度测定 dsdna BR Assay Kits 各试剂加样量 : Buffer 标准 1 标准 2 样品 试剂 ( 荧光染色 ) 总量 ( 溶液体积 ) 50 或 250ml 1 或 5ml 1 或 5ml 待测 250µl 或 1.25ml 原始浓度 未知 0 ng
 Qubit-DNA RNA 总浓度测定 dsdna BR Assay Kits 各试剂加样量 : 总量 ( 溶液体积 ) 50 或 250ml 1 或 5ml 1 或 5ml 待测 250µl 或 1.25ml 原始浓度 未知 0 ng/μl 100 ng/μl 待测 200 测定时要求浓度 未知 0 ng/μl 5000ng/ml 0~5000 ng/ml 1 备注 -Buffer:Qubit dsdna
Qubit-DNA RNA 总浓度测定 dsdna BR Assay Kits 各试剂加样量 : 总量 ( 溶液体积 ) 50 或 250ml 1 或 5ml 1 或 5ml 待测 250µl 或 1.25ml 原始浓度 未知 0 ng/μl 100 ng/μl 待测 200 测定时要求浓度 未知 0 ng/μl 5000ng/ml 0~5000 ng/ml 1 备注 -Buffer:Qubit dsdna
, Vol.34, No.21 nm nm nm nm μm μm μm a b c d e
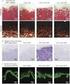 2013, Vol.34, No.21 359 Abstract Key words TS201.2 A 360 2013, Vol.34, No.21 nm nm nm nm μm μm μm a b c d e 2013, Vol.34, No.21 361 362 2013, Vol.34, No.21 ph ph 2013, Vol.34, No.21 363 () (1) (2) (SiO
2013, Vol.34, No.21 359 Abstract Key words TS201.2 A 360 2013, Vol.34, No.21 nm nm nm nm μm μm μm a b c d e 2013, Vol.34, No.21 361 362 2013, Vol.34, No.21 ph ph 2013, Vol.34, No.21 363 () (1) (2) (SiO



